Содержание
- 2. Задачи: познакомиться с типами химических связей ; научиться определять по молекулярной формуле соединения тип связей в
- 3. Что такое химическая связь? Химическая связь - это взаимодействие атомов, которое связывает их в молекулы, ионы,
- 4. Различают четыре типа химических связей: Ионная связь. Ковалентная связь. Металлическая связь. Водородная связь.
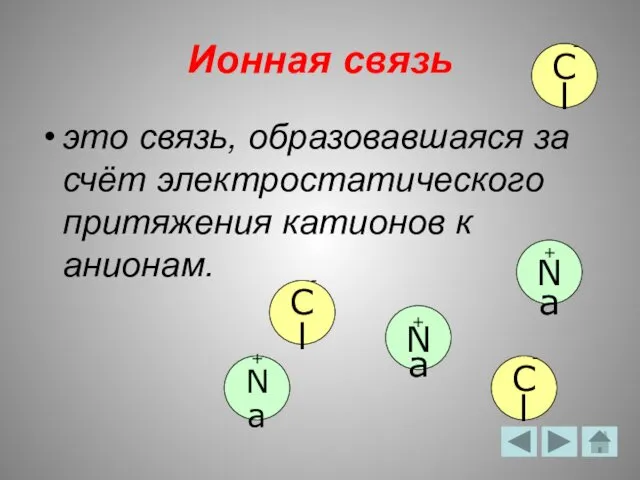
- 5. Ионная связь это связь, образовавшаяся за счёт электростатического притяжения катионов к анионам. + Na - Cl
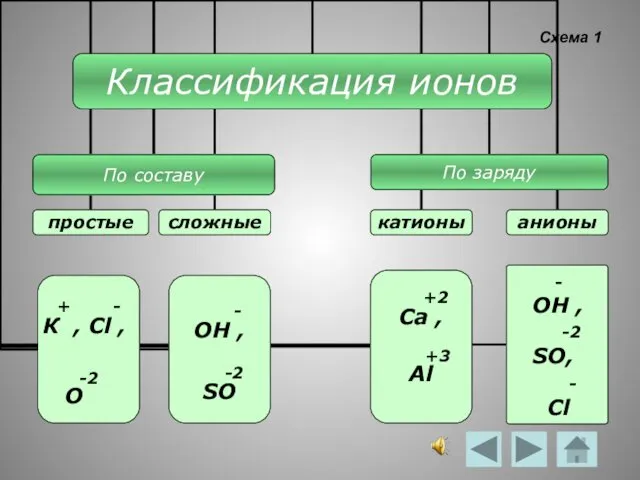
- 6. Схема 1 - ОН , -2 SO, - Cl
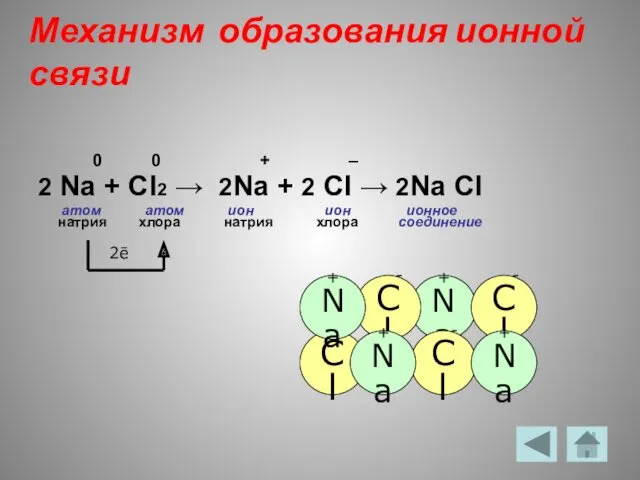
- 7. Механизм образования ионной связи 0 0 + – 2 Na + Cl2 → 2Na + 2
- 8. Ковалентная связь это связь, возникает между атомами за счёт образования общих электронных пар. ē ē ē
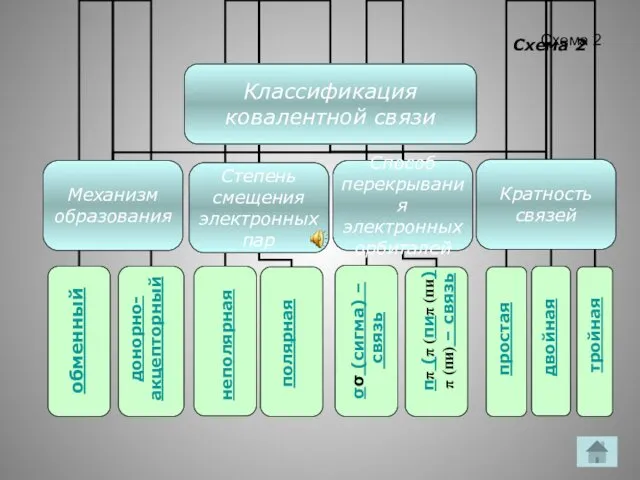
- 9. Схема 2 обменный донорно- акцепторный полярная неполярная σσ (сигма) – связь ππ (π (пиπ (пи)π (пи)
- 10. Обменный механизм образования ковалентной связи ☼ Действует, когда атомы образуют общие электронные пары за счёт объединения
- 11. Донорно-акцепторный механизм образования ковалентной связи ☼ Действует между веществами донором и акцептором. Донор – вещество, у
- 12. Степень смещения электронных пар ☼Зависит от ЭЛЕКТРООТРИЦАТЕЛЬНОСТИ элементов. Ряд электроотрицательности: F, O, N, C l, Br,
- 13. Кратность ковалентной связи ☼Зависит от числа общих электронных пар, связывающих атомы. Бывает: ПРОСТАЯ « - »
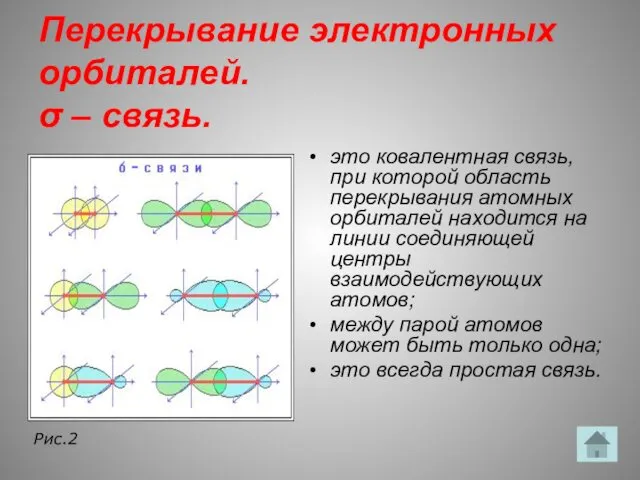
- 14. Перекрывание электронных орбиталей. σ – связь. это ковалентная связь, при которой область перекрывания атомных орбиталей находится
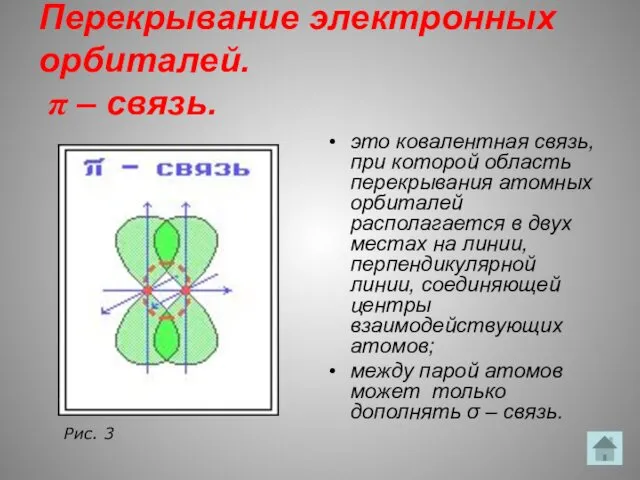
- 15. Перекрывание электронных орбиталей. π – связь. это ковалентная связь, при которой область перекрывания атомных орбиталей располагается
- 16. Металлическая связь это связь, которую осуществляют относительно свободные электроны между ионами металлов в металлической решётке. n+
- 17. Механизм образования металлической связи: 0 n+ М - nē = М Например: для элементов (металлов) Ι
- 18. Водородная связь Межмолекулярная водородная связь – это связь между атомами водорода одной молекулы и сильноотрицательными элементами(O,
- 20. Скачать презентацию











 Сочинение по данному началу. Моё утро
Сочинение по данному началу. Моё утро Коммуникативная , социальная, эмоционально-волевая готовность детей к школьному обучению
Коммуникативная , социальная, эмоционально-волевая готовность детей к школьному обучению Угловые соединения
Угловые соединения План-конспект внеклассного мероприятия в 1 классе по теме: Осенины.
План-конспект внеклассного мероприятия в 1 классе по теме: Осенины. Культура освоения новой технологии. Руководитель ШППО Бейбулатова Е.А.
Культура освоения новой технологии. Руководитель ШППО Бейбулатова Е.А. Великая Отечественная Война
Великая Отечественная Война Формы взаимодействия психолога с коллективом
Формы взаимодействия психолога с коллективом Церковь Иль - Джезу
Церковь Иль - Джезу Миф о Йиркапе
Миф о Йиркапе Прохождение практики ООО Виал Комфорт
Прохождение практики ООО Виал Комфорт Понятия и уравнения кинематики
Понятия и уравнения кинематики Теории происхождения нефти и газа – основа прогнозирования перспектив нефтеносности недр
Теории происхождения нефти и газа – основа прогнозирования перспектив нефтеносности недр Поделки из помпонов
Поделки из помпонов Автоматизация звука [Р] в середине слова (интервокальная позиция)
Автоматизация звука [Р] в середине слова (интервокальная позиция) Я и мой школьный спортивный клуб. Ясырева Елена
Я и мой школьный спортивный клуб. Ясырева Елена Формирование личностной идентичности человека
Формирование личностной идентичности человека Презентация Дерево моей семьи
Презентация Дерево моей семьи General equilibrium in the open (trading) economy
General equilibrium in the open (trading) economy Петр Алексеевич (Первый) Романов
Петр Алексеевич (Первый) Романов Развитие критического мышления у учащихся
Развитие критического мышления у учащихся Кілегей қабықтын жарақаттаушы әсерлерден зақымдануы. Лейкоплакия
Кілегей қабықтын жарақаттаушы әсерлерден зақымдануы. Лейкоплакия Родительское собрание
Родительское собрание Презентация Les inventions françaises
Презентация Les inventions françaises винокуров презентация
винокуров презентация Сталь. Свойства
Сталь. Свойства С праздником 8 марта
С праздником 8 марта Рождественские узоры Поволжья. Порядок участия в Межрегиональной выставке-ярмарке
Рождественские узоры Поволжья. Порядок участия в Межрегиональной выставке-ярмарке Геохимия урана и тория в осадочном процессе
Геохимия урана и тория в осадочном процессе