Слайд 2

Кейбір тұздардың суда диссоциацияланғанда түзілген гидраттанған катиондары немесе аниондарының су молекуласымен
сәйкесінше қышқылды немесе сілтілі орта түзе әрекеттесуі тұздардың гидролизі деп аталады.
Слайд 3

Сандық жағынан гидролизді гидролиздену дәрежесі (h) арқылы өрнектейді
h=гидролизденген молекулар саны
молекулалардың жалпы саны
Температураны арттырып және ерітінді сұйылту арқылы гидролиздену дәрежесін өсіруге болады.
Слайд 4

Гидролиз процесіне құрамында әлсіз қышқыл немесе әлсіз негіздің иондары бар тұздар
ғана түседі. Ал күшті қышқылдар мен күшті негіздердің әрекеттесуінен түзілген тұздар (NaCl, KNO3, BaCl2 және т.б.) гидролизденбейді. Себебі, олардың гидраттанған иондары су молекуласымен әрекеттеспейді және нәтижесінде әлсіз электролит түзілмейді.
Слайд 5

Тұздардың табиғатына байланысты үш түрлі
гидролиздену реакциясы болады:
1. Күшті қышқыл мен
әлсіз негіздің әрекеттесуінен түзілген тұздардың CuCl2, NH4Cl, Al2(SO4)3 және т.б. гидролизі. Бұл жағдайда гидролиз реакциясына, яғни тұздың құрамындағы гидраттанған катион мен су молекуласы әрекеттеседі де, нәтижесінде түзілген оксоний ионына байланысты ерітінді қышқылды (рН < 7) болады. Мысалы AlCl3 тұзы суда ерігенде диссоциацияланып, иондарға толық ыдырайды:
Диссоциациялану теңдеуі:
AlCl3 → Al3+ + 3Cl-
HOH → H+ + OH
Al3+ + 3Cl- + HOH → Al(OH)2+ + H+ + 3Cl-
Гидролиз реакциясының иондық теңдеуі:
Al3+ + 3Cl- + HOH → Al(OH)2+ + H+ + 3Cl-
Гидролиз реакциясының молекулалық теңдеуі:
AlCl3 + H2O → Al(OH)Cl2 + HCl
Ерітіндіде Al3+ ионы су молекуласынан гидроксид-ионды OH- оңай қосып алып, өте нашар диссоциацияланатын (Al(OH)3-ке қарағанда) Al(OH)2+ ионына ауысады. Мұның нәтижесінде судың келесі молекуласы диссоциацияланады. Сонымен, ерітіндіде сутегі иондарының көбеюіне әсер етеді.
Слайд 6
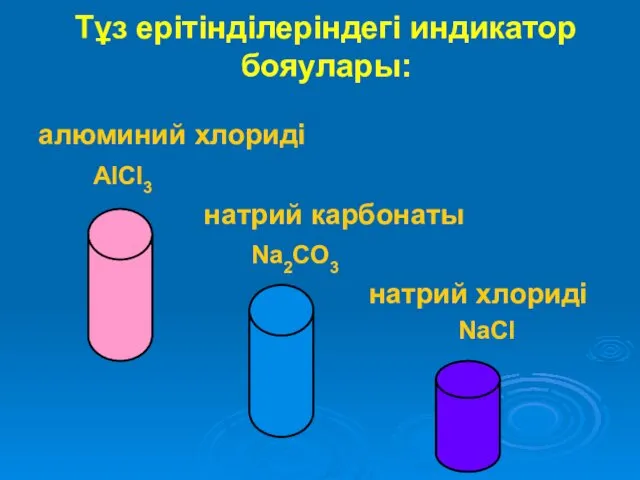
Тұз ерітінділеріндегі индикатор бояулары:
алюминий хлориді
AlCl3
натрий карбонаты
Na2CO3
натрий хлориді
NaCl
Слайд 7
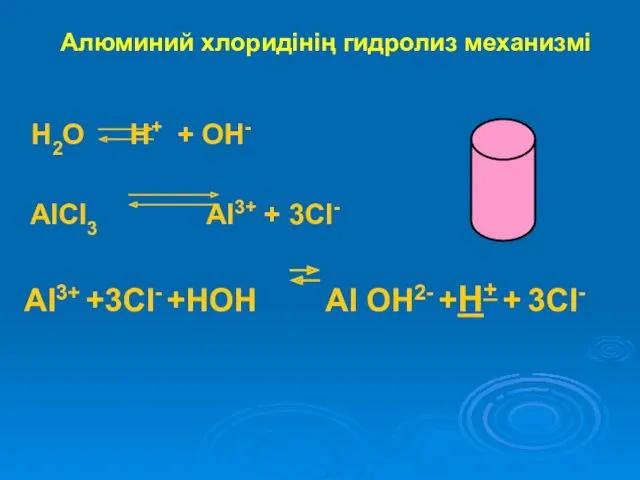
Алюминий хлоридінің гидролиз механизмі
H2O H+ + OH-
AlCl3 Al3+ +
3Cl-
Al3+ +3Cl- +HOH Al OH2- +H+ + 3Cl-
Слайд 8
![Алюминий хлоридінің гидролиз сызбасы AlCl3 Al(OH)3 HCl әлсіз негіз күшті қышқыл [OH]- ҚЫШҚЫЛДЫ ОРТА](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/27065/slide-7.jpg)
Алюминий хлоридінің гидролиз сызбасы
AlCl3
Al(OH)3 HCl
әлсіз негіз күшті қышқыл
[OH]-
< [H]+
ҚЫШҚЫЛДЫ ОРТА
Слайд 9

2. Әлсіз қышқыл мен күшті негіздердің әрекеттесуінен түзілген тұздардың CH3COONa, Na2CO3,
KCN, Na2SO3, KNO2 және т.б. гидролизі. Бұл жағдайда гидролиз реакциясына тұздың құрамындағы әлсіз қышқылдың қалдығы болып саналатын гидраттанған анион түседі де, нәтижесінде ерітінді сілтілі (рН > 7) болады.
Диссоциациялану теңдеуі:
Na2CO3 ⇄ 2Na+ + CO32-
H2O ⇄ H+ + OH-
2Na+ + CO32- + HOH ⇄ 2Na+ + HCO3- + OH-
Гидролиз реакциясының иондық теңдеуі:
2Na+ + CO32- + HOH ⇄ 2Na+ + HCO3- + OH-
Гидролиз реакциясының молекулалық теңдеуі:
Na2CO3 + H2O ⇄ NaOH + NaHCO3
Слайд 10
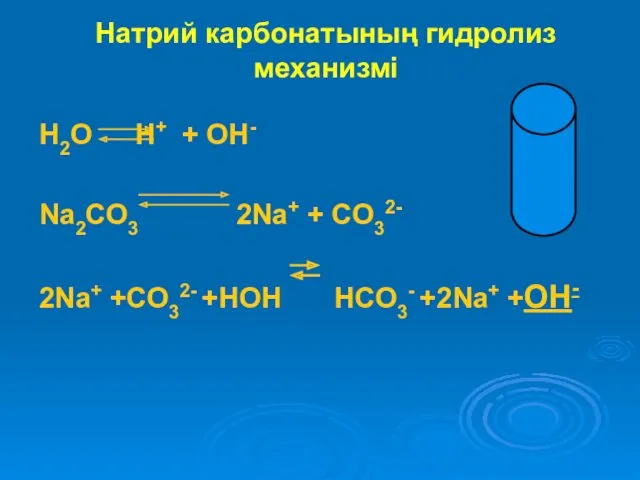
Натрий карбонатының гидролиз механизмі
H2O H+ + OH-
Na2CO3 2Na+ + CO32-
2Na+ +CO32-
+HOH HCO3- +2Na+ +OH-
Слайд 11
![Натрий карбонатының гидролиз сызбасы Na2CO3 NaOH H2CO3 күшті негіз әлсіз қышқыл [OH]- > [H]+ СІЛТІЛІ ОРТА](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/27065/slide-10.jpg)
Натрий карбонатының гидролиз сызбасы
Na2CO3
NaOH H2CO3
күшті негіз әлсіз қышқыл
[OH]-
> [H]+
СІЛТІЛІ ОРТА
Слайд 12
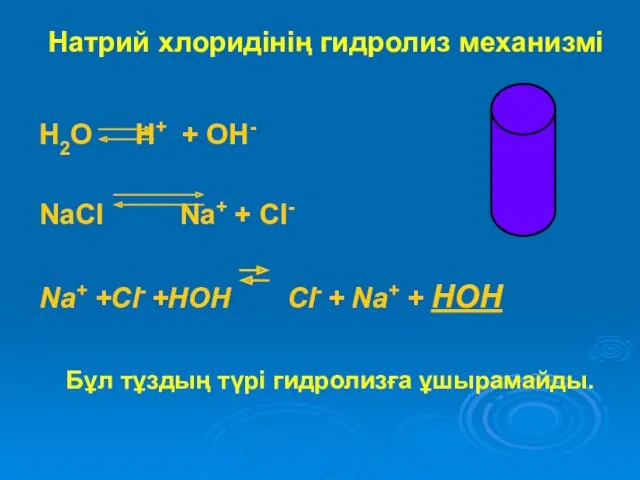
Натрий хлоридінің гидролиз механизмі
H2O H+ + OH-
NaСl Na+ + Cl-
Na+ +Cl-
+HOH Cl- + Na+ + HOH
Бұл тұздың түрі гидролизға ұшырамайды.
Слайд 13
![Натрий хлоридінің гидролиз сызбасы NaCl NaOH HCl күшті негіз күшті қышқыл [OH]- = [H]+ БЕЙТАРАП ОРТА](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/27065/slide-12.jpg)
Натрий хлоридінің гидролиз сызбасы
NaCl
NaOH HCl
күшті негіз күшті қышқыл
[OH]-
= [H]+
БЕЙТАРАП ОРТА
Слайд 14

3. Әлсіз негіз бен әлсіз қышқылдан түзілген тұздар да гидролизге ұшырайды.
Бұл жағдайда гидролиздену процесі соңына дейін жүріп, қышқыл мен негіз түзіледі. Мысалы, алюминий сульфиді Al2S3 сумен әрекеттескенде алюминий гидроксиді Al(OH)3 мен күкіртсутек H2S түзіліп, гидролиздену реакциясы қайтымсыз болады:
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑
Олай болса, тұздардың гидролизге ұшырауы, олардың иондарының құрамы мен мен қасиетіне байланысты.
Слайд 15

Гидролиздің қоғамдық өмірдегі мәні
Шикі бағалы өнімдерді даярлау (қағаз, сабын, спирт, глюкоза,
ақуыздық ашытқылар)
Өндірістік ағыс және ішімдік суларды тазалау
(алюминий сульфаты + алюминий гидроксиді)
Маталарды бояуға даярлау
Слайд 16

Гидролиздің күнделікті адам өміріндегі рөлі
Кір жуу
Ыдыс-аяқ жуу
Сабынмен жуыну
Ас қорыту процессі






![Алюминий хлоридінің гидролиз сызбасы AlCl3 Al(OH)3 HCl әлсіз негіз күшті қышқыл [OH]- ҚЫШҚЫЛДЫ ОРТА](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/27065/slide-7.jpg)


![Натрий карбонатының гидролиз сызбасы Na2CO3 NaOH H2CO3 күшті негіз әлсіз қышқыл [OH]- > [H]+ СІЛТІЛІ ОРТА](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/27065/slide-10.jpg)

![Натрий хлоридінің гидролиз сызбасы NaCl NaOH HCl күшті негіз күшті қышқыл [OH]- = [H]+ БЕЙТАРАП ОРТА](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/27065/slide-12.jpg)



 Физиологические механизмы развития тренированности
Физиологические механизмы развития тренированности Реформация – новое отношение к миру, обновление христианства
Реформация – новое отношение к миру, обновление христианства Phonetic drill remember!
Phonetic drill remember! Использование невербальных средств в речевом общении
Использование невербальных средств в речевом общении Методические рекомендации деятельности педагога дополнительного образования в межаттестационный период
Методические рекомендации деятельности педагога дополнительного образования в межаттестационный период Урок по ПДД. 4класс
Урок по ПДД. 4класс Сколько звуков в слове
Сколько звуков в слове Компьютерная графика
Компьютерная графика Compare photos
Compare photos Занятие учебной практики. Дверные петли Врезка дверных петель
Занятие учебной практики. Дверные петли Врезка дверных петель Проценты в виде десятичной дроби
Проценты в виде десятичной дроби Weather - two word adjectives, collocations; causative verbs
Weather - two word adjectives, collocations; causative verbs Биохимия крови
Биохимия крови Строение и функции головного мозга
Строение и функции головного мозга Презентация (1)
Презентация (1) Упрощение выражений
Упрощение выражений О Fit service 2021. Федереальная международная сеть автосервисов
О Fit service 2021. Федереальная международная сеть автосервисов Газетница для хранения газет и журналов
Газетница для хранения газет и журналов Презентация Новогоднее оформление группы в детском саду
Презентация Новогоднее оформление группы в детском саду Проект прогулочный площадки
Проект прогулочный площадки Биография М.Е. Салтыкова-Щедрина
Биография М.Е. Салтыкова-Щедрина Влияние скорости охлаждения при затвердевании на структуру сплавов
Влияние скорости охлаждения при затвердевании на структуру сплавов История создания романа Война и мир. Особенности жанра
История создания романа Война и мир. Особенности жанра Наша Галактика
Наша Галактика день семьи
день семьи История искусств в системе современного гуманитарного знания
История искусств в системе современного гуманитарного знания Планирование и организация рекламной компании ООО ТК-ПРОФИ
Планирование и организация рекламной компании ООО ТК-ПРОФИ Участие медицинской сестры в организации ухода за больными с пневмонией
Участие медицинской сестры в организации ухода за больными с пневмонией