Содержание
- 2. Общая характеристика металлов Цель урока: дать общую характеристику металлов и способов их получения на основе строения
- 3. План урока Строение атомов металлов Нахождение в природе Способы получения металлов Физические свойства Химические свойства
- 4. Строение атомов металлов Задание. Составьте электронные схемы атомов натрия, кальция и алюминия. Na 2e, 8e,1e Ca
- 5. Ртуть Медь Железо Золото
- 6. 2. Нахождение в природе а) в самородном виде Au, Pt, Hg, Ag б) в виде соединений
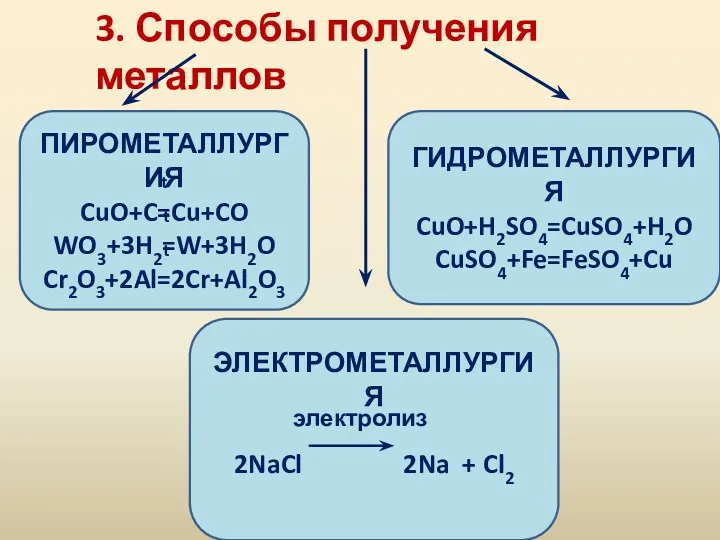
- 7. 3. Способы получения металлов ПИРОМЕТАЛЛУРГИЯ CuO+C=Cu+CO WO3+3H2=W+3H2O Cr2O3+2Al=2Cr+Al2O3 ЭЛЕКТРОМЕТАЛЛУРГИЯ 2NaCl 2Na + Cl2 ГИДРОМЕТАЛЛУРГИЯ CuO+H2SO4=CuSO4+H2O CuSO4+Fe=FeSO4+Cu
- 8. 1. Составьте уравнения реакций промышленных способов получения металлов: а) цинка из сульфида цинка; б) калия из
- 9. непрозрачные, твердые (кроме ртути) металлическая кристаллическая решетка имеют металлический блеск электро- и теплопроводны ковкие, пластичные по
- 10. Химические свойства металлов Ме⁰– ne → Me⁺ n Взаимодействие с неметаллами а) с галогенами 2Ме +
- 11. Химические свойства металлов 2) Взаимодействие со сложными веществами а) с водой 2Na+2H2O=2NaOH+H2 Ca+H2O= Mg+H2O= Al+H2O= б)
- 12. Запишите уравнения реакций, соответствующих следующим превращениям: а) Сu→ Сu(NO3)2 →СuО→ СuSO4 →Сu(ОН)2 б) ZnS→ ZnO →ZnSO4
- 13. Задания для самостоятельной работы 1. 2. 3.
- 15. Скачать презентацию











 Сказки для детей Колобок
Сказки для детей Колобок Ценность, деньги, цена
Ценность, деньги, цена Влияние скорости охлаждения при затвердевании на структуру сплавов
Влияние скорости охлаждения при затвердевании на структуру сплавов Шинель
Шинель Исследовательская работа Опалённые войной
Исследовательская работа Опалённые войной Исследовательский проект на тему Кошки – домашние животные
Исследовательский проект на тему Кошки – домашние животные Богослужебные тексты. Чтение Евангелия на богослужении
Богослужебные тексты. Чтение Евангелия на богослужении Технологические процессы обработки воды
Технологические процессы обработки воды Решение задач по химии (ОГЭ, ЕГЭ, Олимпиады)
Решение задач по химии (ОГЭ, ЕГЭ, Олимпиады) Основы управления техносферной безопасностью
Основы управления техносферной безопасностью Монтаж воздушных линий электропередач на напряжение до 1 кВ
Монтаж воздушных линий электропередач на напряжение до 1 кВ Табличные модели
Табличные модели Свойства текстильных материалов. Натуральные волокна животного происхождения
Свойства текстильных материалов. Натуральные волокна животного происхождения Векторы в пространстве
Векторы в пространстве Іван Пятрович Шамякін
Іван Пятрович Шамякін Александр Невский
Александр Невский колумбия
колумбия Отношения в паре мать-дочь
Отношения в паре мать-дочь Соловьёва Е.Д._Краеведение 2021 г.-1
Соловьёва Е.Д._Краеведение 2021 г.-1 Фёдор Иванович Шаляпин. Жизнь и творчество.
Фёдор Иванович Шаляпин. Жизнь и творчество. Manual UTH 05B
Manual UTH 05B Закон и власть. (Урок 14)
Закон и власть. (Урок 14) Презентация Исследовательская деятельность старших дошкольников на основе комплексно - тематического планирования
Презентация Исследовательская деятельность старших дошкольников на основе комплексно - тематического планирования Основы трансплантологии. Дерматопластика
Основы трансплантологии. Дерматопластика Лэпбук Путешествие в мир сенсорики
Лэпбук Путешествие в мир сенсорики Русские художественные промыслы
Русские художественные промыслы Метрология. Стандартизация. Взаимозаменяемость. Сертификация. Лекция № 16
Метрология. Стандартизация. Взаимозаменяемость. Сертификация. Лекция № 16 Средства отображения коллективного пользования. Диспетчерский щит
Средства отображения коллективного пользования. Диспетчерский щит