Содержание
- 2. Алкены (этиленовые углеводороды, олефины) - непредельные алифатические углеводороды, молекулы которых содержат двойную связь. Общая формула ряда
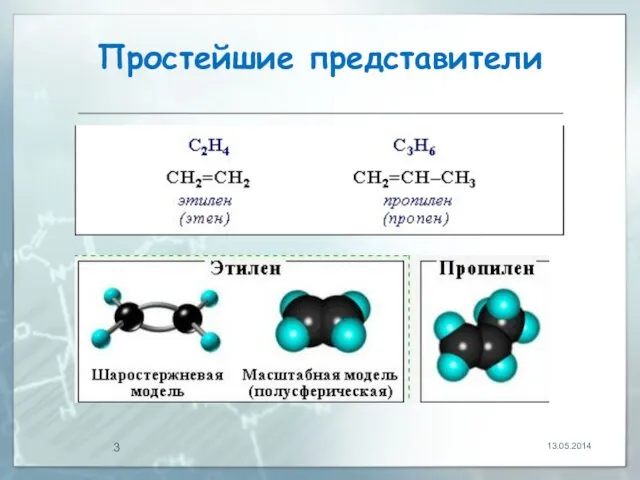
- 3. Простейшие представители 13.05.2014
- 4. Алкены В отличие от предельных углеводородов, алкены содержат двойную связь С=С, которая осуществляется 4-мя общими электронами:
- 5. Строение С=С связи Каждый из атомов имеет по три 2sp2-гибридных орбитали, направленных друг к другу под
- 6. Строение С=С связи Двойная связь является сочетанием σ- и π-связей (хотя она изображается двумя одинаковыми черточками,
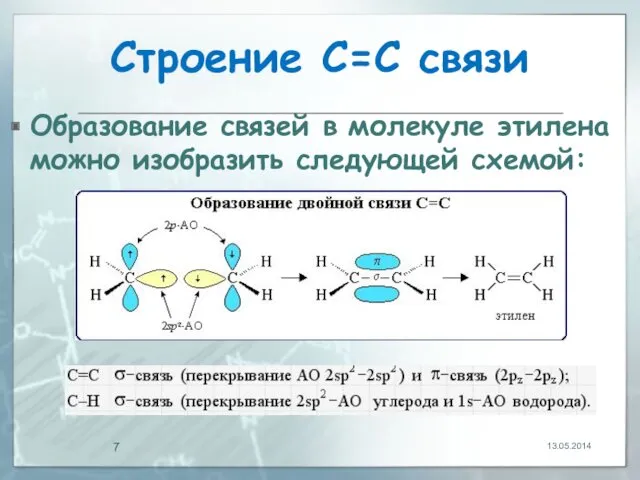
- 7. Строение С=С связи Образование связей в молекуле этилена можно изобразить следующей схемой: 13.05.2014
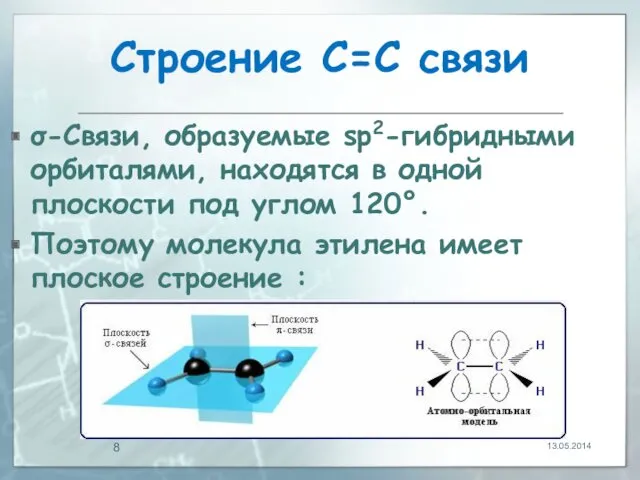
- 8. Строение С=С связи σ-Связи, образуемые sp2-гибридными орбиталями, находятся в одной плоскости под углом 120°. Поэтому молекула
- 9. Номенклатура алкенов названия алкенов производят от названий соответствующих алканов (путем замены суффикса –ан на –ен: 2
- 10. Номенклатура алкенов названия алкенов производят от названий соответствующих алканов (путем замены суффикса –ан на –ен: 2
- 11. Номенклатура алкенов Нумерацию углеродных атомов начинают с ближнего к двойной связи конца цепи. Цифра, обозначающая положение
- 12. Номенклатура алкенов В номенклатуре различных классов органических соединений наиболее часто используются следующие одновалентные радикалы алкенов: 13.05.2014
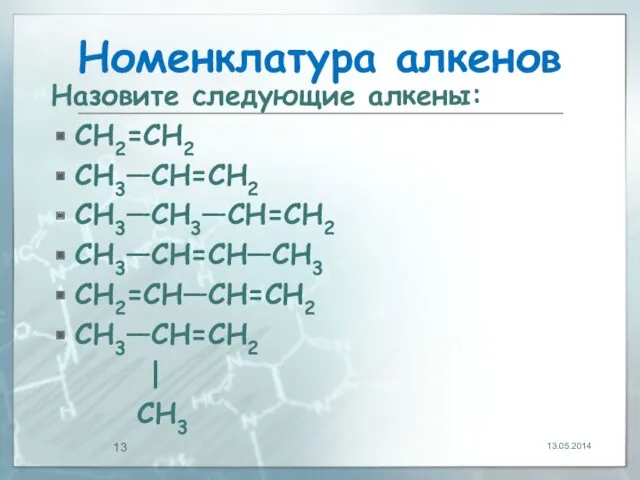
- 13. Номенклатура алкенов Назовите следующие алкены: CH2=CH2 CH3—CH=CH2 CH3—CH3—CH=CH2 CH3—CH=CH—CH3 CH2=CH—CH=CH2 CH3—CH=CH2 | CH3 13.05.2014
- 14. Структурная изомерия алкенов 13.05.2014 1. Изомерия углеродного скелета (начиная с С4Н8):
- 15. Структурная изомерия алкенов 13.05.2014 2. Изомерия положения двойной связи (начиная с С4Н8) :
- 16. Структурная изомерия алкенов 13.05.2014 3.Межклассовая изомерия с циклоалканами, начиная с С3Н6 :
- 17. Пространственная изомерия алкенов Вследствие жесткой закрепленности атомов поворотная изомерия относительно двойной связи не проявляется. Но становится
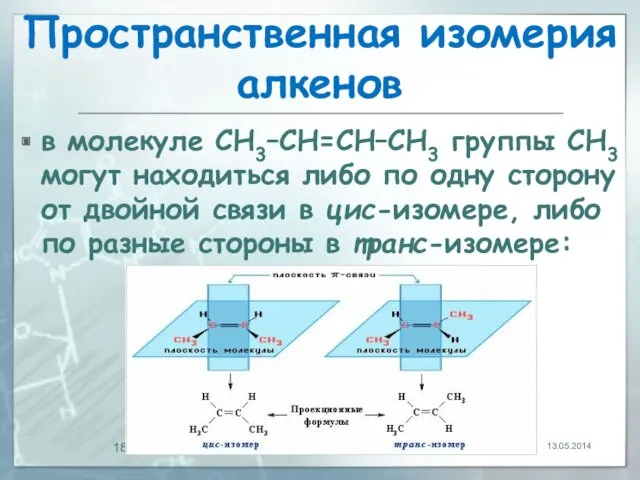
- 18. Пространственная изомерия алкенов в молекуле СН3–СН=СН–СН3 группы СН3 могут находиться либо по одну сторону от двойной
- 19. Свойства алкенов Физические свойства алкенов изменяются в гомологическом ряду: от С2Н4 до С4Н8 – газы, начиная
- 20. Свойства алкенов Химические свойства алкенов определяются строением и свойствами двойной связи С=С, которая значительно активнее других
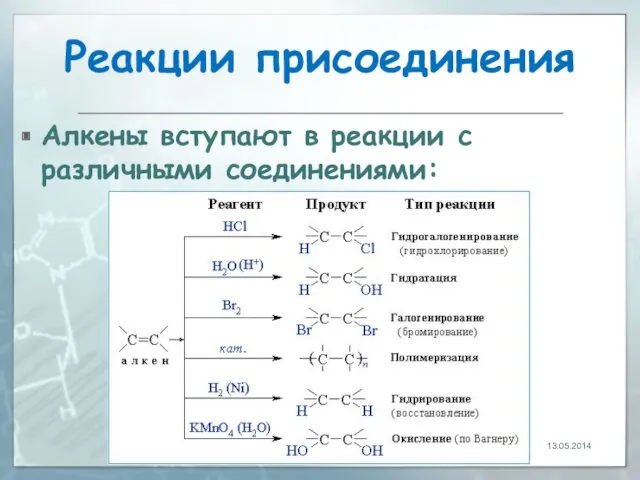
- 21. Реакции присоединения Алкены вступают в реакции с различными соединениями: 13.05.2014
- 22. Гидрирование (присоединение водорода) Алкены взаимодействуют с водородом при нагревании в присутствии металлов Pt, Pd или Ni:
- 23. Гидрирование (присоединение водорода) Присоединение водорода к атомам углерода в алкенах приводит к понижению степени их окисления:
- 24. Гидрирование (присоединение водорода) Эта реакция используется в промышленности для получения высокооктанового топлива: 13.05.2014
- 25. Галогенирование (присоединение галогенов) Присоединение галогенов по двойной связи С=С происходит легко в обычных условиях (при комнатной
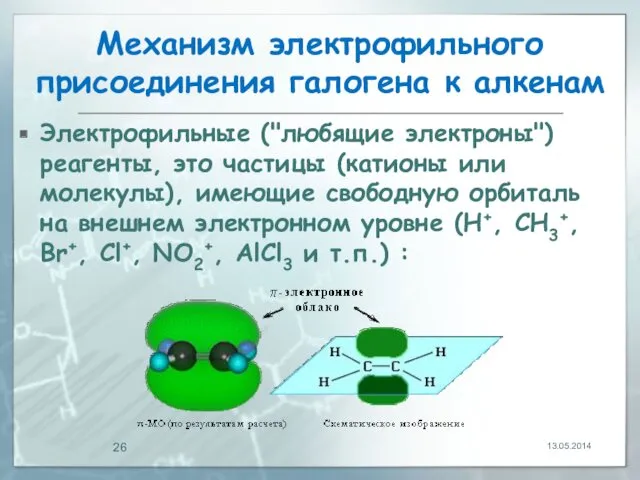
- 26. Механизм электрофильного присоединения галогена к алкенам Электрофильные ("любящие электроны") реагенты, это частицы (катионы или молекулы), имеющие
- 27. Механизм электрофильного присоединения галогена к алкенам Механизм присоединения протекает в три стадии: Стадия 1: образование π-комплекса.
- 28. Механизм электрофильного присоединения галогена к алкенам Стадия 2 (лимитирующая): образование карбокатиона. Электрофил (Br+) присоединяется к одному
- 29. Механизм электрофильного присоединения галогена к алкенам Стадия 3: взаимодействие карбокатиона с анионом Br-, образовавшемся при диссоциации
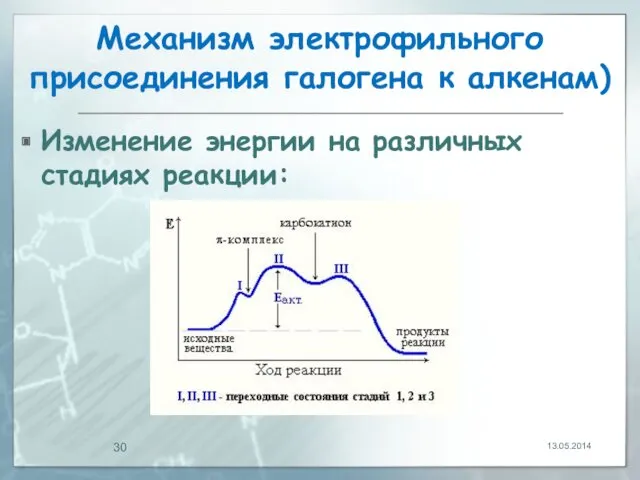
- 30. Механизм электрофильного присоединения галогена к алкенам) Изменение энергии на различных стадиях реакции: 13.05.2014
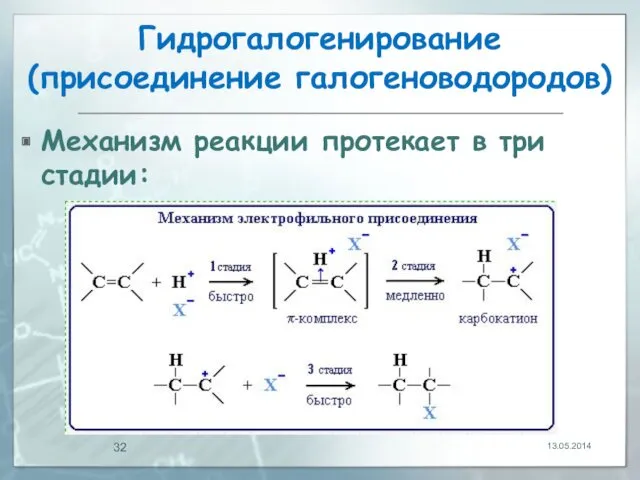
- 31. Гидрогалогенирование (присоединение галогеноводородов) Реакция идет по механизму электрофильного присоединения с гетеролитическим разрывом связей. Электрофилом является протон
- 32. Гидрогалогенирование (присоединение галогеноводородов) Механизм реакции протекает в три стадии: 13.05.2014
- 33. Гидратация (присоединение воды) Гидратация происходит в присутствии минеральных кислот по механизму электрофильного присоединения: 13.05.2014
- 34. Гидратация (присоединение воды) Реакция происходит в присутствии минеральных кислот (донора Н+) по механизму электрофильного присоединения: 13.05.2014
- 35. Полимеризация алкенов 1. Полимеризация – реакция образования высокомолекулярного соединения (полимера) путем последовательного присоединения молекул низкомолекулярного вещества
- 36. Полимеризация алкенов Число n называется степенью полимеризации. Реакции полимеризации алкенов идут в результате присоединения по кратным
- 37. Полимеризация алкенов 2. Димеризация алкенов – образование димера в результате реакции присоединения. В присутствии минеральной кислоты
- 38. Получение алкенов I. Крекинг алканов: например: 13.05.2014
- 39. Получение алкенов II. Отщепление (элиминирование) двух атомов или групп атомов от соседних атомов углерода с образованием
- 40. Получение алкенов II. Отщепление : дегидратация (при температуре менее 150°C в присутствии водоотнимающих реагентов ) 13.05.2014
- 41. Получение алкенов II. Отщепление : Дегидрогалогенирование (Дегидрогалогенирование моногалогеналканов при действии спиртового раствора щелочи) 13.05.2014
- 42. Применение алкенов Алкены применяются в качестве исходных продуктов в производстве полимерных материалов (пластмасс, каучуков, пленок) и
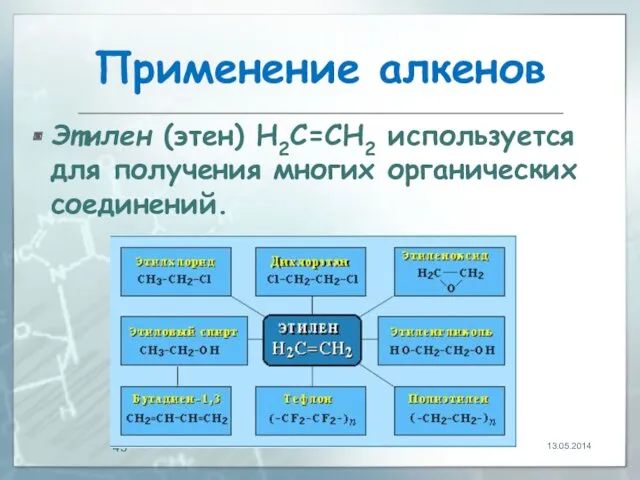
- 43. Применение алкенов Этилен (этен) Н2С=СН2 используется для получения многих органических соединений. 13.05.2014
- 44. Применение алкенов Пропилен (пропен) Н2С=СН2–СН3 и бутилены (бутен-1 и бутен-2) используются для получения спиртов и полимеров.
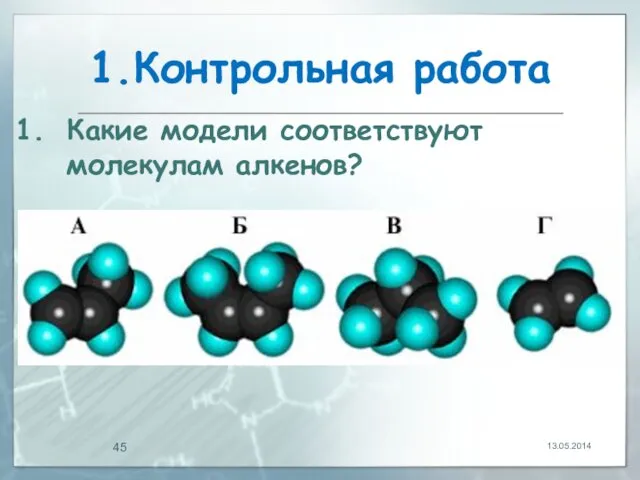
- 45. 1.Контрольная работа 13.05.2014 Какие модели соответствуют молекулам алкенов?
- 46. 2. Контрольная работа 13.05.2014 Дайте названия следующих алкенов, полученных из алканов: - пропан - декан -
- 47. 3.Контрольная работа 13.05.2014 Назовите соединение: Ответ 1: 3-метил-4-этилпентен-2 Ответ 2: 3-метил-2-этилпентен-3 Ответ 3: 3,4-диметилгексен-2 Ответ 4:
- 48. 4. Контрольная работа 13.05.2014 Сколько изомерных алкенов соответствует формуле С4Н8 ? Ответ 1: изомеров нет Ответ
- 49. 5. Контрольная работа 13.05.2014 Двойная связь является сочетанием . . . Ответ 1: двух σ-связей Ответ
- 50. 6. Контрольная работа 13.05.2014 Какова гибридизация атомов углерода в молекуле алкена: Ответ 1: 1 и 4
- 52. Скачать презентацию






































 Карл Маркс (5 мая 1818 года -14 марта 1883 года). Биография. Деятельность и учения
Карл Маркс (5 мая 1818 года -14 марта 1883 года). Биография. Деятельность и учения Норма права
Норма права Правила поведения в театре.
Правила поведения в театре. Городской транспортный комплекс
Городской транспортный комплекс Oracle. Управление активами. Проектный подход
Oracle. Управление активами. Проектный подход Машиностроительные материалы
Машиностроительные материалы Логика высказываний. (Лекция 2)
Логика высказываний. (Лекция 2) Ежик (сказка с шариком и кольцом Су-Джок)
Ежик (сказка с шариком и кольцом Су-Джок) Конструктивные элементы зданий
Конструктивные элементы зданий Огонь-наш друг и враг
Огонь-наш друг и враг Шиповые соединения
Шиповые соединения Презентация к стихотворению Е. Серегиной Полет над Каширой прордолжение 3
Презентация к стихотворению Е. Серегиной Полет над Каширой прордолжение 3 Проект Эколята –Дошколята
Проект Эколята –Дошколята Загадки о весне
Загадки о весне презентация Инновационный проект Использование информационно-коммуникационных технологий в условиях семейного детского сада
презентация Инновационный проект Использование информационно-коммуникационных технологий в условиях семейного детского сада Антон Иванович Деникин (1872-1947)
Антон Иванович Деникин (1872-1947) Ақсай мұнай газ кен орны
Ақсай мұнай газ кен орны Lappo
Lappo Пауки-древнейшие обитатели нашей планеты
Пауки-древнейшие обитатели нашей планеты Размножение организмов
Размножение организмов Планировка участка по ремонту двигателей
Планировка участка по ремонту двигателей презентация к занятию Дифференциация букв Б и Д
презентация к занятию Дифференциация букв Б и Д Кристаллические и аморфные тела
Кристаллические и аморфные тела Цифрові фотокамери
Цифрові фотокамери Явление вторичного излучения радиоволн. Отражение, рассеяние и переизлучение радиоволн объектами (целями). Лекция №4
Явление вторичного излучения радиоволн. Отражение, рассеяние и переизлучение радиоволн объектами (целями). Лекция №4 презентация Мой город-Волгодонск
презентация Мой город-Волгодонск Презентация к родительскому собранию на тему Здоровое питание детей
Презентация к родительскому собранию на тему Здоровое питание детей Андрій Чебикін
Андрій Чебикін