Содержание
- 2. Литература: Глаголев К.В., Морозов А.Н. Физическая термодинамика: Учеб. пособие. – М.: Изд-во МГТУ им. Н.Э.Баумана, 2004.
- 3. Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона): (11.1) где – универсальная газовая постоянная, μ – молярная масса
- 4. Моль – количество вещества, содержащее число частиц, равное постоянной Авогадро: Молярная масса – масса одного моля.
- 5. Изотермический процесс (11.2) График изотермического процесса – изотерма. (11.1а) Закон Бойля-Мариотта
- 6. Изобарический (изобарный) процесс (11.3) График – изобара. Закон Гей-Люссака (11.1а)
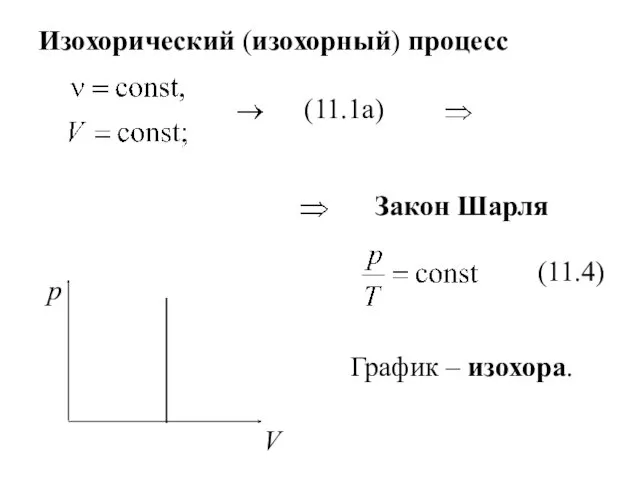
- 7. Изохорический (изохорный) процесс (11.4) График – изохора. Закон Шарля (11.1а)
- 8. Существуют и другие стандартные процессы, в которых сохраняется какая-либо термодинамическая величина, которые, хотя и не являются
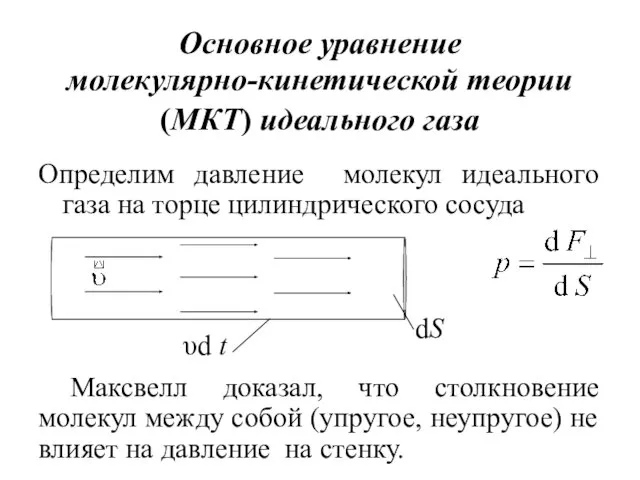
- 9. Основное уравнение молекулярно-кинетической теории (МКТ) идеального газа Определим давление молекул идеального газа на торце цилиндрического сосуда
- 10. Допущение: пусть все молекулы, находящиеся в сосуде, движутся с одной и той же скоростью и 1/6
- 11. где n – концентрация молекул (число молекул в единице объема). Здесь Т.к. скорости отдельных молекул υi
- 12. где υкв. – средняя квадратичная скорость. – средняя энергия поступательного движения молекулы. (11.5)
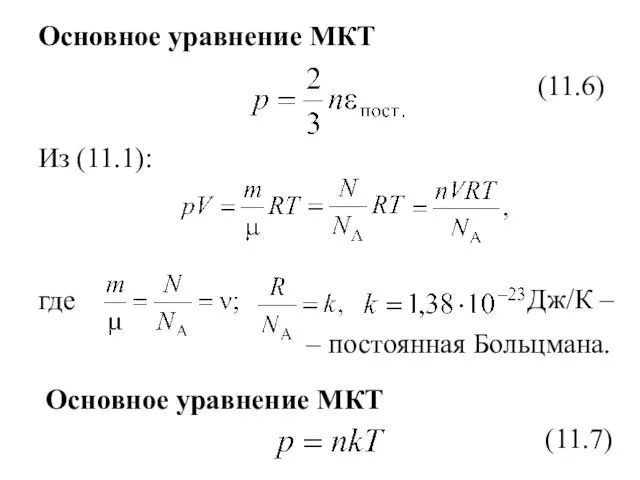
- 13. Основное уравнение МКТ (11.6) Из (11.1): где Дж/К – – постоянная Больцмана. Основное уравнение МКТ (11.7)
- 14. Из (11.6) и (11.7) (11.8) (11.8) вскрывает физический смысл температуры T: температура выражает среднюю кинетическую энергию
- 15. средняя квадратичная скорость (11.9)
- 16. Равномерное распределение энергии по степеням свободы молекул Согласно (11.8) средняя энергия поступательного движения молекулы iпост.=3. На
- 17. Средняя энергия молекулы (11.11) где i – сумма числа поступательных (iпост.), вращательных (iвр.) и удвоенного числа
- 18. Для жесткой молекулы: двухатомной трехатомной одноатомной
- 19. Внутренняя энергия идеального газа Т.к. частицы идеального газа между собой не взаимодействуют, то внутренняя энергия частиц:
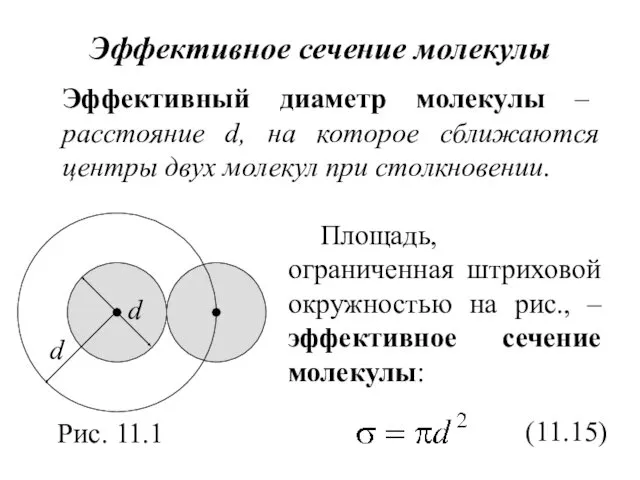
- 20. Эффективное сечение молекулы Эффективный диаметр молекулы – расстояние d, на которое сближаются центры двух молекул при
- 21. Среднее число соударений и средняя длина свободного пробега молекул Длина свободного пробега молекулы – среднее расстояние,
- 22. Определим z, проследив за поведением молекулы, движущейся ⊥ плоскости рисунка (рис. 11.1). За единицу времени она
- 23. Тогда среднее число столкновений молекулы ежесекундно: (11.18) где n – концентрация молекул. Средняя длина свободного пробега
- 24. Уточненные формулы (11.18) и (11.19): При более строгом рассмотрении вопроса о числе столкновений z, необходимо заменить
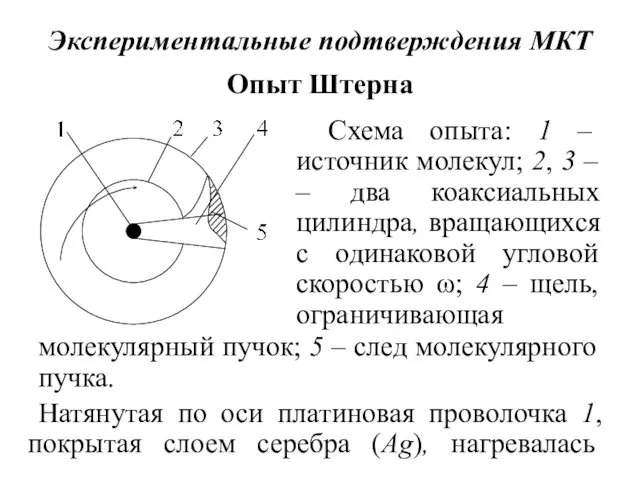
- 25. Экспериментальные подтверждения МКТ Опыт Штерна молекулярный пучок; 5 – след молекулярного пучка. Схема опыта: 1 –
- 26. электрическим током до t = 1200° C, при которой атомы Ag испарялись. Воздух из установки предварительно
- 27. Прошедшие через щель 4 атомы Ag осаждаются на холодной стенке внешнего цилиндра 3, образуя серебряную полоску
- 28. Прибор Штерна совершал 45 об/с. Совпадение измеренных значений скоростей молекул с теоретическими было хорошим. Вследствие хаотичности
- 30. Скачать презентацию






















 Present Perfect
Present Perfect Строение мышцы как органа
Строение мышцы как органа Расцвет европейского средневековья – время городов
Расцвет европейского средневековья – время городов Универсиада 2013
Универсиада 2013 Клещевой боррелиоз
Клещевой боррелиоз Игровое дидактическое пособие
Игровое дидактическое пособие Изменчивость как причина наследственных заболеваний у человека
Изменчивость как причина наследственных заболеваний у человека Модели систем здравоохранения. Межсекторальное сотрудничество. Принципы, примеры
Модели систем здравоохранения. Межсекторальное сотрудничество. Принципы, примеры Царское Село -Пушкин презентация
Царское Село -Пушкин презентация Преемственность работы учителя-логопеда и воспитателя ГПД в профилактике оптической дисграфии у детей в период обучения грамоте.
Преемственность работы учителя-логопеда и воспитателя ГПД в профилактике оптической дисграфии у детей в период обучения грамоте. Организационно-правовые формы предприятий
Организационно-правовые формы предприятий Xiamen Frand Intelligent Equipment Co, LTD
Xiamen Frand Intelligent Equipment Co, LTD Рисуем Космос
Рисуем Космос Инженерный анализ методом конечных элементов. Работа со сборками. Задание контактов
Инженерный анализ методом конечных элементов. Работа со сборками. Задание контактов الكمبيوتر
الكمبيوتر Использование информационных технологий как средства развития ключевых компетентностей учащихся в обучении биологии
Использование информационных технологий как средства развития ключевых компетентностей учащихся в обучении биологии Кріплення свердловин та розмежування пластів
Кріплення свердловин та розмежування пластів Частичные арифметические функции. (Лекция 11)
Частичные арифметические функции. (Лекция 11) Автоматические выключатели
Автоматические выключатели Непосредственное, прямое народовластие. (Тема 7)
Непосредственное, прямое народовластие. (Тема 7) Отстойники. Классификация
Отстойники. Классификация урок географии в 6 классе Разнообразие горных пород и минералов. Практическая работа Изучение свойств горных пород и минералов
урок географии в 6 классе Разнообразие горных пород и минералов. Практическая работа Изучение свойств горных пород и минералов Презентация Дидактическая игра, её роль в развитии дошкольников первой младшей группы
Презентация Дидактическая игра, её роль в развитии дошкольников первой младшей группы Корни растений. Типы корневых систем
Корни растений. Типы корневых систем Неделя спикера
Неделя спикера Презентация к уроку технологии в начальных классах Мастерим из глины
Презентация к уроку технологии в начальных классах Мастерим из глины Основные понятия программирования
Основные понятия программирования Внеклассное мероприятие на тему Символы и главный документ нашей страны
Внеклассное мероприятие на тему Символы и главный документ нашей страны