Слайд 2

Цель урока:
Изучение реакций ионного обмена и условий их протекания.
Слайд 3

Эпиграф
Три пути ведут к познанию: путь размышления – самый благородный, путь
подражания – самый лёгкий, путь опыта – самый горький!
Слайд 4

Ответьте на вопросы
1.Какие вещества называются электролитами? Приведите примеры.
2. Какие вещества называются
неэлектролитами? Приведите примеры.
3. В каком году и кто разработал теорию электролитической диссоциации?
Слайд 5

Выполните задания
1.Перечисленные вещества разделите на 2 столбика: в один запишите электролиты,
в другой – неэлектролиты: р-р КОН, тв.КОН, крист. сахара, Н2SO4, спирт, дист.вода.
2. Запишите уравнение диссоциации следующих веществ: КNO3, Ba(OH)2, HCL, H2SO4
Слайд 6
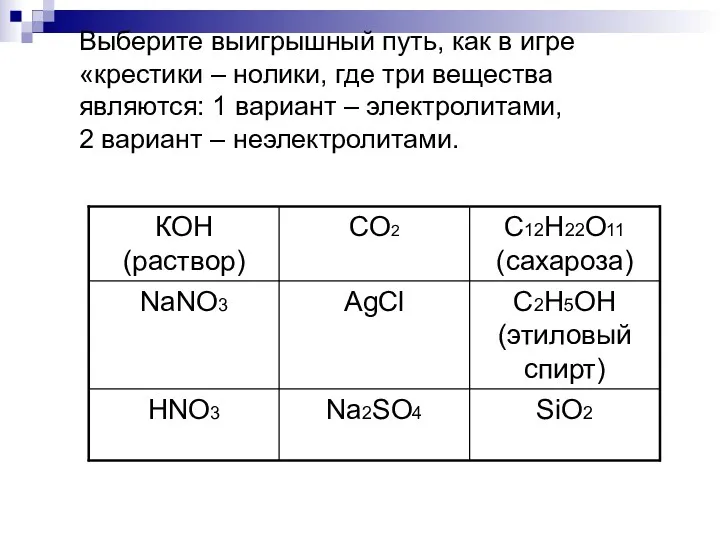
Выберите выигрышный путь, как в игре «крестики – нолики, где три
вещества являются: 1 вариант – электролитами, 2 вариант – неэлектролитами.
Слайд 7

Слайд 8

Реакции между ионами называются ионными реакциями, а уравнения таких реакций –
ионными уравнениями.
Слайд 9

Реакции ионного обмена протекают до конца в случае
Выпадения осадка
Выделения газа
Образования
малодиссоциирующего вещества
Слайд 10

Правила составления ионных уравнений
Простые вещества, оксиды, а также нерастворимые кислоты, основания,
соли не диссоциируют.
Для реакции берут растворы веществ, поэтому даже малорастворимые вещества находятся в растворах в виде ионов.
Если в результате реакции образовалось малорастворимое вещество, то при записи ионного уравнения его считают нерастворимым.
Слайд 11

Алгоритм составления ионного уравнения
Записать молекулярное уравнение реакции.
С помощью таблицы растворимости определить
растворимость каждого вещества.
Составить полное ионное уравнение
Составить сокращенное ионное уравнение (найти одинаковые ионы и сократить их слева и справа)
Слайд 12

Лабораторная работа
Тема: Реакции ионного обмена
1 группа Взаимодействие растворов NaOH и CuSO4
2
группа Взаимодействие растворов Na2CO3 и HCl
3 группа Взаимодействие растворов NaOH и HCl
Слайд 13

Слайд 14
Слайд 15

Оцените свою работу по направлениям
«Я» - как я себя чувствовал в
процессе урока, доволен ли я своей работой;
«Мы» - насколько комфортно и эффективно мне было работать в группе;
«Дело» - достиг ли я цели обучения, в чём испытал затруднения, как преодолеть проблемы.
Слайд 16

Домашнее задание
§ 4, упр.1















 Биотрансформация ядов
Биотрансформация ядов Презентация Области применения металлов
Презентация Области применения металлов Защита от воздействия высоких и низких температур
Защита от воздействия высоких и низких температур Операции над графами и их свойства
Операции над графами и их свойства Здание как сочетание различных объемов
Здание как сочетание различных объемов Основные элементы вязания крючком
Основные элементы вязания крючком Презентация к уроку: Основания
Презентация к уроку: Основания Телефонні лінії зв’язку. Комунікаційні системи глобальних мереж
Телефонні лінії зв’язку. Комунікаційні системи глобальних мереж Удивительные птицы мира (Топ-20)
Удивительные птицы мира (Топ-20) АиР Судорожный синдром
АиР Судорожный синдром Презентация Сотрудничество семьи и школы в развитии личностных УУД младших школьников
Презентация Сотрудничество семьи и школы в развитии личностных УУД младших школьников Чистые интервалы
Чистые интервалы Электротравма. Поражение атмосферным электричеством
Электротравма. Поражение атмосферным электричеством Электроэнергетика России
Электроэнергетика России О предоставлении субсидий на возмещение части прямых понесенных затрат, направленных на создание и модернизацию объектов
О предоставлении субсидий на возмещение части прямых понесенных затрат, направленных на создание и модернизацию объектов Классы неорганических соединений
Классы неорганических соединений Душистый льется чай
Душистый льется чай Building blocks. Atoms. Elements. Structure of the atom
Building blocks. Atoms. Elements. Structure of the atom Forecasting techniques. Barometric methods
Forecasting techniques. Barometric methods Презентация Центр книги.
Презентация Центр книги. Презентация Развитие навыков письма и чтения посредством образовательной кинезиологической программы BRAIN GYM
Презентация Развитие навыков письма и чтения посредством образовательной кинезиологической программы BRAIN GYM Классификация глобальных проблем
Классификация глобальных проблем Технология возделывания картофеля
Технология возделывания картофеля Цветоведение
Цветоведение Правка металла
Правка металла презентация для родителей один день из жизни группы
презентация для родителей один день из жизни группы Теоретическая механика. Курс лекций
Теоретическая механика. Курс лекций Прорастание картофеля в разных условиях
Прорастание картофеля в разных условиях