Содержание
- 2. Понятие атом Атом (греч. «atomos» – неделимый) ввел Демокрит. Атомы выступают в роли первоначала. Они неделимы,
- 3. Атомно-молекулярное учение Возродил атомистическую теорию английский физик и химик Джон Дальтон. Атомы одного элемента имеют одинаковые
- 4. Атом делим!!! Атом делим, как доказали следующие экспериментальные открытия, сделанные в науке на рубеже конца 19-начала
- 5. Катодные лучи В 1879 году Крукс открыл катодные лучи, представляющие собой поток электронов в вакуумной трубке,
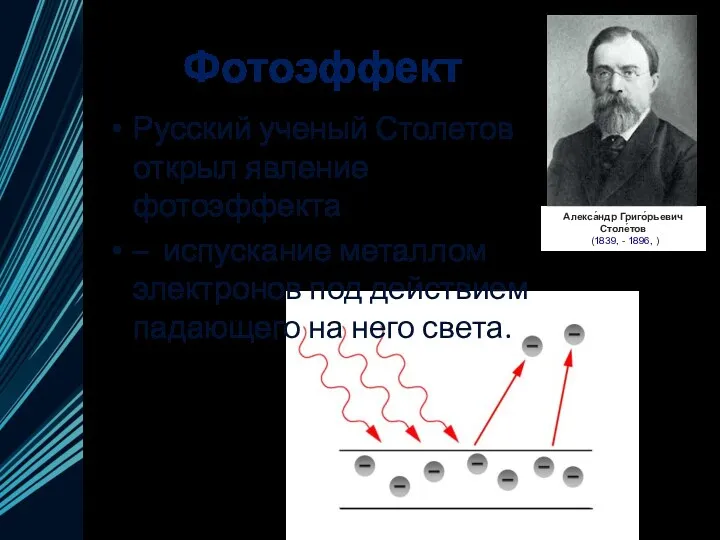
- 6. Фотоэффект Русский ученый Столетов открыл явление фотоэффекта – испускание металлом электронов под действием падающего на него
- 7. Рентгеновское излучение Значимым стало открытие Рентгеном «Х»-лучей. Эти лучи представляют собой электромагнитное излучение подобное свету с
- 8. Радиоактивность Большой вклад в развитие представлений об элементарных частицах внесли Радиоактивность – это явление самопроизвольного превращения
- 9. Электролиз Вспомните, что это? Электро́лиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых
- 10. Модели строения атома Модель Томсона – «пудинговая модель» 1904 год
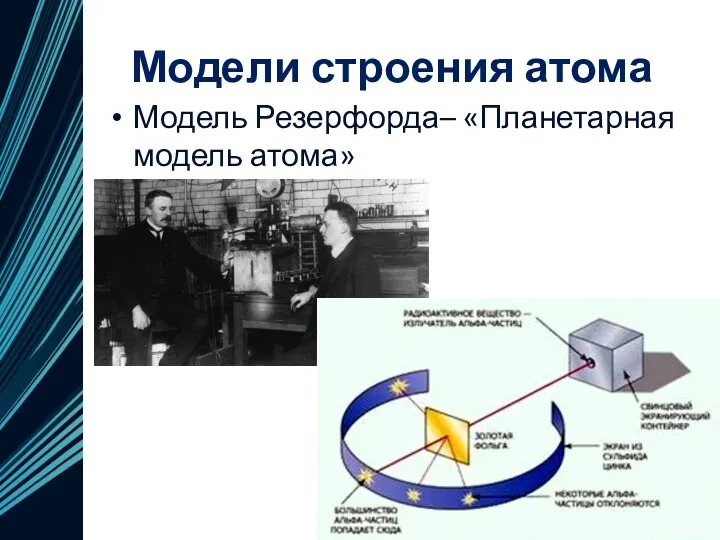
- 11. Модели строения атома Модель Резерфорда– «Планетарная модель атома»
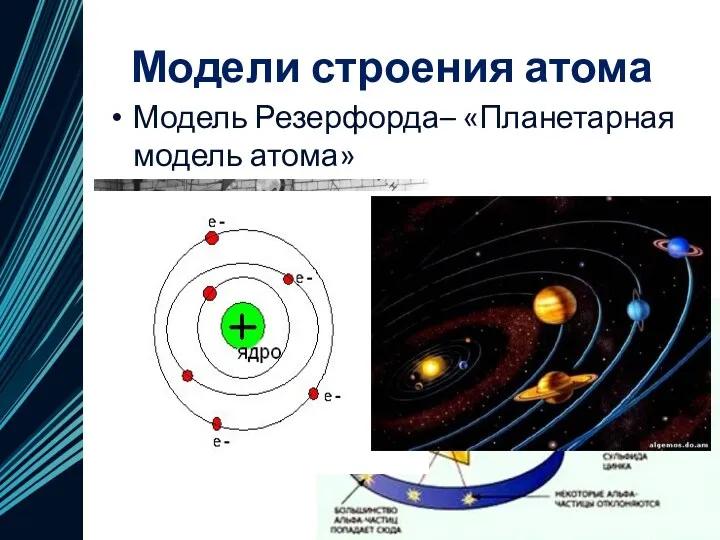
- 12. Модели строения атома Модель Резерфорда– «Планетарная модель атома»
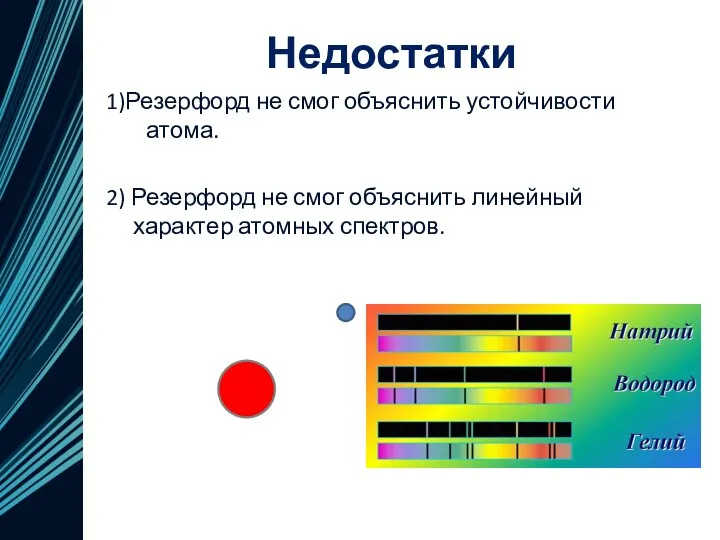
- 13. Недостатки 1)Резерфорд не смог объяснить устойчивости атома. 2) Резерфорд не смог объяснить линейный характер атомных спектров.
- 14. Квантовая модель 1913 год Основные положения он сформулировал в виде постулатов: I. Электрон может вращаться вокруг
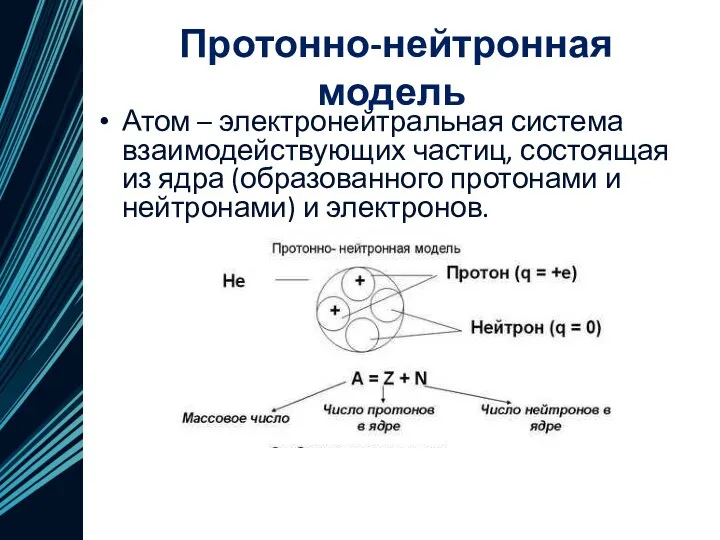
- 15. Протонно-нейтронная модель В 1932 году Иваненко предложил протонно-нейтронную модель ядра. Эту теорию развил Гейзенберг. Эта модель
- 16. Протонно-нейтронная модель Атом – электронейтральная система взаимодействующих частиц, состоящая из ядра (образованного протонами и нейтронами) и
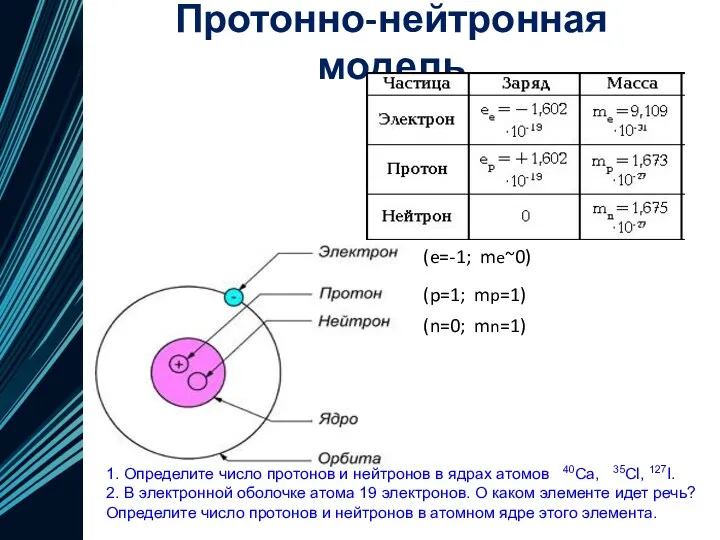
- 17. Протонно-нейтронная модель 1. Определите число протонов и нейтронов в ядрах атомов 40Ca, 35Cl, 127I. 2. В
- 18. Изотопы - Это разновидности атомов одного и того же химического элемента, имеющие одинаковый заряд атомного ядра(одинаковое
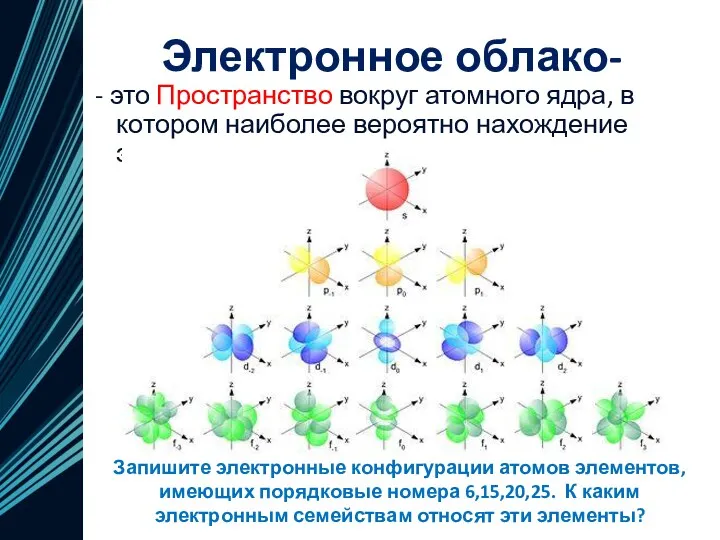
- 19. Электронное облако- - это Пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона. Запишите электронные
- 20. Рефлексия Тема сегодняшнего урока была интересна, все было понятно - Мне было интересно, но не все
- 21. Д/з п.1, в.3,6,7,10
- 22. Источники Габриелян О.С. Химия. 11 класс. Базовый уровень: учеб. для общеобразоват. учреждений. – М., 2013. Габриелян
- 24. Скачать презентацию














 Демография и труд
Демография и труд Архитектура SOA
Архитектура SOA Классный час Все мы разные
Классный час Все мы разные Леонтьев А.Н. Деятельность. Сознание. Личность
Леонтьев А.Н. Деятельность. Сознание. Личность Экспресс-методы определения массовой доли и качества влаги в мясном сырье
Экспресс-методы определения массовой доли и качества влаги в мясном сырье Эргономика спальной комнаты.Автоподъемник кровати
Эргономика спальной комнаты.Автоподъемник кровати Первые христиане и их учение
Первые христиане и их учение занятие по развитию речи Цветы Диск
занятие по развитию речи Цветы Диск История города Нурлат в фотографиях
История города Нурлат в фотографиях Семиотика урологических заболеваений
Семиотика урологических заболеваений Иерусалим в контексте древних городов. Несколько слов о библейской географии
Иерусалим в контексте древних городов. Несколько слов о библейской географии Альтернативные теории международной торговли
Альтернативные теории международной торговли Зимние явления в природе.
Зимние явления в природе. Линейная алгебра. Экономические приложения
Линейная алгебра. Экономические приложения Методы и особенности интервью
Методы и особенности интервью Открытый урок Природно-хозяйственные зоны 8 класс
Открытый урок Природно-хозяйственные зоны 8 класс Презентация учителя . Я - учитель
Презентация учителя . Я - учитель Общая характеристика Евразии
Общая характеристика Евразии Презентация Что скрывается в яркой баночке
Презентация Что скрывается в яркой баночке Педагогический совет Внедрение и реализация ФГОС ДО
Педагогический совет Внедрение и реализация ФГОС ДО Открытый урок в 8 классе Металлы – простые вещества. Роль металлов в организме человека
Открытый урок в 8 классе Металлы – простые вещества. Роль металлов в организме человека Нетрадиционные методы и приёмы в коррекционной работе с детьми, имеющими речевые нарушения.
Нетрадиционные методы и приёмы в коррекционной работе с детьми, имеющими речевые нарушения. Равнины суши
Равнины суши Южная Осетия. Лекция 7.1
Южная Осетия. Лекция 7.1 КВН Сказка, сказка, приходи!
КВН Сказка, сказка, приходи! Презентация Николаева Евгения на тему: Несомненное условие счастья – есть семья!
Презентация Николаева Евгения на тему: Несомненное условие счастья – есть семья! Wyposażenie kościoła
Wyposażenie kościoła Алльфа страхование. Выявление ключевых проблем филиала и их решение
Алльфа страхование. Выявление ключевых проблем филиала и их решение