Содержание
- 2. Цели урока: обеспечить усвоение учащимися знаний о фосфоре как о химическом элементе и простом веществе; аллотропных
- 3. Прав ли был Артур Конан-Дойл?
- 4. Открытие фосфора Гамбургский алхимик Хеннинг Бранд 1669 год «Фосфор» - от греческого «светоносный»
- 5. период Фосфор как химический элемент группа валентных электронов степени окисления высший оксид водородное соединение
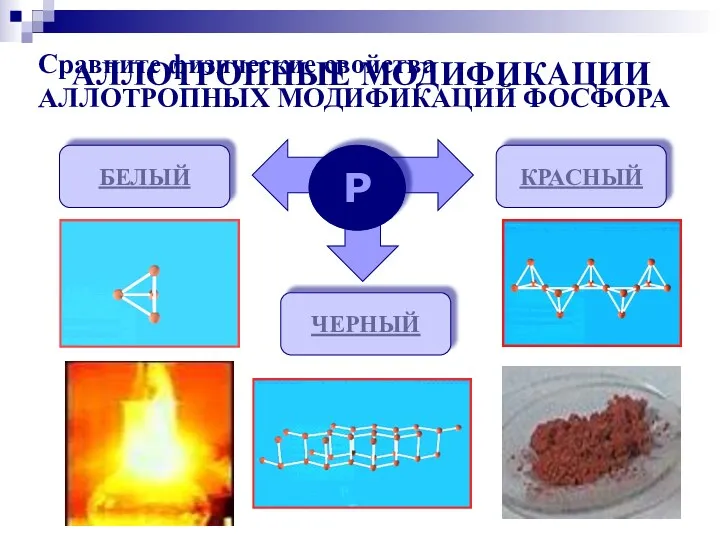
- 6. АЛЛОТРОПНЫЕ МОДИФИКАЦИИ Р БЕЛЫЙ КРАСНЫЙ ЧЕРНЫЙ Сравните физические свойства АЛЛОТРОПНЫХ МОДИФИКАЦИЙ ФОСФОРА
- 7. С металлами: Ca + P = C неметаллами: P + O2 = P + S =
- 8. с бертолетовой солью при ударе взрывается, воспламеняется: KClO3 + P = P2O5 + KCl
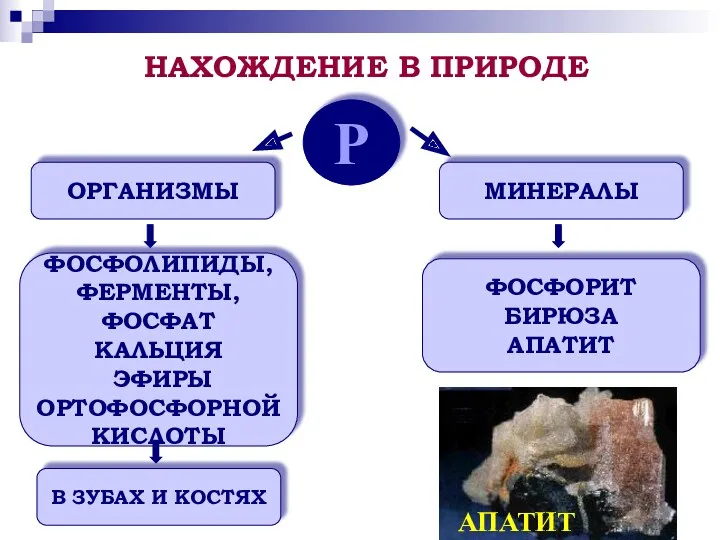
- 9. Р ОРГАНИЗМЫ МИНЕРАЛЫ ФОСФОЛИПИДЫ, ФЕРМЕНТЫ, ФОСФАТ КАЛЬЦИЯ ЭФИРЫ ОРТОФОСФОРНОЙ КИСЛОТЫ В ЗУБАХ И КОСТЯХ ФОСФОРИТ БИРЮЗА
- 10. Физиологическое действие белого фосфора Результат применения чрезмерного количества фосфора Появление лягушек с уродствами -результат применения фосфорных
- 11. Получение фосфора нагреванием смеси фосфорита, угля и песка в электропечи: Ca3(PO4)2 + C + SiO2 →
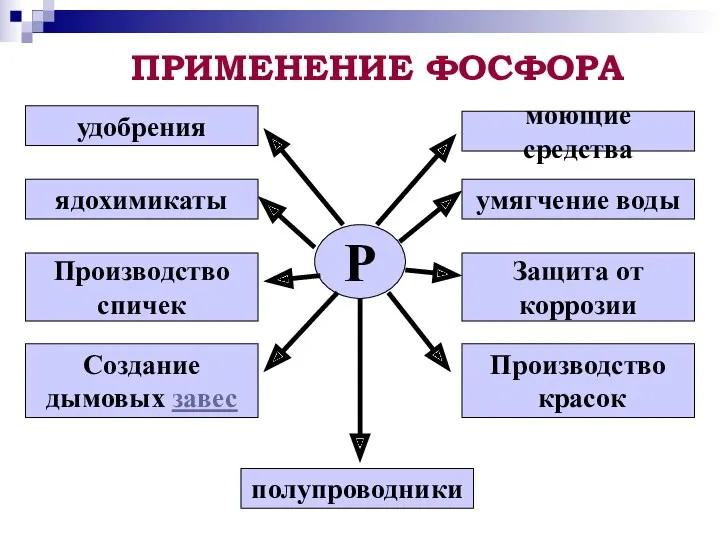
- 12. ПРИМЕНЕНИЕ ФОСФОРА Р удобрения ядохимикаты Производство спичек Создание дымовых завес полупроводники Производство красок Защита от коррозии
- 13. ДОМАШНЕЕ ЗАДАНИЕ §19.9 (Л.С.Гузей), §21(Г.Е.Рудзитис) Индивидуальные задания. Подготовить сообщения: 1)об истории спичек; 2) о биологической роли
- 14. СПАСИБО ЗА УРОК!
- 15. Войска США использовали фосфорные Бомбы в Ираке, 2004 г.
- 16. Молекулы P4 имеют форму тетраэдра. Это легкоплавкое t(пл)=44,1оС, t(кип)=275оС, мягкое, бесцветное воскообразное вещество. Хорошо растворяется в
- 17. Существует несколько форм красного фосфора Их структуры окончательно не установлены. Известно, что они являются атомными веществами
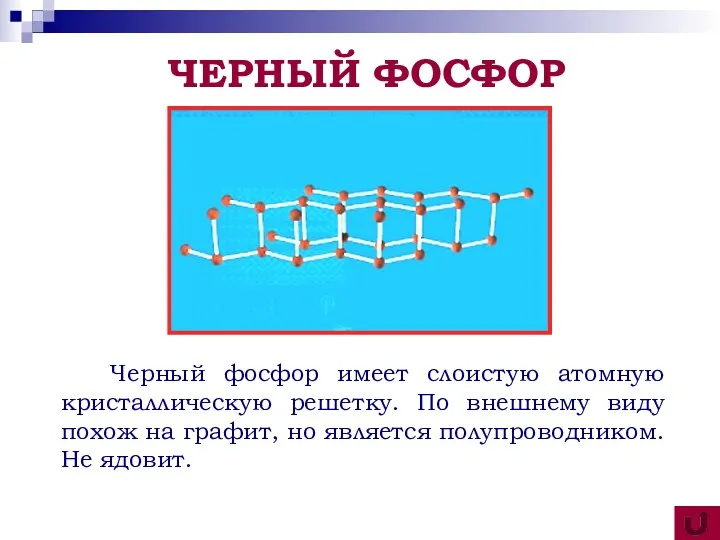
- 18. Черный фосфор имеет слоистую атомную кристаллическую решетку. По внешнему виду похож на графит, но является полупроводником.
- 19. период Фосфор как химический элемент III группа VА валентных электронов 5 степени окисления -3, +3, +5
- 21. Скачать презентацию














 До школы 6 месяцев:срочно учимся читать
До школы 6 месяцев:срочно учимся читать Увеличительные приборы. 5 класс.
Увеличительные приборы. 5 класс. Латексная аллергия, клиника, диагностика и лечение
Латексная аллергия, клиника, диагностика и лечение Знамя победы
Знамя победы Факторы опасности для человека
Факторы опасности для человека Взаємодія генів. Позаядерна спадковість
Взаємодія генів. Позаядерна спадковість Лекция № 3 Местное и общее обезболивание
Лекция № 3 Местное и общее обезболивание Народные промыслы Пермского края
Народные промыслы Пермского края Проект GoodsIn WPT. Спецификация на часть СКУД и Видеонаблюдение
Проект GoodsIn WPT. Спецификация на часть СКУД и Видеонаблюдение Агропромышленный комплекс
Агропромышленный комплекс The United Kingdom
The United Kingdom Виды кровельных гидроизоляционных и герметизирующих материалов
Виды кровельных гидроизоляционных и герметизирующих материалов Внедрение в образовательный процесс современных технологий.
Внедрение в образовательный процесс современных технологий. Высокопрочное гипсоцементнопуццолановое вяжущее (ГЦПВ)
Высокопрочное гипсоцементнопуццолановое вяжущее (ГЦПВ) Внутренняя политика Николая I
Внутренняя политика Николая I Разработка технологических нормативов водопотребления и водоотведения
Разработка технологических нормативов водопотребления и водоотведения Экзопланеты, или внесолнечные планеты
Экзопланеты, или внесолнечные планеты Роль неблагоприятных факторов окружающей среды в развитии болезней органов дыхания у детей
Роль неблагоприятных факторов окружающей среды в развитии болезней органов дыхания у детей Восстановление деталей сваркой и наплавкой
Восстановление деталей сваркой и наплавкой Презентация1
Презентация1 Транспорт
Транспорт Виртуальная экскурсия О подвиге, о доблести, о славе
Виртуальная экскурсия О подвиге, о доблести, о славе Broken heart
Broken heart Родительское собрание Возрастные особенности детей 5-6 лет
Родительское собрание Возрастные особенности детей 5-6 лет Основные группы лекарственных препаратов при лечении ОРЗ и ОРВИ
Основные группы лекарственных препаратов при лечении ОРЗ и ОРВИ Суарудың түрлері
Суарудың түрлері Плезиохронная цифровая иерархия
Плезиохронная цифровая иерархия Социальная политика государства
Социальная политика государства