Слайд 2
Слайд 3

Слайд 4
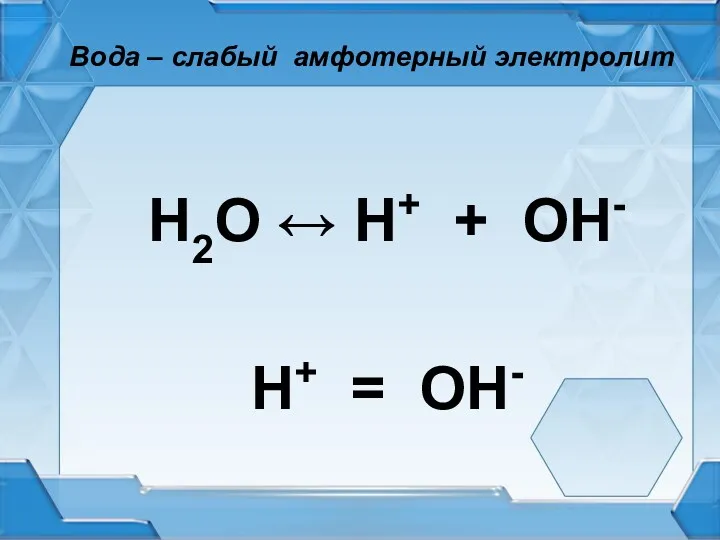
Вода – слабый амфотерный электролит
Н2О ↔ Н+ + ОН-
Н+ =
ОН-
Слайд 5

Водородный показатель (рН) – количественная характеристика кислотности среды
Слайд 6

Это понятие было введено в 1909 году датским химиком Сёренсеном.
Показатель называется pH, по первым буквам латинских слов potentia hydrogeni — сила водорода, или pondus hydrogenii — вес водорода.
Слайд 7

Зависимость среды раствора от концентрации ионов Н+ и ОН-
Слайд 8

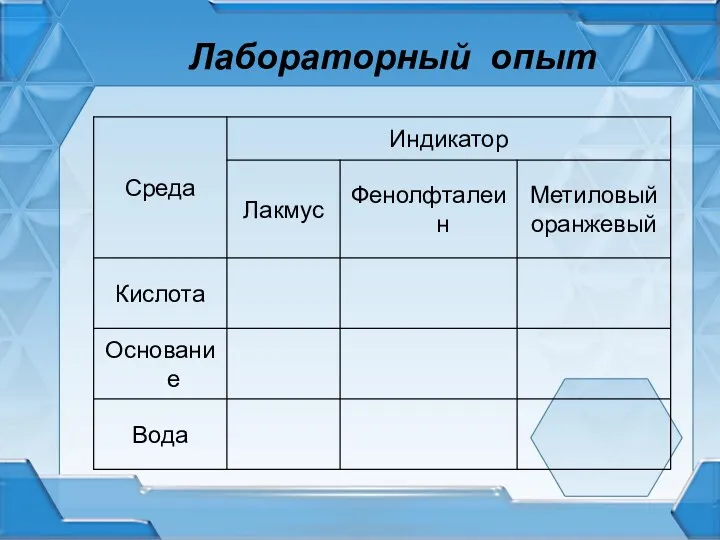
Индикаторы
органические соединения, изменяющие свою окраску при изменении среды растворов,т.е рН
Слайд 9

Универсальный индикатор
Это смесь кислотно-основных индикаторов, позволяющая определить значение рН от 1
до 10.
Слайд 10
Слайд 11

Окраска индикаторов в различных средах
Слайд 12

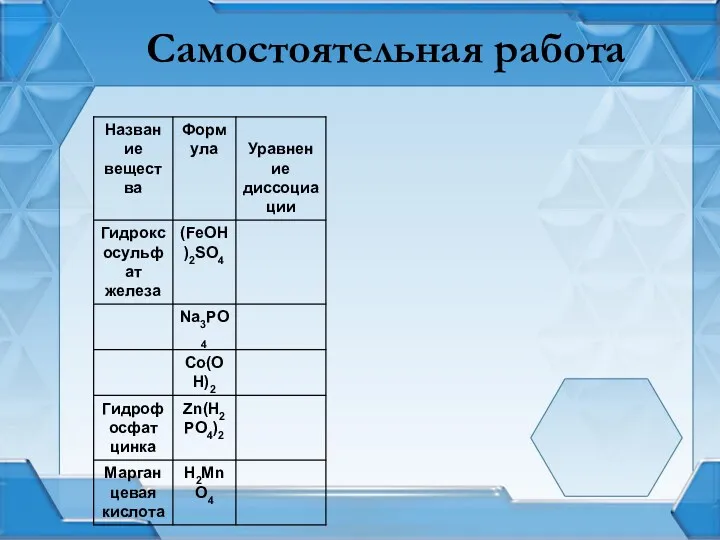
Лабораторная работа: «Определение рН в растворах СМС»











 Презентация к уроку Технология 1 класс. Оригами.
Презентация к уроку Технология 1 класс. Оригами. Tema_2_Ponyatie_Chast_II
Tema_2_Ponyatie_Chast_II Устройство судна
Устройство судна Организация труда секретаря-референта в современной организации
Организация труда секретаря-референта в современной организации Алексей Николаевич Толстой 1882-1945гг
Алексей Николаевич Толстой 1882-1945гг Lapbook Templates
Lapbook Templates Развитие творческого потенциала у младших школьников корррекционной школы VIII вида
Развитие творческого потенциала у младших школьников корррекционной школы VIII вида ТЫЖ Программист
ТЫЖ Программист Расстройства местного кровообращения
Расстройства местного кровообращения Классный час на тему: Всемирный день защиты животных
Классный час на тему: Всемирный день защиты животных История фотоаппарата
История фотоаппарата Дорожные знаки. Художественное творчество (рисование) в подготовительной группе Добрые сердца
Дорожные знаки. Художественное творчество (рисование) в подготовительной группе Добрые сердца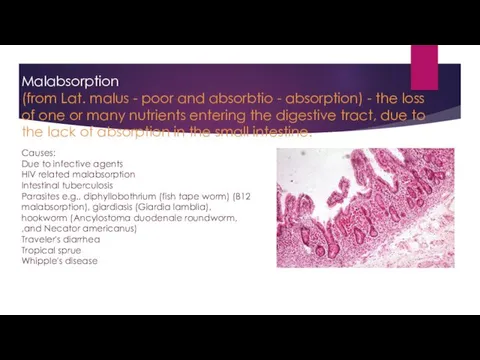 Malabsorption
Malabsorption Презентация Книжки-малышки
Презентация Книжки-малышки павлов
павлов день космонавтики
день космонавтики Все о возражениях и сомнениях клиента в настоящем периоде
Все о возражениях и сомнениях клиента в настоящем периоде Рахит. Этиология, патогенез, клиника, диагностика, лечение, профилактика
Рахит. Этиология, патогенез, клиника, диагностика, лечение, профилактика Writing an article
Writing an article Стоматологические индексы
Стоматологические индексы Излучение и спектры
Излучение и спектры Ориентирование подземных выработок
Ориентирование подземных выработок Урок географии по теме Воды суши. Реки.
Урок географии по теме Воды суши. Реки. консультация - презентация для родителей и педагогов Учимся произносить звук Р
консультация - презентация для родителей и педагогов Учимся произносить звук Р Последствия курения (кл.час)
Последствия курения (кл.час) Наполнение регионального репозитория образовательным контентом
Наполнение регионального репозитория образовательным контентом Викторина 8-б класс
Викторина 8-б класс Возрастные особенности третьеклассника
Возрастные особенности третьеклассника