Содержание
- 2. Цели и задачи урока рассмотреть положение неметаллов в ПСХЭ Д.И.Менделеева и на основе строения атомов сделать
- 3. Общая характеристика неметаллов Химических элементов-неметаллов всего 16. Совсем немного, если учесть, что известно 114 элементов. Два
- 4. Биогенные элементы-неметаллы Шесть неметаллов — С, Н, О, N, Р и S — биогенные элементы, которые
- 5. Положение неметаллов в ПС Д.И.Менделеева. Неметаллы расположены в правом верхнем углу ПС (вдоль и над диагональю
- 7. Особенности атомного строения элементов-неметаллов. Для атомов-неметаллов характерно: Небольшой атомный радиус ( в сравнении с радиусами атомов-металлов
- 8. Характеристика простых веществ-неметаллов. Для неметаллов - простых веществ более характерно различие свойствах (физических и химических), чем
- 9. Физические свойства простых веществ – неметаллов. Для неметаллов (простых веществ) характерны все 3 агрегатных состояния при
- 10. Для неметаллов характерна разнообразная цветовая гамма: белый ,черный ,красный фосфор, красно-бурый бром, желтая сера, фиолетовый йод,
- 11. Аллотропия. Среди неметаллов распространено явление аллотропии. Один элемент может образовывать несколько простых веществ. Причины аллотропии: Разные
- 12. Кислород О2 и озон О3 Кислород- газ, без цвета, вкуса и запаха, плохо растворим в воде,
- 13. Сера Физические свойства: Сера- твердое кристаллическое вещество желтого цвета. В воде нерастворима, водой не смачивается (на
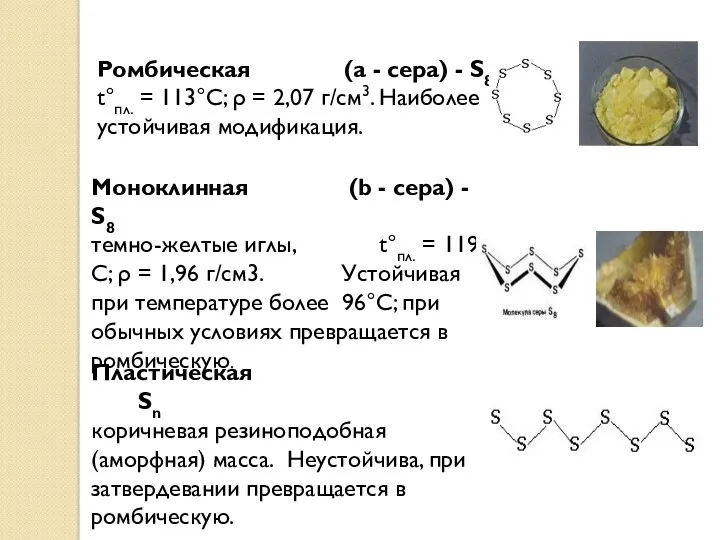
- 14. Ромбическая (a - сера) - S8 t°пл. = 113°C; ρ = 2,07 г/см3. Наиболее устойчивая модификация.
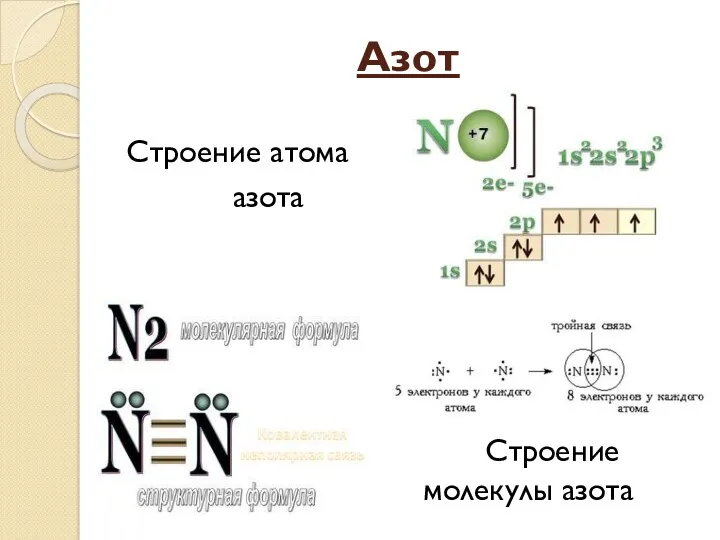
- 15. Азот Строение атома азота Строение молекулы азота
- 18. Биологическая роль азота чистый (элементарный) азот сам по себе не обладает какой-либо биологической ролью. биологическая роль
- 19. Фосфор Элементарный фосфор в обычных условиях представляет собой несколько устойчивых аллотропических модификаций; вопрос аллотропии фосфора сложен
- 20. Биологическая роль соединений фосфора Фосфор присутствует в живых клетках в виде орто- и пирофосфорной кислот, входит
- 21. Белый, красный, чёрный и металлический фосфор
- 22. Белый фосфор Белый фосфор представляет собой белое вещество (из-за примесей может иметь желтоватый оттенок). По внешнему
- 23. Красный фосфор Красный фосфор имеет формулу Рn и представляет собой полимер со сложной структурой. Имеет оттенки
- 24. Чёрный фосфор Чёрный фосфор представляет собой чёрное вещество с металлическим блеском, жирное на ощупь и весьма
- 25. Металлический фосфор При 8,3·1010 Па чёрный фосфор переходит в новую, ещё более плотную и инертную металлическую
- 26. Свободный углерод В свободном виде углерод встречается в нескольких аллотропных модификациях – алмаз, графит, карбин, крайне
- 27. Алмаз Бесцветное, прозрачное, сильно преломляющее свет вещество. Алмаз тверже всех найденных в природе веществ, но при
- 28. Куллинан (алмаз)- 621,35 грамма, размеры: 100х65х50 мм Бриллианты: Куллинан-1, Куллинан-2, Куллинан-3 и 4
- 29. Графит Графит – устойчивая при нормальных условиях аллотропная модификация углерода, имеет серо-черный цвет и металлический блеск,
- 30. Графит
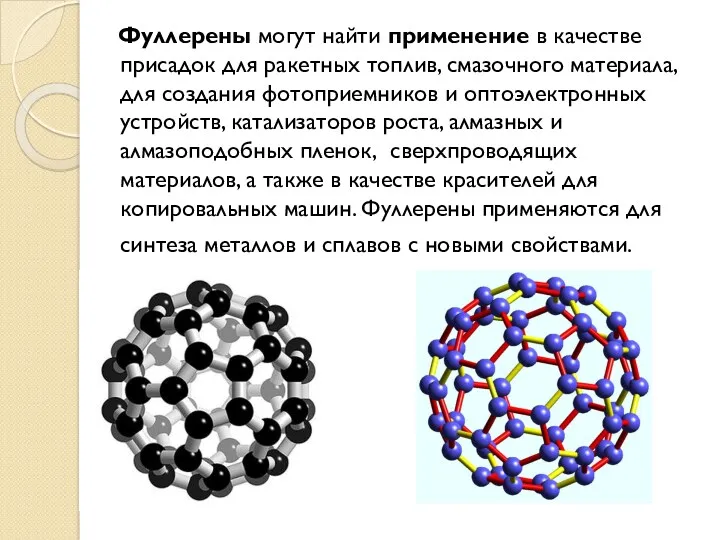
- 31. Фуллерены Фуллерены – класс химических соединений, молекулы которых состоят только из углерода, число атомов которого четно,
- 32. Фуллерены могут найти применение в качестве присадок для ракетных топлив, смазочного материала, для создания фотоприемников и
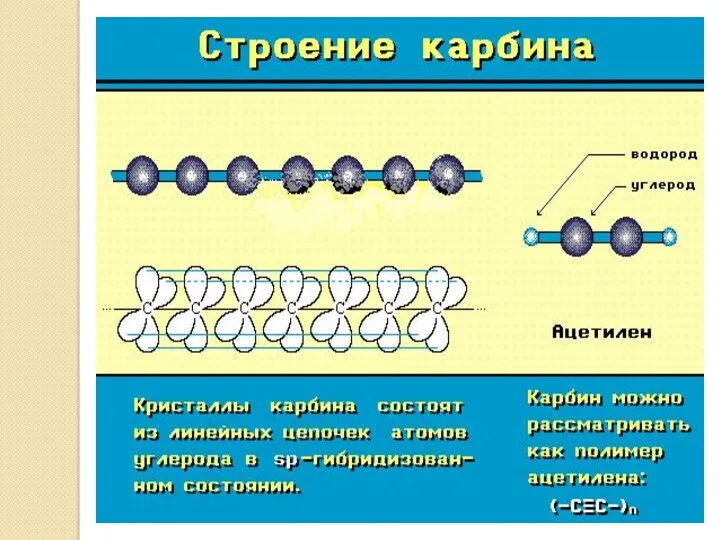
- 33. Карбин Карбин конденсируется в виде белого углеродного осадка на поверхности при облучении пирографита лазерным пучком света.
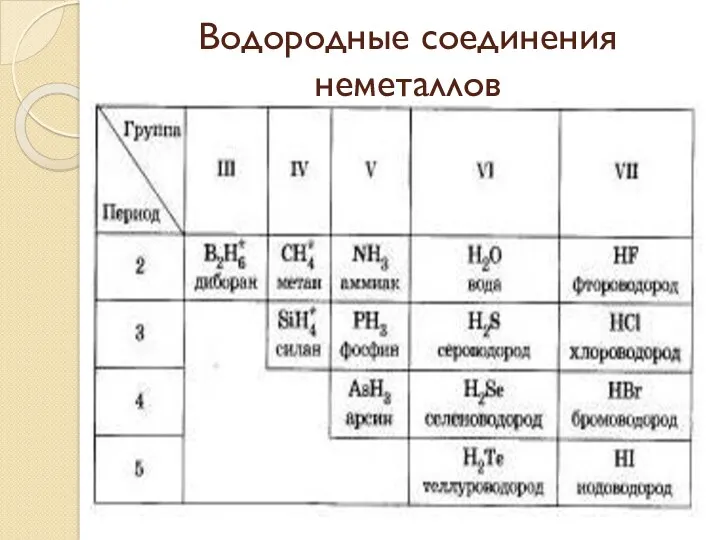
- 35. Водородные соединения неметаллов
- 37. Скачать презентацию





























 Разработка передней подвески легкового автомобиля
Разработка передней подвески легкового автомобиля Кир Булычев. Путешествие Алисы
Кир Булычев. Путешествие Алисы Физическая культура. 11 класс
Физическая культура. 11 класс Wind power plant
Wind power plant инф. о меропр. 2021 КРИПКиПРО (1)
инф. о меропр. 2021 КРИПКиПРО (1) Francesco Petrarca IL CANZONIERE
Francesco Petrarca IL CANZONIERE География религиозного и паломнического туризма
География религиозного и паломнического туризма Бортовые системы контроля и индикации работы авиадвигателей
Бортовые системы контроля и индикации работы авиадвигателей Польові телефонні аппарати, комутатори та кабелі
Польові телефонні аппарати, комутатори та кабелі Моральное стимулирование труда персонала
Моральное стимулирование труда персонала семинар для воспитателей Аутичный ребёнок в детском саду
семинар для воспитателей Аутичный ребёнок в детском саду Изучение общих сведений о строительных машинах
Изучение общих сведений о строительных машинах Корея Республикасы мен ҚР арасындағы келіссөздер мен іс-сапарларға байланысты дайындалатын дипломатиялық қүжаттар
Корея Республикасы мен ҚР арасындағы келіссөздер мен іс-сапарларға байланысты дайындалатын дипломатиялық қүжаттар X съезд федерации независимых профсоюзов России (ФНПР)
X съезд федерации независимых профсоюзов России (ФНПР) Презентация по предмету Культура народов Ямала.
Презентация по предмету Культура народов Ямала. Михаил Зощенко, рассказ Великие путешественники
Михаил Зощенко, рассказ Великие путешественники Тепловое оборудование. Классификация теплового оборудования
Тепловое оборудование. Классификация теплового оборудования Презентация к уроку по теме Дробные выражения
Презентация к уроку по теме Дробные выражения Методика выявления Коммуникативных и организаторских способностей (КОС)
Методика выявления Коммуникативных и организаторских способностей (КОС) Затланышсыз фигыльләр
Затланышсыз фигыльләр Обдирочно-зачистное отделение цеха. Проект электроснабжения
Обдирочно-зачистное отделение цеха. Проект электроснабжения Растительный мир Мещёры
Растительный мир Мещёры Археологические памятники Брянского края
Археологические памятники Брянского края Урок-презентация по теме: Признаки параллелограмма
Урок-презентация по теме: Признаки параллелограмма Фонд жилищного строительства Ямало-Ненецкого автономного округа. Отчет
Фонд жилищного строительства Ямало-Ненецкого автономного округа. Отчет ПДД для младшеклассников
ПДД для младшеклассников Бумага
Бумага Загадочная Антарктида
Загадочная Антарктида