Содержание
- 2. Цель урока: Обобщать и систематизировать знания по теме. Знать о практическом использовании электролиза в промышленном производстве
- 3. План урока: I. Повторение тем: «Электролитическая диссоциация», «Сильные и слабые электролиты» II. Изучение материала по плану:
- 4. Повторение темы: «Электролитическая диссоциация» Электрический ток – это направленное движение электрически заряженных частиц. Вещества, в которых
- 5. По рисунку 1 объясните термин «Электролитическая диссоциация». Расскажите о процессе диссоциации. Как называют положительные и отрицательные
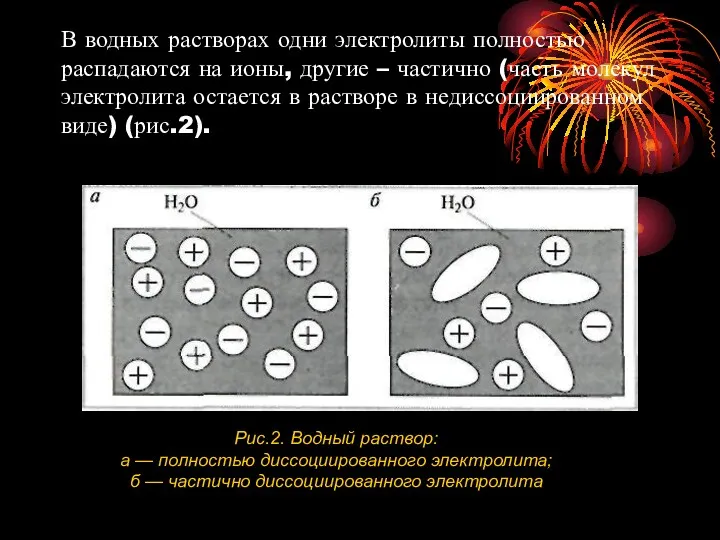
- 6. В водных растворах одни электролиты полностью распадаются на ионы, другие – частично (часть молекул электролита остается
- 7. Чем больше молекул электролита распадается на ионы, тем сильнее электролит. Диссоциация сильных электролитов – необратимый процесс,
- 8. II. Изучение нового материала. 1. Сущность процесса электролиза. Движение ионов в растворе или расплаве электролита является
- 9. Что такое электролиз? В чем заключается сущность электролиза? Электролиз – это окислительно – восстановительный процесс, протекающий
- 10. 2. Правила для определения результатов электролиза. а) Электролиз в расплавах (электроды нерастворимые). NaCl ↔ Na+ +
- 11. Электролиз в растворах. При электролизе водных растворов могут участвовать не только ионы растворенного вещества, но и
- 12. На катоде возможны восстановительные процессы: Ме+ + е = Ме (1) 2Н+ + 2е = Н2
- 13. На аноде возможны окислительные процессы: Окисл. анионов Аn- (4) 4ОН- – 4е = 2О2 + 4Н+
- 14. Какие из этих процессов будут преобладать? На катоде: В растворах процесс на катоде зависит от активности
- 15. На аноде: 1. Если анод активный, окисляется материал анода – процесс 7 На инертном аноде: 2.
- 16. 1-й закон Фарадея: Массы веществ, выделившихся на катоде и аноде, пропорциональны количеству прошедшего через раствор или
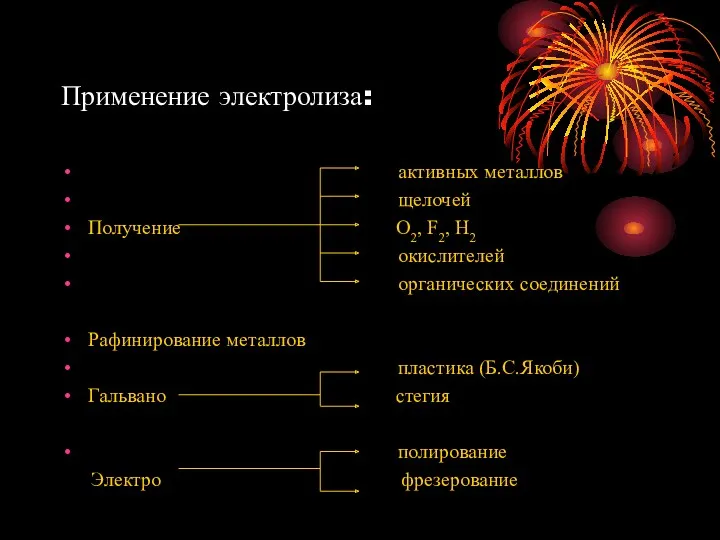
- 17. Применение электролиза: активных металлов щелочей Получение О2, F2, Н2 окислителей органических соединений Рафинирование металлов пластика (Б.С.Якоби)
- 18. Тест по теме «Электролиз» При электролизе раствора сульфата цинка с инертными электродами на аноде выделяется: а)
- 19. 2. Объем кислорода (н.у.) выделившегося на инертном аноде при пропускании электрического тока силой 20 А в
- 20. 3. При электролизе 240 г 15%-го раствора гидро-ксида натрия на аноде выделилось 89,6 л (н. у.)
- 21. 4. При электролизе раствора хлорида натрия образуются: а)натрий и хлор; б)гидроксид натрия, хлор и водород; в)кислород
- 22. 5.При электролизе расплава гидроксида натрия на аноде выделяется: а) натрий; б) водород; в) кислород; г) вода.
- 23. 6.При электролизе раствора хлорида кальция на катоде выделилось 5,6 г водорода. Какова масса (в г) вещества,
- 24. 7.Медный купорос массой 100 г растворили в воде и провели электролиз до обесцвечивания раствора. объем (в
- 25. 8.Платиновый электрод: а)инертный; б)растворимый; в)расходуется в процессе в)расходуется в процессе электролиза; г)не расходуется в процессе электролиза.
- 26. 9.Процесс на катоде при электролизе растворов солей зависит от: а)природы катода; б)активности металла; в)состава аниона; г)не
- 27. 10.При электролизе раствора нитрата меди( П) с медными электродами на аноде будет происходить: а)выделение диоксида азота;
- 28. Правильно
- 29. Неправильно
- 31. Скачать презентацию


























 Презентация проф выгорание
Презентация проф выгорание Святой преподобный Варнава Ветлужский
Святой преподобный Варнава Ветлужский Февральская буржуазно-демократическая революция 1917 г
Февральская буржуазно-демократическая революция 1917 г Мастер-класс по экспериментальной деятельности дошкольников
Мастер-класс по экспериментальной деятельности дошкольников Системы связи и сети передачи информации Виды модуляции сигналов. Детектирование
Системы связи и сети передачи информации Виды модуляции сигналов. Детектирование Языковое портфолио к учебнику И.Н.Верещагина “Students book english ” part 2
Языковое портфолио к учебнику И.Н.Верещагина “Students book english ” part 2 МЫ ТЕПЕРЬ УЧЕНИКИ !
МЫ ТЕПЕРЬ УЧЕНИКИ ! Нагревание воздуха и его температура
Нагревание воздуха и его температура Особенности принятия индивидуальных решений в организационно-управленческой деятельности
Особенности принятия индивидуальных решений в организационно-управленческой деятельности Лилейные. Общие признаки лилейных
Лилейные. Общие признаки лилейных Анализ источников финансирования некоммерческих организаций
Анализ источников финансирования некоммерческих организаций Реклама в печатных СМИ. Структура рекламного объявления
Реклама в печатных СМИ. Структура рекламного объявления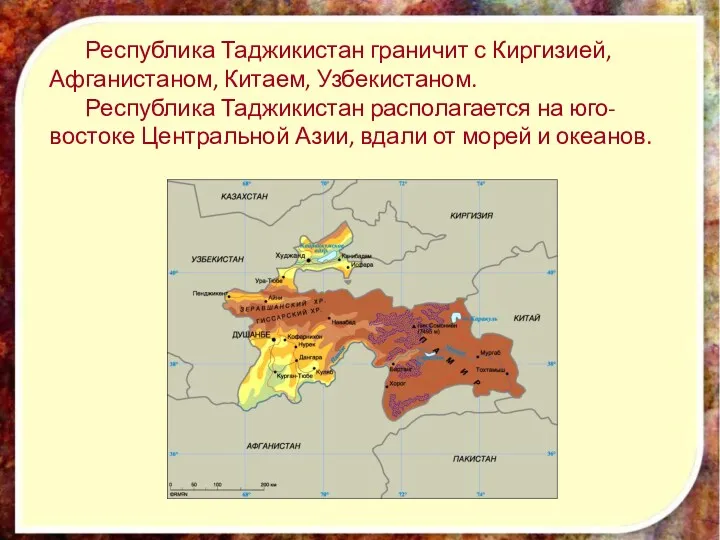 Республика Таджикистан
Республика Таджикистан Профессия моей мечты
Профессия моей мечты Классный час Покорение космоса
Классный час Покорение космоса Перекрестные системы
Перекрестные системы Введение в анестезиологию. Подготовка к обезболиванию и операции. Современный ингаляционный и неингаляционный наркоз
Введение в анестезиологию. Подготовка к обезболиванию и операции. Современный ингаляционный и неингаляционный наркоз Разработка web- дизайна для магазина автозапчастей ООО Форсаж с использованием CSS и анимации на JavaScript
Разработка web- дизайна для магазина автозапчастей ООО Форсаж с использованием CSS и анимации на JavaScript Золотой фонд прессы России
Золотой фонд прессы России Строгание. Виды рубанков
Строгание. Виды рубанков Промышленные роботы. Робототехника
Промышленные роботы. Робототехника Демократические выборы и политические партии
Демократические выборы и политические партии Применение данных каротажа в процессе бурения с использованием комплексных приборов LWD121-2ННК-ГГКЛП и LWD172-2ННК-ГГКЛП-3Г
Применение данных каротажа в процессе бурения с использованием комплексных приборов LWD121-2ННК-ГГКЛП и LWD172-2ННК-ГГКЛП-3Г Камни. Разные по форме, по размеру, по цвету
Камни. Разные по форме, по размеру, по цвету Кряшенское храмостроительство: прошлое и настоящее
Кряшенское храмостроительство: прошлое и настоящее Организация развивающей предметно-пространственной среды в соответствии с ФГОС ДО. Образовательная область Познавательное развитие
Организация развивающей предметно-пространственной среды в соответствии с ФГОС ДО. Образовательная область Познавательное развитие Границы биосферы, ее структура и функции
Границы биосферы, ее структура и функции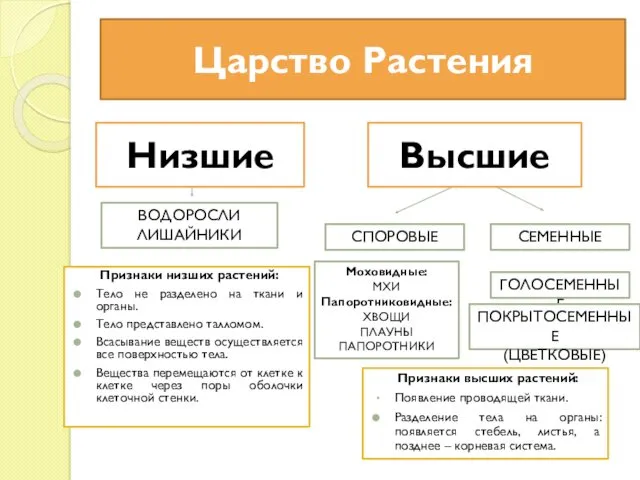 Царство Растения. Низшие Водоросли Лишайники
Царство Растения. Низшие Водоросли Лишайники