Содержание
- 2. Цель: Познакомить с научными химическими достижениями во время Первой Мировой Войны и их последствиями. Расширить и
- 3. Историческая справка Эта история произошла во время I мировой войны. Ещё было далеко до рассвета, но
- 4. Проблема Химия и Первая Мировая Война. Что связывает эти слова?
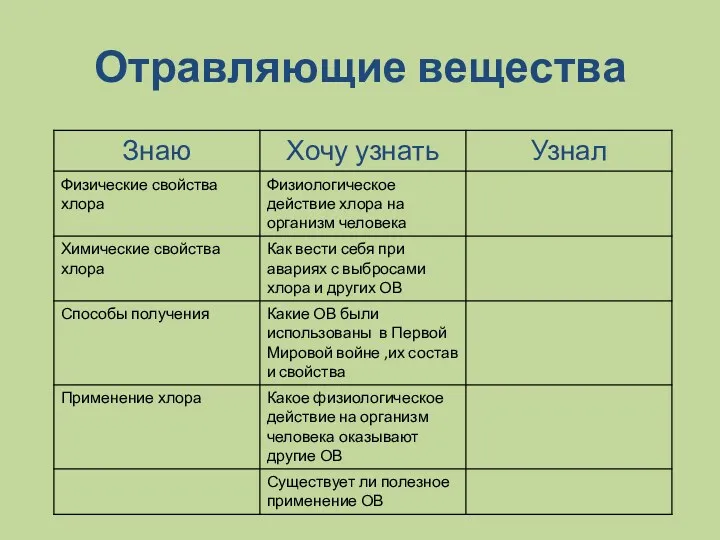
- 5. Отравляющие вещества
- 6. Хлор Физиологическое действие хлора на организм человека По физиологическому действию на организм хлор относится к группе
- 7. Нейтрализация хлора Основной способ нейтрализации – это взаимодействие с водой: Cl2 + H2O = HCl +
- 8. Слезоточивый газ
- 9. Фосген Физические свойства Фосген (СG) при обычных условиях бесцветный газ, тяжелее воздуха в 3,5 раза, с
- 10. Химические свойства фосгена - фосген хорошо гидролизуется, особенно в щелочной среде СОСl2 + 4NaOH → Na2CO3
- 11. Иприт Иприт – это разновидность химического вещества боевого действия группы кожно-нарывных веществ, которые вызывают появление нарывов
- 12. Химические свойства иприта При обычной температуре иприт представляет собой устойчивое соединение. При нагревании выше 170 °C
- 13. Физиологическое действие на организм Иприт воздействует на организм, разрушая клеточные мембраны, нарушая обмен углеводов. Иприт поражает
- 14. Синильная кислота Физические свойства бесцветная, прозрачная, очень подвижная жидкость с запахом горького миндаля (при малых концентрациях),смешивается
- 15. Получение СН4 + NH3 +1,5 O2 → HCN + 4H2O в присутствии катализаторов Физиологическое действие на
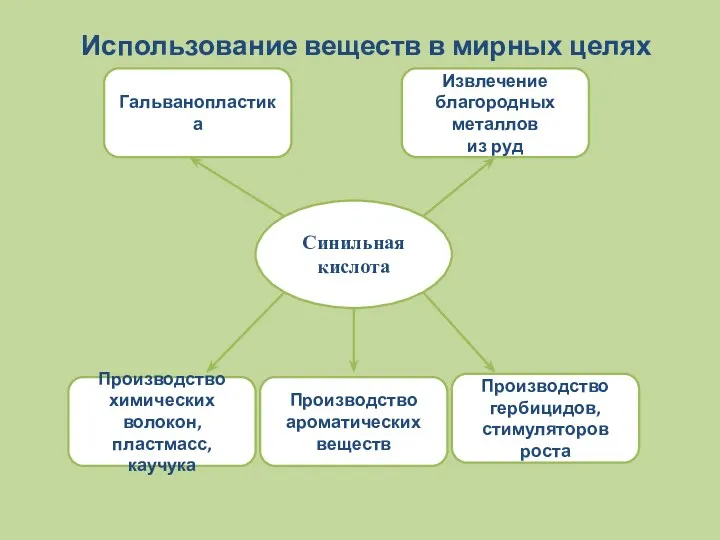
- 16. Использование веществ в мирных целях
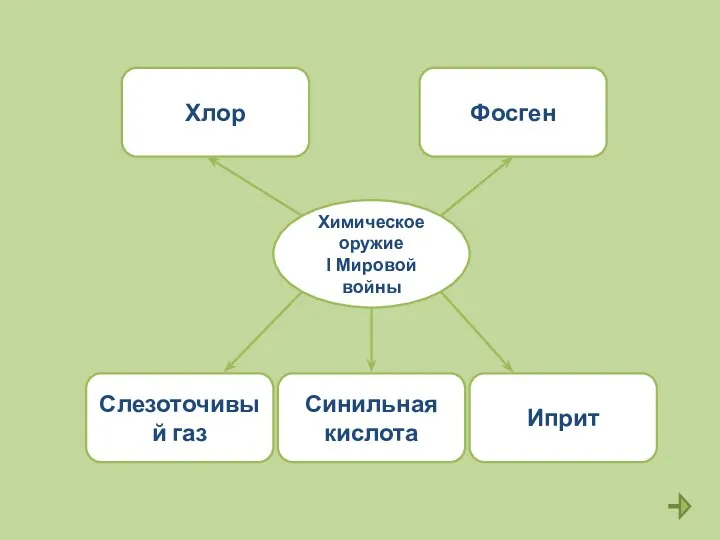
- 17. Самостоятельная работа 1.Это произошло в солнечный день 22 апреля 1915 года. Солдаты увидели желтый туман, от
- 18. Соотнесите исторические события с используемыми ОВ Отравляющие вещества Фосген Хлор Синильная кислота Слезоточивый газ Иприт Историческое
- 19. Применение знаний в новых ситуациях Решите задачу: При аварии на химическом заводе произошла утечка 400 кг.
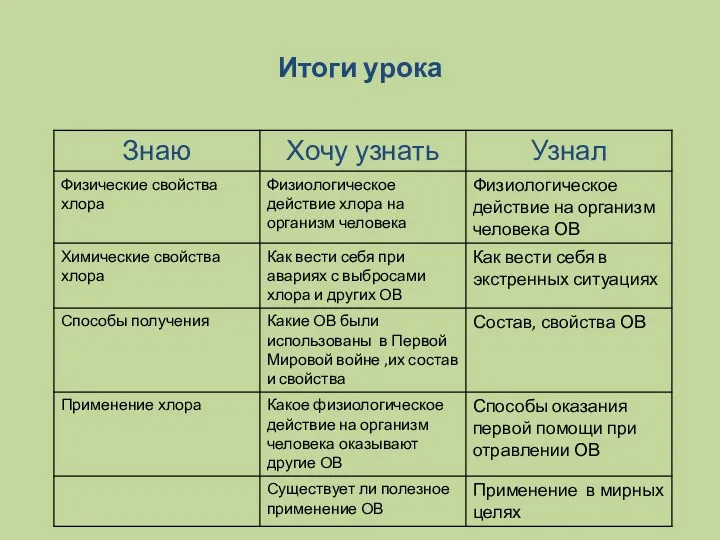
- 20. Итоги урока
- 21. Проблема уничтожения химического оружия Использование химического оружия в наши дни запрещено. Уничтожение арсеналов отравляющих веществ -
- 23. Скачать презентацию
















 Начало столетней войны. Соперничество Англии и Франции. Жакерия
Начало столетней войны. Соперничество Англии и Франции. Жакерия пед.проектДифференцированный подход в обучении математики, как способ развития познавательной активности на уроке
пед.проектДифференцированный подход в обучении математики, как способ развития познавательной активности на уроке Романтизм и реализм романа Герой нашего времени. Роман в оценке В. Г. Белинского
Романтизм и реализм романа Герой нашего времени. Роман в оценке В. Г. Белинского Университетский гуманитарный класс
Университетский гуманитарный класс Технологии приема ТВ сигнала
Технологии приема ТВ сигнала Нестероїдні протизапальні засоби
Нестероїдні протизапальні засоби Решение задач по информатике ( по типу ОГЭ)
Решение задач по информатике ( по типу ОГЭ) Технологии сборочного производства
Технологии сборочного производства Сопереживание в картинах художников
Сопереживание в картинах художников Производство алюминия
Производство алюминия Современные образовательные технологии
Современные образовательные технологии Таблица сложения. Тренажёр Игра в футбол
Таблица сложения. Тренажёр Игра в футбол Развитие индивидуального жилищного строительства в Российской Федерации АО Банк ДОМ.РФ
Развитие индивидуального жилищного строительства в Российской Федерации АО Банк ДОМ.РФ Станционные пути и габаритные расстояния
Станционные пути и габаритные расстояния Функциональная полупроводниковая электроника. УФЭ (3)
Функциональная полупроводниковая электроника. УФЭ (3) Снегурочка в языческой культуре славян
Снегурочка в языческой культуре славян Сложение натуральных чисел
Сложение натуральных чисел Розв’язування текстових задач за допомогою систем рівнянь
Розв’язування текстових задач за допомогою систем рівнянь KS4502 包装指引 - 配 个电池 盖
KS4502 包装指引 - 配 个电池 盖 Презентация Новогодняя игрушка
Презентация Новогодняя игрушка Цінність послуги
Цінність послуги Правосознание и правовая культура. (Тема 18)
Правосознание и правовая культура. (Тема 18) Хрустальные деревья
Хрустальные деревья Состав и содержание проектно-конструкторской документации на швейные изделия
Состав и содержание проектно-конструкторской документации на швейные изделия Анемии у детей-4
Анемии у детей-4 Мастер класс Волшебные ленты
Мастер класс Волшебные ленты Построение третьего вида по двум данным
Построение третьего вида по двум данным Система менеджмента качества в аптечных организациях
Система менеджмента качества в аптечных организациях