Содержание
- 2. Цели урока: Знать строение и свойства азотной кислоты и ее солей. Уметь составлять уравнения реакций, отражающие
- 3. O H O N Структурная формула O Строение молекулы азотной кислоты:
- 4. Физические свойства Бесцветная, дымящаяся, неограниченно растворимая в воде жидкость, обладающая резким раздражающим запахом. t°пл.= -41°C; t°кип.=
- 5. Получение. Лабораторный способ: Действие конц. серной кислоты на кристаллические нитраты. KNO3 + H2SO4(конц) = KHSO4 +
- 6. Получение. Промышленный способ осуществляется в 3 этапа: 1) Окисление аммиака на платиновом катализаторе до NO 4NH3
- 7. ХИМИЧЕСКИЕ СВОЙСТВА - Общие с другими кислотами - - Специфические свойства
- 8. Общие химические свойства HNO3: Очень сильная кислота. Диссоциирует в водном растворе практически нацело. HNO3 H++NO3-
- 9. Разбавленная азотная кислота проявляет все свойства кислот: 1. взаимодействует с основными и амфотерными оксидами. 2. взаимодействует
- 10. HNO3: Реагирует с основными и амфотерными оксидами CuO + 2HNO3 = Cu(NO3)2 + H2O CuO +
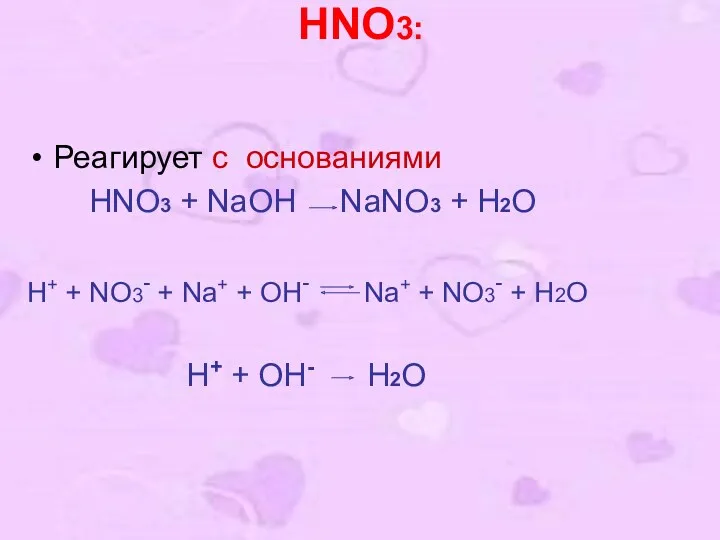
- 11. HNO3: Реагирует с основаниями HNO3 + NaOH NaNO3 + H2O H+ + NO3- + Na+ +
- 12. HNO3: вытесняет слабые кислоты из их солей 2HNO3 + Na2CO3 2NaNO3 + H2O + CO2 2H+
- 13. Азотная кислота проявляет особые свойства: Взаимодействие с металлами Взаимодействие с неметаллами Взаимодействие с органическими соединениями Разложение
- 14. Специфические свойства азотной кислоты При взаимодействии с металлами никогда не выделяется водород!! металл + HNO3 =
- 15. Азотная кислота: взаимодействие с металлами.
- 16. Реакция с металлами: Большинство металлов реагируют с азотной кислотой с выделением азота или его оксидов в
- 17. HNO3 реагирует с неметаллами: Азотная кислота превращается в NO (или в NO2); неметаллы окисляются до соответствующих
- 18. Азотная кислота 1. Разлагается на свету и при нагревании: 4HNO3 = 2H2O + 4NO2 + O2
- 19. Реакции с органическими веществами: Окрашивает белки в желтый цвет ("ксантопротеиновая реакция")
- 20. Качественная реакция на ион NO3- Вещество + медные стружки + H2SO4(к.)+ t0 NaNO3 + H2SO4(к.) =
- 21. Соли азотной кислоты называются нитратами (селитрами) NaNO3 – нитрат натрия Cu(NO3)2 – нитрат меди(II)
- 22. РАЗЛОЖЕНИЕ НИТРАТОВ при нагревании: 1) Нитраты щелочных металлов разлагаются до нитритов: 2NaNO3 = 2NaNO2 + O2
- 24. Скачать презентацию




















 Компьютерные игры и их влияние на развитие ребенка
Компьютерные игры и их влияние на развитие ребенка Река Нил
Река Нил Выступление МАОУ24 14.02.22 Гришаткина С.А
Выступление МАОУ24 14.02.22 Гришаткина С.А Диагностические материалы по хореографии
Диагностические материалы по хореографии Урок по географии 8 класс Байкал-— жемчужина Сибири
Урок по географии 8 класс Байкал-— жемчужина Сибири Наряд для семейного обеда. (Технология, 6 класс)
Наряд для семейного обеда. (Технология, 6 класс) Вокально-хоровая студия. Церковное пение
Вокально-хоровая студия. Церковное пение Морфемика и словообразование
Морфемика и словообразование Деление обыкновенных дробей
Деление обыкновенных дробей Атомная энергетика и ее экологические проблемы
Атомная энергетика и ее экологические проблемы Пути осуществления духовно- нравственного воспитания дошкольников в условиях ФГОС
Пути осуществления духовно- нравственного воспитания дошкольников в условиях ФГОС Облекитесь во всеоружие Божие (Посл.к Еф.6:11)
Облекитесь во всеоружие Божие (Посл.к Еф.6:11) Измерительные трансформаторы тока
Измерительные трансформаторы тока Колбасные изделия
Колбасные изделия Эпителиальные ткани
Эпителиальные ткани Химическая связь.
Химическая связь. Редкие растения Тверской области
Редкие растения Тверской области Платежи в бюджет по доходам
Платежи в бюджет по доходам Системы неравенств с двумя переменными
Системы неравенств с двумя переменными Зона отдыха Цветик-семицветик
Зона отдыха Цветик-семицветик Догмат о искуплении
Догмат о искуплении Социальная реабилитация (медико-социальная экспертиза)
Социальная реабилитация (медико-социальная экспертиза) Материал для внеклассной работы. Презентация. Брейн ринг 2-3 класс
Материал для внеклассной работы. Презентация. Брейн ринг 2-3 класс Особенности обеспечения личной безопасности при обезвреживании вооруженных и особо опасных преступников
Особенности обеспечения личной безопасности при обезвреживании вооруженных и особо опасных преступников Морозные узоры на окне
Морозные узоры на окне Хто головніше. Суперечка побутових приладів
Хто головніше. Суперечка побутових приладів Взаимосвязь религиозно-мифологических представлений викингов и их образа жизни
Взаимосвязь религиозно-мифологических представлений викингов и их образа жизни Видение, миссия и цели организации
Видение, миссия и цели организации