Слайд 2

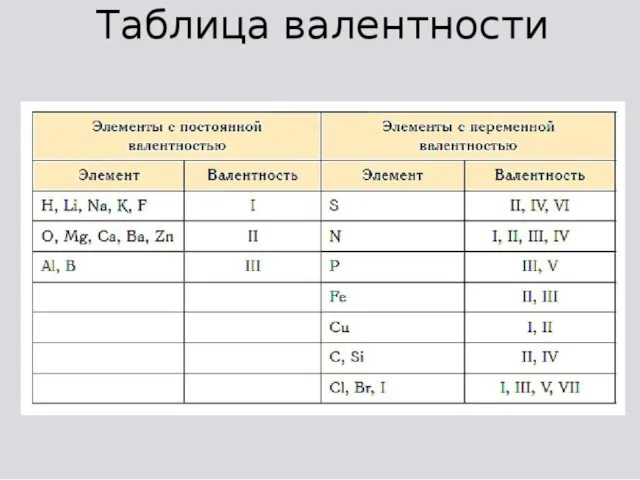
Валентность (от лат. «valentia» - сила) - способность атома присоединять или замещать определённое число
других атомов или атомных групп с образованием химической связи. Обозначается римскими цифрами
Слайд 3

У металлов главных групп Периодической системы валентность равна номеру группы.
У
неметаллов высшая валентность элемента равна номеру его группы в Периодической системе Д.И. Менделеева. Низшая валентность находится как разница между числом 8 и номером группы, в которой расположен данный элемент
Слайд 4

!Валентность водорода всегда принимают за 1.
!Кислород всегда проявляет в своих соединениях
валентность 2.
!Валентность алюминия и бора всегда равна 3
Слайд 5
Слайд 6

Слайд 7

Na2O
I
II
2
НОК
2/1 = 2 2/2 = 1 (не пишется)
Слайд 8
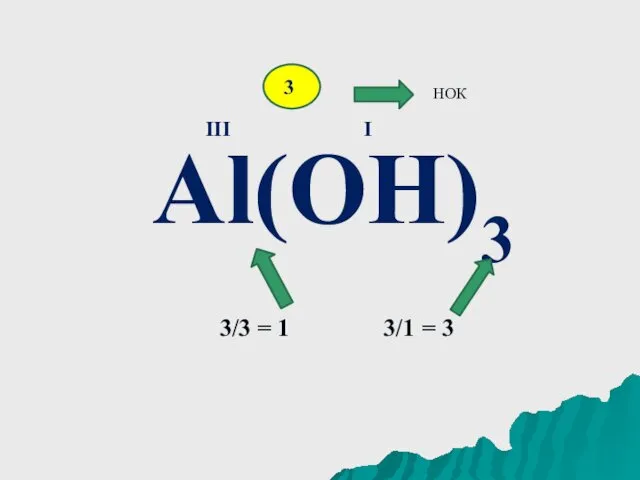
Al(OH)3
III
I
3
НОК
3/3 = 1 3/1 = 3
Слайд 9
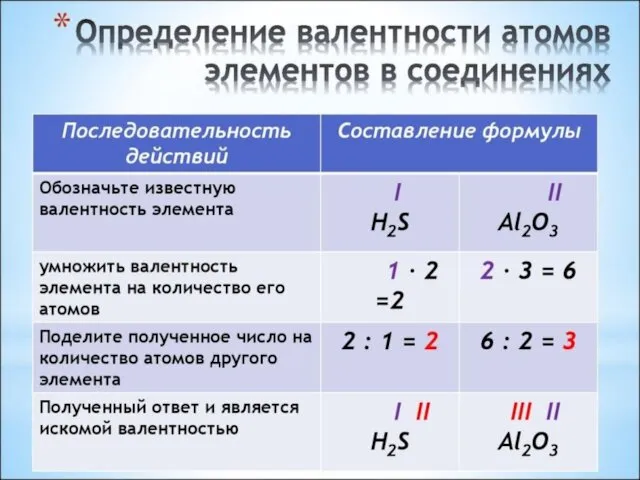
Слайд 10

Степень окисления (с.о.) - условный заряд атома данного элемента в соединении,
вычисленный, исходя из предположения, что все атомы в молекуле ионизированы, т.е. имеют заряд. Обозначается арабскими цифрами со знаком + или -
Слайд 11

У металлов главных подгрупп Периодической системы степень окисления в соединениях равна номеру
группы: Na+1Cl−1, Li+12O−2, Mg+2F−12, Ba+2O−2.
Степень окисления алюминия равна +3: Al+32S−23.
У фтора степень окисления равна -1: H+1F−1, K+1F−1.
Кислород почти всегда имеет степень окисления -2: Na+12O−2, C+4O2−2. Исключения - фторид кислорода и пероксиды: O+2F−12, H+12O−12.
В большинстве соединений степень окисления водорода +1, но в соединениях с металлами она равна -1: H+1Br−1, N−3H+13, Na+1H−1, Ca+2H−12.
У атомов остальных неметаллов максимальное значение степени окисления тоже равно номеру группы в Периодической системе. Минимальное значение степени окисления можно определить, если от номера группы отнять 8
Слайд 12

!Степень окисления простого вещества равна нулю.
!Сумма всех степеней окисления в мложном
веществе равна нулю.
!В сложных веществах степень окисления атомов металла всегда положительная. Атомы неметаллов имеют как положительные, так и отрицательные степени окисления
Слайд 13

Слайд 14

Понятие валентности можно считать родственным такой характеристике, как степень окисления. Тем
не менее, обе эти характеристики не тождественны друг другу.
Валентность ≠ С.О.
Слайд 15

Говоря о степени окисления, подразумевают, что атом в веществе ионной (что
важно) природы имеет некий условный заряд. И если валентность - это нейтральная характеристика, то степень окисления может быть отрицательной, положительной или равной нулю














 Интеллектуальная игра Что такое хорошо и что такое плохо для учеников 2-го класса
Интеллектуальная игра Что такое хорошо и что такое плохо для учеников 2-го класса День матери
День матери Логарифмы. История возникновения
Логарифмы. История возникновения Презентация к внеклассному мероприятию Россия -Родина моя
Презентация к внеклассному мероприятию Россия -Родина моя Системное программное обеспечение
Системное программное обеспечение Готовность к школе
Готовность к школе Предельные одноосновные карбоновые кислоты
Предельные одноосновные карбоновые кислоты Внеурочная деятельность. Театр (презентация).
Внеурочная деятельность. Театр (презентация). Русская православная церковь
Русская православная церковь General information about electrical networks
General information about electrical networks Услуга МультиФон Бизнес от Мегафон. Многоканальная офисная IP-телефония
Услуга МультиФон Бизнес от Мегафон. Многоканальная офисная IP-телефония Отладка программных продуктов. Ручное и автоматизированное тестирование
Отладка программных продуктов. Ручное и автоматизированное тестирование Химия биогенных элементов
Химия биогенных элементов Мастер-класс Цветок из атласных лент
Мастер-класс Цветок из атласных лент Ток шектеуіш реактор
Ток шектеуіш реактор White tower of London
White tower of London Работа с родителями по вопросам организации трудового воспитания, формированеи в семье трудовых обязанностей детей
Работа с родителями по вопросам организации трудового воспитания, формированеи в семье трудовых обязанностей детей Поездка Могилев - Смоленск - Талашкино
Поездка Могилев - Смоленск - Талашкино Развитие опытно - экспериментальной деятельности детей раннего возраста, через использование игр – экспериментов с песком и водой
Развитие опытно - экспериментальной деятельности детей раннего возраста, через использование игр – экспериментов с песком и водой Измерение крупногабаритных деталей с высокой точностью с использованием мостовых КИМ Coord3 и специализированной оснастки Alufix
Измерение крупногабаритных деталей с высокой точностью с использованием мостовых КИМ Coord3 и специализированной оснастки Alufix Геологическое строение Саратовской области
Геологическое строение Саратовской области Презентация Кайбицкий район
Презентация Кайбицкий район Writing an essay (C2)
Writing an essay (C2) Ребусы
Ребусы Easter monday
Easter monday Мотивация учения- основное условие успешного обучения Выступление на педсовете
Мотивация учения- основное условие успешного обучения Выступление на педсовете Презентация Строительные игры Диск
Презентация Строительные игры Диск Презентация к уроку Вода. Разновидности воды.
Презентация к уроку Вода. Разновидности воды.