Важнейшие классы неорганических соединений, способы их получения и химические свойства. Соли. презентация
Содержание
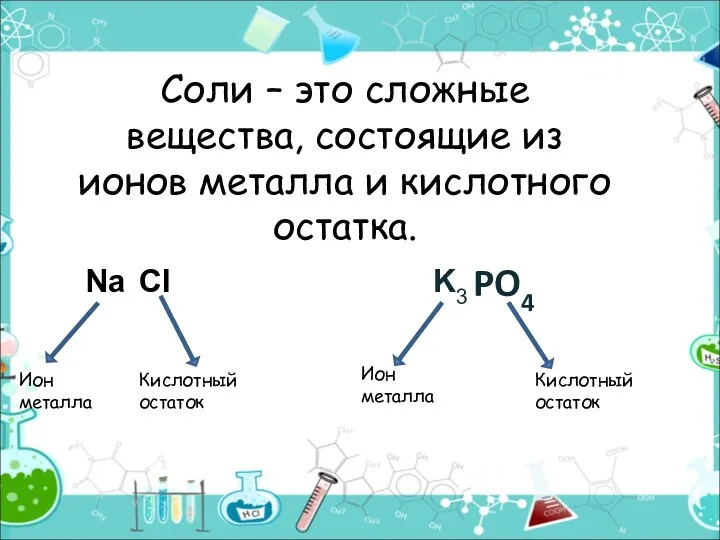
- 2. Соли – это сложные вещества, состоящие из ионов металла и кислотного остатка. PO4 Ион металла Кислотный
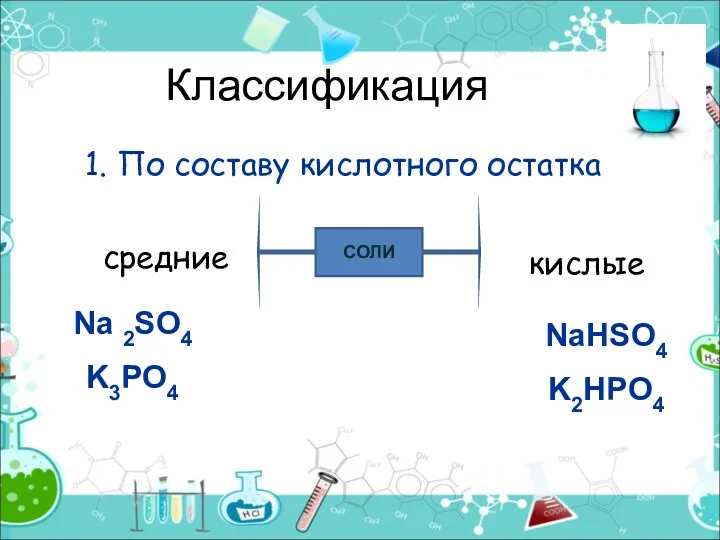
- 3. Классификация 1. По составу кислотного остатка СОЛИ средние кислые Na 2SO4 K3PO4 NaHSO4 K2HPO4
- 4. Номенклатура средних солей магния Название кислотного остатка Наименование металла в родительном падеже МgСL2 хлорид
- 5. Номенклатура кислых солей Указать название кислотного остатка К названию кислотного остатка прибавить «гидро-» Наименование металла в
- 6. Химические свойства 1. Взаимодействие с металлами: SnCl2 + Zn ? ZnCl2 + Sn
- 7. Химические свойства 2. Взаимодействие со щелочами: 2NaОН + CuSO4 → Cu(OH)2 + Na2SO4
- 8. Химические свойства 3. Взаимодействие солей между собой КСl + AgNO3 → AgCl + KNO3
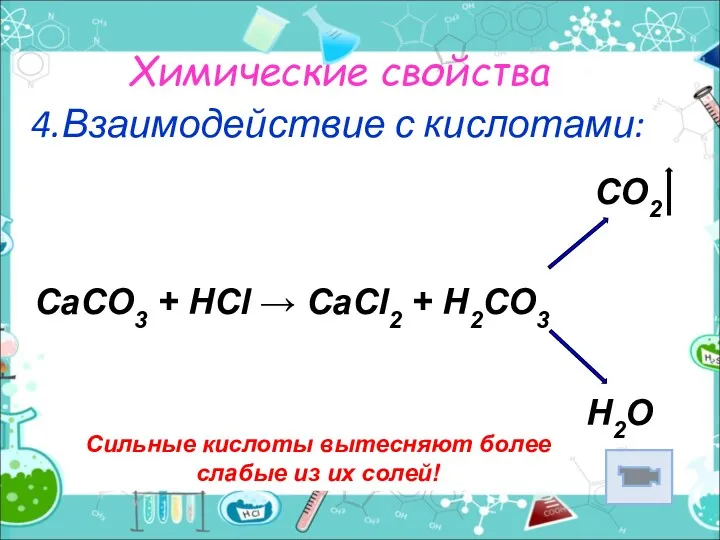
- 9. Химические свойства 4.Взаимодействие с кислотами: Сильные кислоты вытесняют более слабые из их солей! CO2 CaCO3 +
- 10. Химические свойства Разложение при нагревании СаСО3= СО2 + Н2О
- 11. Способы получения 1. Кислота + основание = соль + вода H2SO4 +2NaOH = Na2SO4 + 2H2O
- 13. Скачать презентацию







 Презентация проекта Луковое счастье.
Презентация проекта Луковое счастье. Презентация Мировой океан.
Презентация Мировой океан. Конспект урока по теме: Простые задачи на нахождение процентов
Конспект урока по теме: Простые задачи на нахождение процентов Углеводороды. Основные гомологические ряды. Типичные представители рядов
Углеводороды. Основные гомологические ряды. Типичные представители рядов Роль школьного музея в духовно-нравственном воспитании обучающихся
Роль школьного музея в духовно-нравственном воспитании обучающихся Литературная викторина Диск
Литературная викторина Диск Нормативные документы по обеспечению транспортной безопасности
Нормативные документы по обеспечению транспортной безопасности История создания МЧС.
История создания МЧС. Изгибаемые элементы. Расчет прочности нормальных сечений. Тема 7
Изгибаемые элементы. Расчет прочности нормальных сечений. Тема 7 CASE-технологии
CASE-технологии Класс Млекопитающие. 4 500 видов. Систематика
Класс Млекопитающие. 4 500 видов. Систематика Презентация к диплому
Презентация к диплому Управление временем, или тайм – менеджмент
Управление временем, или тайм – менеджмент Валюта будущего - Bitcoin
Валюта будущего - Bitcoin Лакокрасочные матариалы
Лакокрасочные матариалы Итоговый отчёт по работе: Экология
Итоговый отчёт по работе: Экология Государство Норвегия
Государство Норвегия Русский дом
Русский дом Углеводороды. Алкены
Углеводороды. Алкены Общая характеристика способов и средств наблюдения
Общая характеристика способов и средств наблюдения Проект 6
Проект 6 Состав штукатурных работ
Состав штукатурных работ Презентация Путешествие в страну Мойдодыра
Презентация Путешествие в страну Мойдодыра Geographical situation, climate, government of Great Britain
Geographical situation, climate, government of Great Britain Cистемная красная волчанка
Cистемная красная волчанка Псориаз. Красный плоский лишай
Псориаз. Красный плоский лишай Паспорт проекта ПСР (шаблон), рекомендации по выбору ПСР проектов
Паспорт проекта ПСР (шаблон), рекомендации по выбору ПСР проектов Серия бесед по Евангелию от Матфея
Серия бесед по Евангелию от Матфея