Содержание
- 2. Цель урока: Образовательная -Обеспечить в ходе урока усвоения знаний о соединениях алюминия: оксидах и гидроксидах. -
- 3. Структура урока: I этап – организационный II этап – актуализация знаний III этап – добыча новых
- 5. Добыча новых знаний
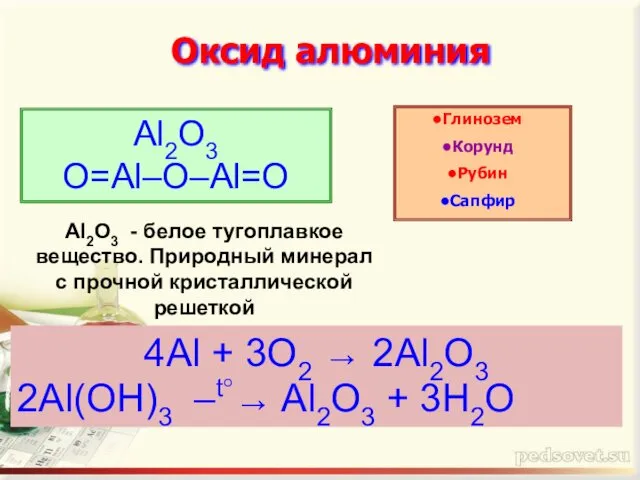
- 6. Оксид алюминия Al2O3 O=Al–O–Al=O Глинозем Корунд Рубин Сапфир 4Al + 3O2 → 2Al2O3 2Al(OH)3 –t°→ Al2O3
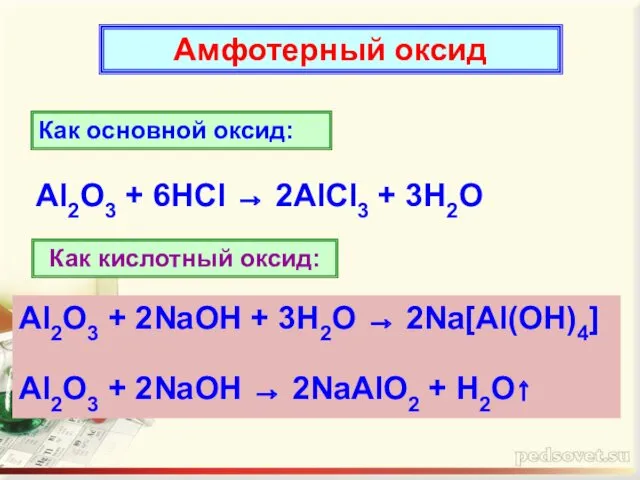
- 7. Амфотерный оксид Как основной оксид: Al2O3 + 6HCl → 2AlCl3 + 3H2O Как кислотный оксид: Al2O3
- 8. Гидроксид алюминия Al(OH)3 AlCl3 + 3NaOH → Al(OH)3↓ + 3NaCl Гидроксид алюминия Al(OН)3 – белое, кристаллическое
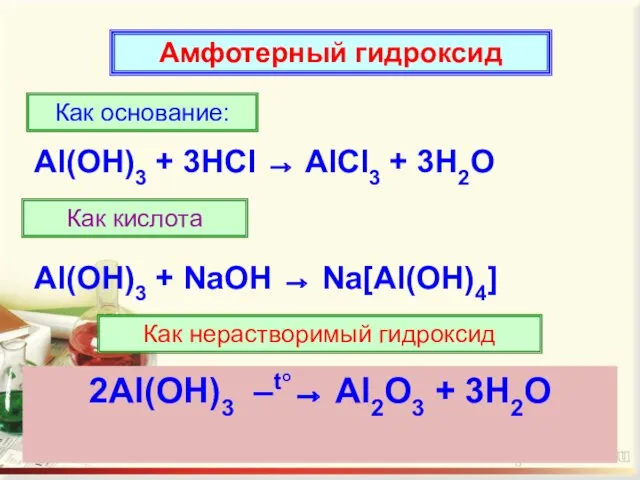
- 9. Амфотерный гидроксид Как основание: Al(OH)3 + 3HCl → AlCl3 + 3H2O Как кислота Al(OH)3 + NaOH
- 10. Соли алюминия Растворимы в воде Нерастворимые в воде: фосфаты Разлагаются водой: сульфиты, сульфиды Соли неустойчивых алюминиевых
- 11. Применение Al и его соединений В чистом виде алюминий находит применение из-за своей мягкости: из него
- 13. Сплавы алюминия используют в строительстве, т. к. из них легко изготовить различные профили балок и разные
- 14. Гель из гидроксида алюминия входит в состав лекарств для лечения болезней желудка. Гидроксид алюминия используется для
- 15. Применение сапфиров и рубинов
- 16. Закрепление
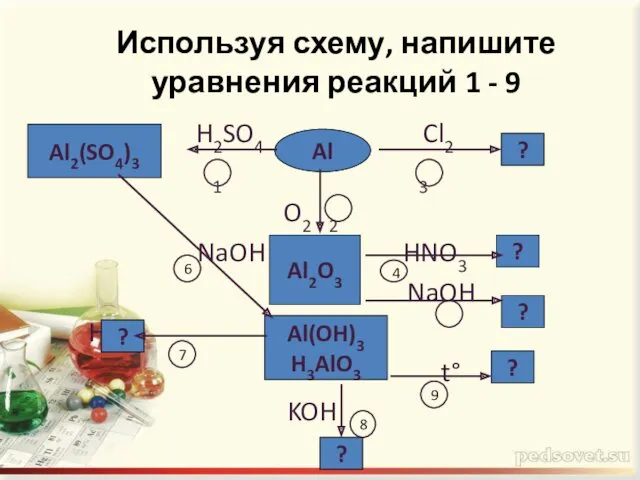
- 18. Используя схему, напишите уравнения реакций 1 - 9 H2SO4 Cl2 1 3 O2 2 NaOH HNO3
- 19. Домашнее задание: § 47, № 5
- 20. РЕФЛЕКСИЯ Мне все понравилось Мне ничего не понятно Мне было интересно Мне было скучно Мне было
- 22. Скачать презентацию















 Майский праздник День Победы
Майский праздник День Победы Формы и методы работы с молодежью за рубежом
Формы и методы работы с молодежью за рубежом Европейский и американский дизайн упаковки 2000-х годов
Европейский и американский дизайн упаковки 2000-х годов Освобождение Брестской области от немецко-фашистских захватчиков
Освобождение Брестской области от немецко-фашистских захватчиков Озера
Озера Санкт-Петербург - город архитектурных шедевров в XIX веке
Санкт-Петербург - город архитектурных шедевров в XIX веке Строение иммунной системы
Строение иммунной системы Государственная пошлина
Государственная пошлина Туберкулез мочеполовой системы
Туберкулез мочеполовой системы Автотрансформаторы
Автотрансформаторы Современная отрасль масс медиа
Современная отрасль масс медиа Первая русская революция (1905-1907)
Первая русская революция (1905-1907) Звіт по роботі в Житомирській області. Шаблон
Звіт по роботі в Житомирській області. Шаблон Бактерии
Бактерии Охрана растений
Охрана растений Perfekte Party
Perfekte Party Примерная структура совета обучающихся профессиональной образовательной организации и организации высшего образования
Примерная структура совета обучающихся профессиональной образовательной организации и организации высшего образования Нарушения кровообращения и лимфообращения
Нарушения кровообращения и лимфообращения Гидравлический расчет двухтрубных и однотрубных систем отопления
Гидравлический расчет двухтрубных и однотрубных систем отопления Презентация Виды искусства
Презентация Виды искусства Святкування Нового року в країнах світу
Святкування Нового року в країнах світу презентация Экологическое воспитание младших школьников
презентация Экологическое воспитание младших школьников Спрос на деньги. Равновесие на денежном рынке. Совокупный спрос. Фискальная и монетарная политика
Спрос на деньги. Равновесие на денежном рынке. Совокупный спрос. Фискальная и монетарная политика Презентация по правилам использования корпоративного шаблона в рамках СМК
Презентация по правилам использования корпоративного шаблона в рамках СМК Формула стиля. Рекомендации от эксперта стилиста Милы Столяренко
Формула стиля. Рекомендации от эксперта стилиста Милы Столяренко Купола над белым безмолвием.
Купола над белым безмолвием. Конкурс для педагогов. Учебный 2022 год с Марусей
Конкурс для педагогов. Учебный 2022 год с Марусей Местоимения обобщение(Моя)
Местоимения обобщение(Моя)