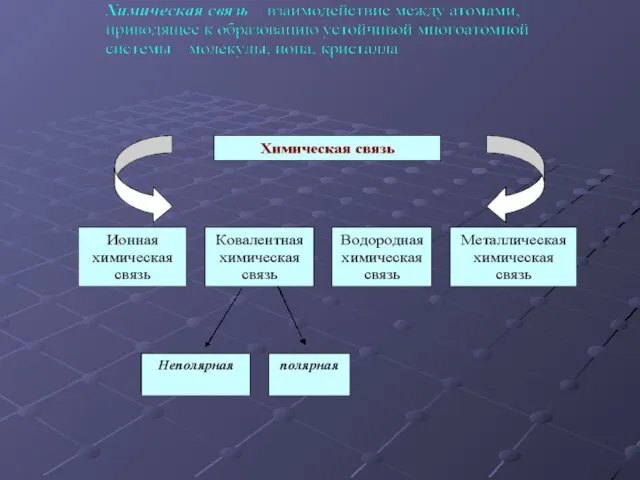
Водородная химическая связь – это электростатическое притяжение между положительно поляризованными атомами
водорода одной молекулы и отрицательно поляризованными атомами (F, O, N) другой молекулы.
Механизм образования водородной связи близок к донорно-акцепторному ( R –Н δ+ …. Э δ- – R)
Межмолекулярная водородная связь (значительно влияет на агрегатное состояние, плотность, температуры кипения и плавления, теплоту парообразования и т.д.)
δ- δ+
О Н О
Н С δ+ δ- С Н
О Н О
Внутримолекулярные водородные связи играют большую роль в формировании вторичной структуры белков, поддержании двойной спирали ДНК, сложной формы т-РНК









 ВИЧ и СПИД. Пути передачи, теории происхождения и меры профилактики
ВИЧ и СПИД. Пути передачи, теории происхождения и меры профилактики Отряд Очумелые ручки 3 класс
Отряд Очумелые ручки 3 класс Проект по специальности строительство и эксплуатация автомобильных дорог и аэродромов Дорога в облака
Проект по специальности строительство и эксплуатация автомобильных дорог и аэродромов Дорога в облака Ученик года - 2017
Ученик года - 2017 Игра Поле чудес для начальной школы В мире сказок
Игра Поле чудес для начальной школы В мире сказок Родительское собрание Адаптация первоклассника к школе Презентация.
Родительское собрание Адаптация первоклассника к школе Презентация. PrezentaciyaReestrGY
PrezentaciyaReestrGY Розробка плати балансування та заряду для li-io акумуляторів
Розробка плати балансування та заряду для li-io акумуляторів Создание продукта для инвестиций
Создание продукта для инвестиций Компания Apple Inc
Компания Apple Inc Презентация проекта Возраст спорту не помеха
Презентация проекта Возраст спорту не помеха Решение задач В1 из открытого банка заданий ЕГЭ и ОГЭ по математике
Решение задач В1 из открытого банка заданий ЕГЭ и ОГЭ по математике Инфракрасное и ультрафиолетовое излучения
Инфракрасное и ультрафиолетовое излучения Искусственный интеллект
Искусственный интеллект Рифма и ритм. Урок литературы в 6 классе
Рифма и ритм. Урок литературы в 6 классе Кто такие насекомые
Кто такие насекомые Страдательный залог Passive Voice
Страдательный залог Passive Voice Балочная плита перекрытия, многопролетная неразрезная балка. Расчетная схема
Балочная плита перекрытия, многопролетная неразрезная балка. Расчетная схема Хирургический сепсис. Определение, диагностическая концепция и стратегия лечения
Хирургический сепсис. Определение, диагностическая концепция и стратегия лечения предметно-пространственная среда групповой комнаты
предметно-пространственная среда групповой комнаты МАС 5G. Концепции построения и развития Единой сети связи России
МАС 5G. Концепции построения и развития Единой сети связи России Типы циркуляционных агентов. Свойства буровых растворов
Типы циркуляционных агентов. Свойства буровых растворов Желудочная секреция. Фазы желудочной секреции
Желудочная секреция. Фазы желудочной секреции Определение надежности, безотказности, работоспособности, долговечности, ремонтопригодности
Определение надежности, безотказности, работоспособности, долговечности, ремонтопригодности Базовый курс пользователя ПК
Базовый курс пользователя ПК Нотариальное производство. (Лекция 3)
Нотариальное производство. (Лекция 3) Внешние факторы отказов технических систем техносферы. Лекция 2
Внешние факторы отказов технических систем техносферы. Лекция 2 картотека загадок по лексической теме Домашние птицы
картотека загадок по лексической теме Домашние птицы