Содержание
- 2. Условие задачи Известно, что в космосе могут существовать твердые тела, образованные, отчасти, благодаря водородным связям (например,
- 3. Поставленные задачи Систематизировать определение «Водородная связь»; Выяснить её влияние на физико-химические свойства вещества; Учитывая п. 2,
- 4. 1. Определение Водородной связи Водородная связь –связь, носящая частично ковалентный, частично электростатический характер, где X и
- 5. 2. Влияние на физико-химические свойства 4 А так же: Длина связи Х-Н увеличивается, вследствие частичного ковалентного
- 6. 3. Способы измерения ∆fH Калориметрия PVT-метод 5
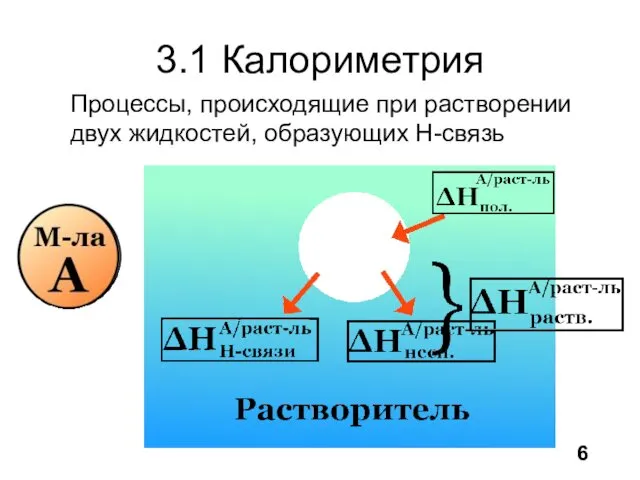
- 7. 3.1 Калориметрия 6 Процессы, происходящие при растворении двух жидкостей, образующих H-связь
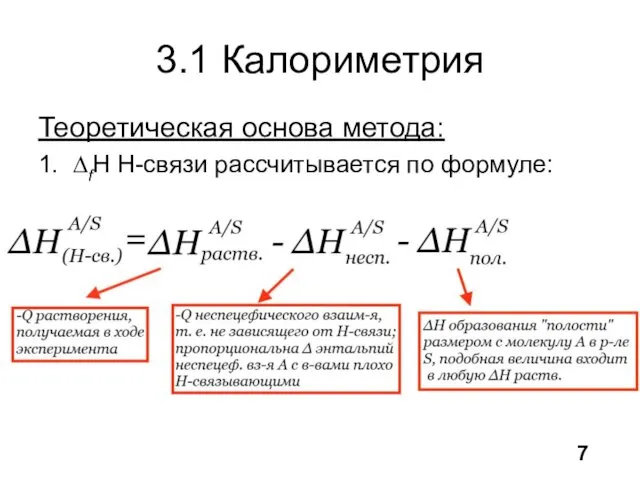
- 8. 3.1 Калориметрия Теоретическая основа метода: 1. ∆fH Н-связи рассчитывается по формуле: 7
- 9. 3.1 Калориметрия Часть ∆H (неспец. вз-я и обр. полости) – нельзя получить отдельно, но можно получить
- 10. 3.1 Калориметрия 2. ∆H образования полости и коэффециэнт пропорциональности q 9
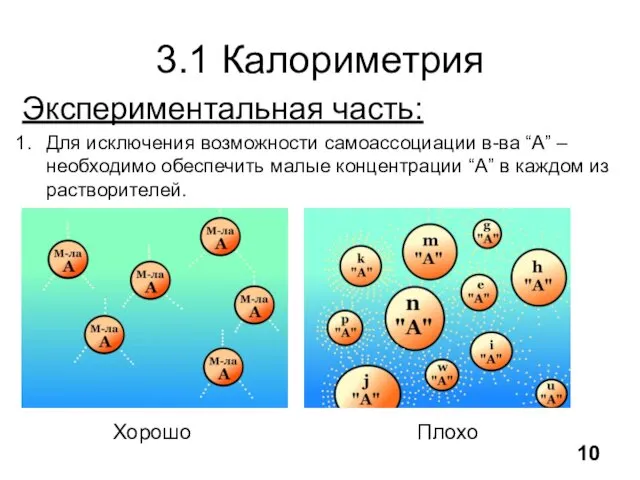
- 11. 3.1 Калориметрия Экспериментальная часть: Для исключения возможности самоассоциации в-ва “А” – необходимо обеспечить малые концентрации “А”
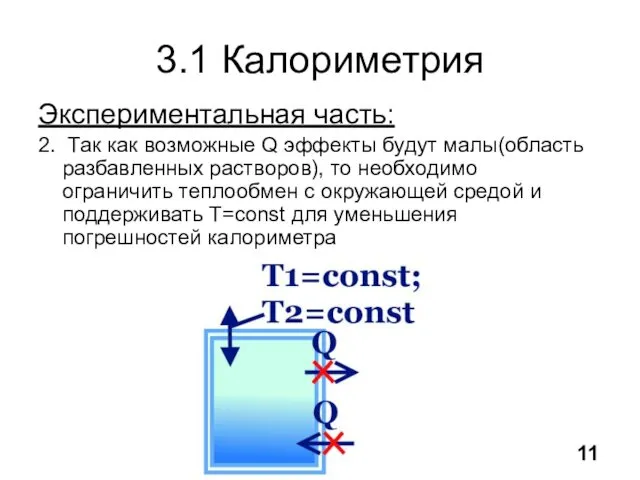
- 12. 3.1 Калориметрия Экспериментальная часть: 2. Так как возможные Q эффекты будут малы(область разбавленных растворов), то необходимо
- 13. 3.1 Калориметрия Экспериментальная часть: 3. Смешение следует проводить внутри калориметра, так как необходимо зарегистрировать максимум Q-эффектов.
- 14. 3.1 Калориметрия Таким образом можно определить ∆fH для более 300 систем в-во A – растворитель S
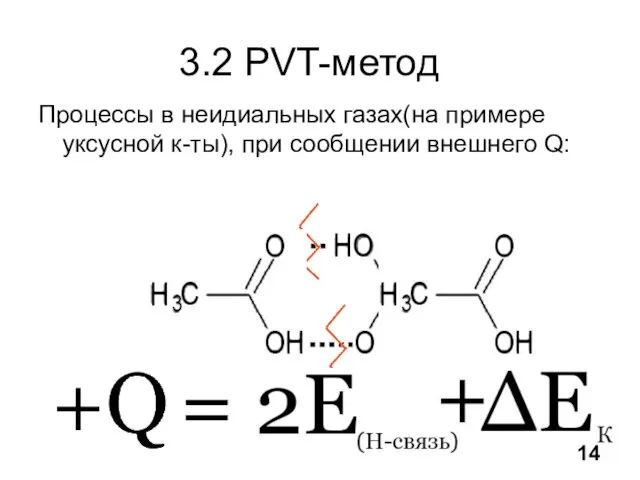
- 15. 3.2 PVT-метод Процессы в неидиальных газах(на примере уксусной к-ты), при сообщении внешнего Q: 14
- 16. 3.2 PVT-метод Теоретическая основа метода: Так как H-связь – одна из причин ассоциации молекул даже в
- 17. 3.2 PVT-метод Теоретическая основа метода: Для описания этих отклонений хорошо подходит вириальное уравнение; Для процесса димеризации
- 18. 3.2 PVT-метод Теоретическая основа метода: Второй вириальный коэффециэнт связан с константой ассоциации уравнением: С помощью видоизмененной
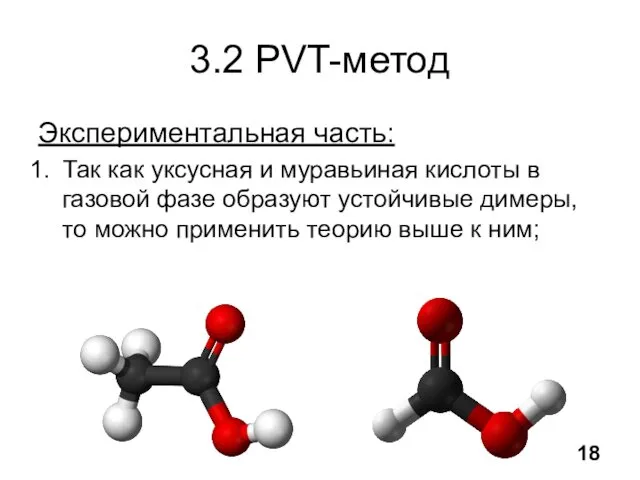
- 19. 3.2 PVT-метод Экспериментальная часть: Так как уксусная и муравьиная кислоты в газовой фазе образуют устойчивые димеры,
- 20. 3.2 PVT-метод Экспериментальная часть: 2. Пробы для эксперимента необходимо отобрать в количестве 1 моль(60 г –
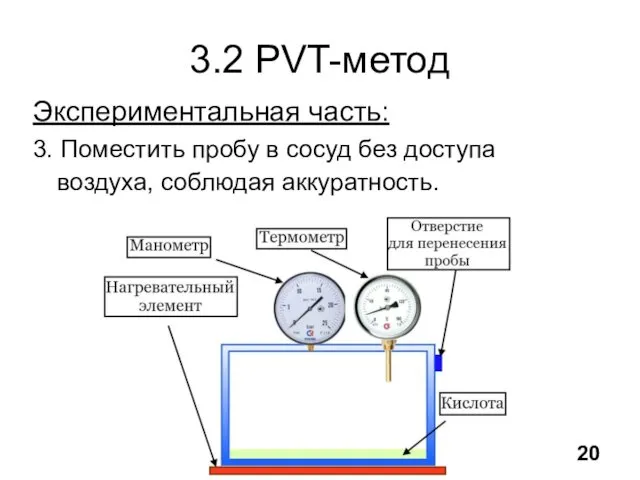
- 21. 3.2 PVT-метод Экспериментальная часть: 3. Поместить пробу в сосуд без доступа воздуха, соблюдая аккуратность. 20
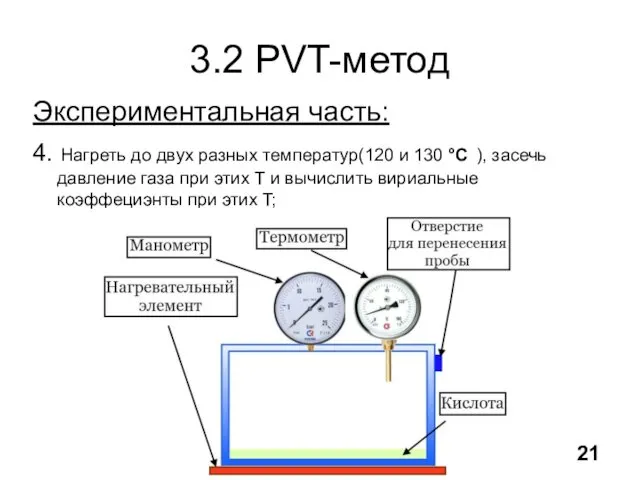
- 22. 3.2 PVT-метод Экспериментальная часть: 4. Нагреть до двух разных температур(120 и 130 °C ), засечь давление
- 23. Выводы Было обобщено понятие «Водородная связь»- связь, носящая частично ковалентный, частично электростатический характер; Было показано влияние
- 24. Список использованной литературы Н. Д. Соколов «Водородная связь», ж. «Успехи Физических Наук»(Т. 57, вып. 2, 1955);
- 25. Разбор уравнения расчета ∆fH 24
- 27. Скачать презентацию
















 Весна, паводок
Весна, паводок Женщины-космонавты России
Женщины-космонавты России Анкета. Колледж
Анкета. Колледж к 100 летию экспедиции Седого
к 100 летию экспедиции Седого Выступление на РМО по теме Агрессия в школе- презентация.
Выступление на РМО по теме Агрессия в школе- презентация. Сущность и содержание финансов предприятия
Сущность и содержание финансов предприятия Игра-тренажер по математике В школе у Мальвины для детей 4-7 лет
Игра-тренажер по математике В школе у Мальвины для детей 4-7 лет Беседа с родителями на темуСтили и методы семейного воспитания
Беседа с родителями на темуСтили и методы семейного воспитания Основы термической и химико-термической обработки металлов и сплавов. Лекция 3 материаловедение
Основы термической и химико-термической обработки металлов и сплавов. Лекция 3 материаловедение Острое повреждение почек при массивной кровопотере
Острое повреждение почек при массивной кровопотере Презентация Влияние пищевых добавок
Презентация Влияние пищевых добавок Неотложная помощь
Неотложная помощь Обязательные предварительные и периодические медицинские осмотры по приказу Минздравсоцразвития РФ
Обязательные предварительные и периодические медицинские осмотры по приказу Минздравсоцразвития РФ Патопсихологический подход к исследованию нарушений психической деятельности и личности при психических расстройствах
Патопсихологический подход к исследованию нарушений психической деятельности и личности при психических расстройствах Презентация фотоотчета о Дне Матери
Презентация фотоотчета о Дне Матери Экономическая теория. Лекция 6. Эластичность спроса и предложения
Экономическая теория. Лекция 6. Эластичность спроса и предложения Безработица. Причины безработицы
Безработица. Причины безработицы Явления, происходящие с телами
Явления, происходящие с телами Розвиток освіти і педагогічної думки в епоху українського відродження
Розвиток освіти і педагогічної думки в епоху українського відродження Методический кабинет Диск
Методический кабинет Диск Боги Древней Греции. Викторина
Боги Древней Греции. Викторина Personal letter
Personal letter Презентация к уроку технологии Город мастеров 3 класс
Презентация к уроку технологии Город мастеров 3 класс Spotlight 8. Module 2. Слова по теме еда
Spotlight 8. Module 2. Слова по теме еда Великдень або Пасха. Христове Воскресіння
Великдень або Пасха. Христове Воскресіння Источники права. Что такое источники права
Источники права. Что такое источники права позновательно-информационный проект У Копатыча в гостях
позновательно-информационный проект У Копатыча в гостях Маршрутная сеть Новокузнецкого городского округа (ПРОЕКТ)
Маршрутная сеть Новокузнецкого городского округа (ПРОЕКТ)