Особые свойства бериллия: диагональная аналогия с алюминием + невозможность ковалентности выше
4.
Особые свойства бериллия проявляются в:
склонности к образованию КС ⇒ амфотерность металла и гидроксида: Be + 2H2O + 2KOH = K2[Be(OH)4] + H2↑; Be(OH)2+2KOH = K2[Be(OH)4];
высокой стабильности оксида;
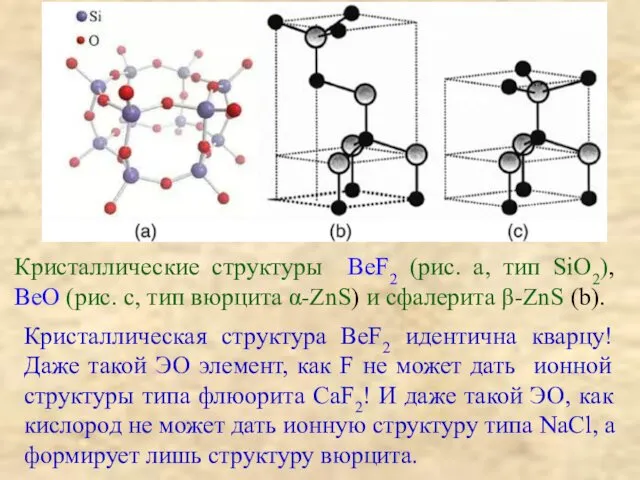
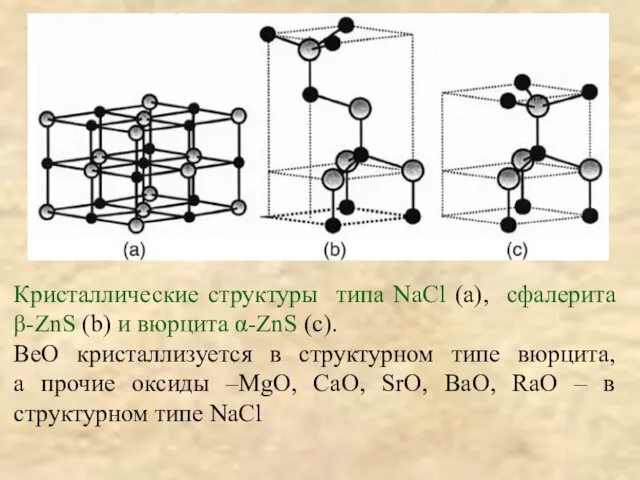
преобладающей роли ковалентной связи в бинарных cоединениях даже с самыми ЭО – элементами (BeO изоструктурен ZnS(вюрцит), BeF2 изоструктурен SiO2 (кварц)
полимеризации галогенидов в твердом состоянии;
совместном нахождении в природе с соединениями Al;
← Берилл, изумруд:
Be3Al2(SiO4)6
Цепочечная структура хлорида BeCl2
Молекулярная стр-ра AlCl3




 Классификация экстремистских организации в России
Классификация экстремистских организации в России Операторы ввода и вывода в Pascal ABC
Операторы ввода и вывода в Pascal ABC Генеральные планы промышленных предприятий. Зонирование территории и требования к расположению зданий и сооружений
Генеральные планы промышленных предприятий. Зонирование территории и требования к расположению зданий и сооружений Характеристика звуков
Характеристика звуков Организация работы холодного цеха
Организация работы холодного цеха Аттестационнаяработа. Использование метода проектов в обучение школьников французскому языку
Аттестационнаяработа. Использование метода проектов в обучение школьников французскому языку Қан тамырлар жүйесі Артериялар
Қан тамырлар жүйесі Артериялар Инновационные стеновые материалы
Инновационные стеновые материалы Оригами. Проект
Оригами. Проект Добыча,транспортировка и переработка нефти и газа. Виды продукции, получаемой из нефти и газа
Добыча,транспортировка и переработка нефти и газа. Виды продукции, получаемой из нефти и газа Бизнес-план инвестиционного проекта, его структура. (Лекция 5)
Бизнес-план инвестиционного проекта, его структура. (Лекция 5) 20230613_reshenie_zadach_s_pomoshchyu_uravneniy
20230613_reshenie_zadach_s_pomoshchyu_uravneniy Напольные покрытия. Массивная доска и пробка
Напольные покрытия. Массивная доска и пробка Российская империя на рубеже XVIII – XIX вв
Российская империя на рубеже XVIII – XIX вв Что такое функция?
Что такое функция?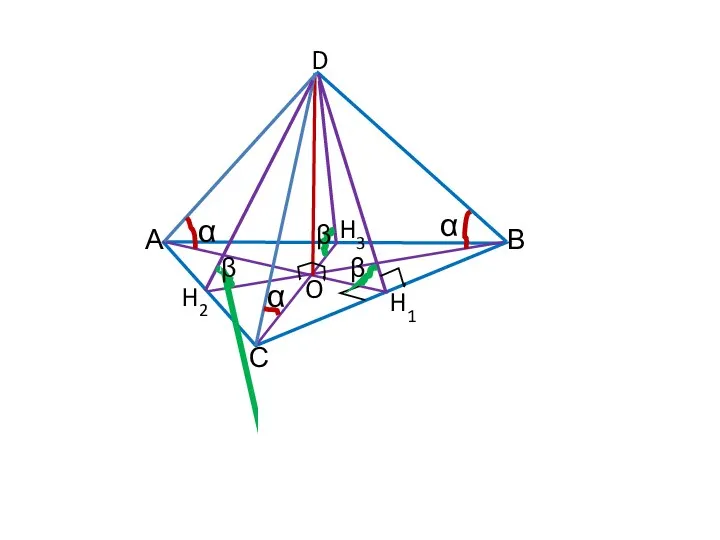 Правильная пирамида
Правильная пирамида |Презентация 23 февраля
|Презентация 23 февраля КАСКО ФЛ Продуктовая линейка Dealer (на базе правил 171.1)
КАСКО ФЛ Продуктовая линейка Dealer (на базе правил 171.1) Импрессионизм. Черты импрессионизма в живописи
Импрессионизм. Черты импрессионизма в живописи Дымковская игрушка
Дымковская игрушка Схема подключения светильника
Схема подключения светильника Republic of Rwanda: A Model of Reform-Driven, Market-Based, Sustainable Development
Republic of Rwanda: A Model of Reform-Driven, Market-Based, Sustainable Development Презентация- Матрешка для мамы
Презентация- Матрешка для мамы Летопись 1-б класса
Летопись 1-б класса Эндометриоз
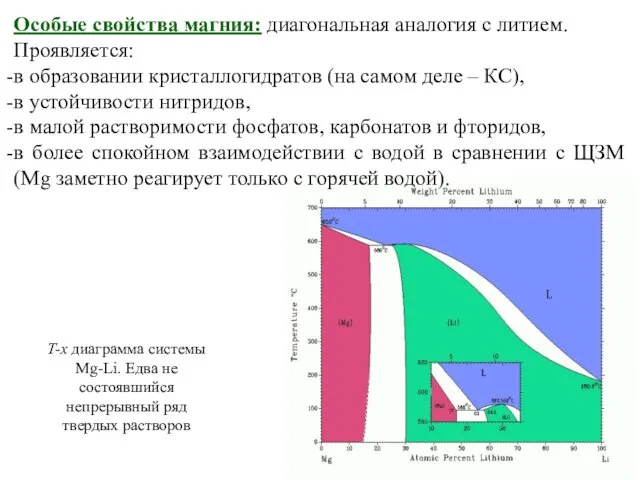
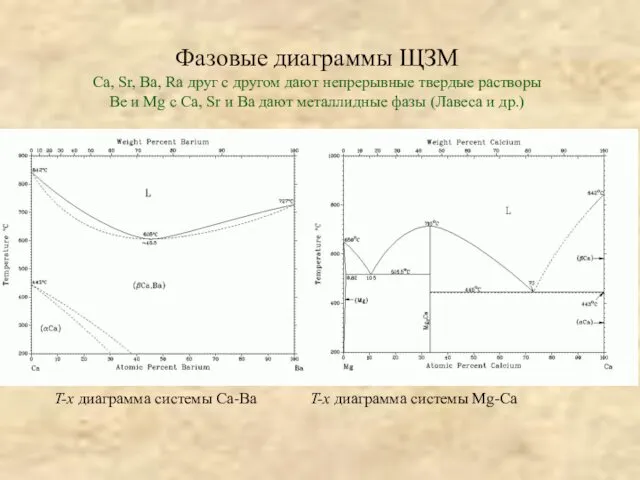
Эндометриоз Анализ диаграмм состояния двойных систем
Анализ диаграмм состояния двойных систем Учет нематериальных активов
Учет нематериальных активов Презентация по теме Южная Россия
Презентация по теме Южная Россия