Содержание
- 3. . Важной характеристикой любого раствора является его состав, который выражается концентрацией
- 5. Эквивалент- это такая реальная или условная частица вещества Х, которая в данной кислотно-основной реакции эквивалентна одному
- 6. 4.Моляльная концентрация - моляльность- количество молей растворенного вещества в 1 кг растворителя – Сm =n(в-ва)/m(кг,р-ля)
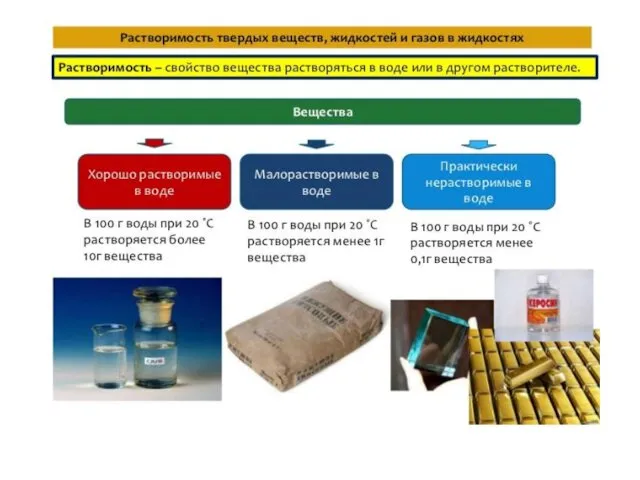
- 9. Растворимость твердых веществ, как правило, увеличивается с возрастанием температуры (кроме Са(ОН)2 ) Растворимость жидкостей также возрастает
- 10. Растворимость газов, наоборот, уменьшается с увеличением температуры, т.к. сопровождается выделением теплоты. Растворимость газов при постоянной температуре
- 11. Закон Генри-Дальтона имеет биологическое значение. Уменьшение растворимости газов в крови при понижении давления – проявление кессонной
- 12. Коллигативные ( общие) свойства растворов. К общим свойствам растворов (зависят только от концентрации , но практически
- 13. Понижение давления насыщенного пара растворителя над раствором Пар, находящийся в равновесии с жидкостью, называют насыщенным. Его
- 14. Если в жидкости растворить некоторое количество нелетучего вещества, то давление насыщенного пара понижается. Это объясняется тем,
- 15. Закон Рауля: Понижение давления насыщенного пара растворителя пропорционально мольной доле растворенного вещества. где Ро – давление
- 16. Из закона Рауля вытекает два следствия. Первое следствие: Температура кипения раствора выше температуры кипения чистого растворителя.
- 17. Второе следствие: Температура замерзания раствора ниже, чем температура замерзания чистого растворителя. Ккр.- криоскопическая постоянная растворителя. Коэффициент
- 18. Численные значения криоскопических и эбуллиоскопических постоянных растворителей приведены в справочниках. С помощью закона Рауля и следствий
- 20. Из математического выражения закона Вант-Гоффа следует, что растворы различных веществ, имеющую одинаковую молярную концентрацию, производят при
- 21. Осмос имеет большое значение в биологических системах. Он обусловливает поступление воды в клетки и межклеточные структуры.
- 22. Кровь, лимфа, а также любые тканевые жидкости человека и животных представляют собой водные растворы молекул и
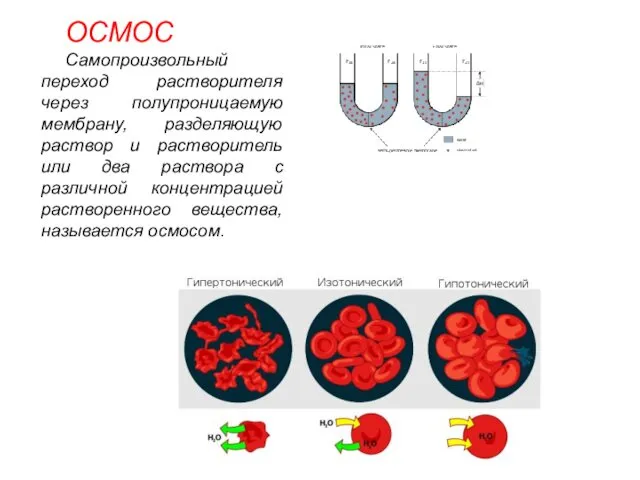
- 23. Если два раствора имеют различное осмотическое давление, то раствор с большим осмотическим давлением является гипертоническим по
- 24. При помещении клеток в изотонический раствор клетки сохраняют свой размер и нормально функционируют. При помещении клеток
- 25. ОСМОС Самопроизвольный переход растворителя через полупроницаемую мембрану, разделяющую раствор и растворитель или два раствора с различной
- 26. При помещении клеток в гипертонический раствор, вода из клеток уходит в более концентрированный раствор и наблюдается
- 27. Такое разрушение клеток называется лизисом. В случае эритроцитов этот процесс называют гемолизом. При внутривенном введении больному
- 28. Рассол и сироп являются гипертоническими растворами, используемыми при консервировании продуктов для плазмолиза микроорганизмов. Биологические жидкости человека
- 29. Для учета осмотических свойств сложных многокомпонентных систем, как плазма крови, было введено понятие осмомолярной (осмомолярность) или
- 31. Скачать презентацию


























 Презентация Ромова Л.Н.
Презентация Ромова Л.Н. Параметры цифровых сигналов и схем
Параметры цифровых сигналов и схем Глава 3. Обзор стандарта ISO 9001:2000
Глава 3. Обзор стандарта ISO 9001:2000 Гормональные препараты
Гормональные препараты День Победы. Работы детей
День Победы. Работы детей Техника люмбальной пункции
Техника люмбальной пункции Разработка базы данных аэропорта Полёт
Разработка базы данных аэропорта Полёт Smart leans case. Смарт-чехол для объектива
Smart leans case. Смарт-чехол для объектива Методические рекомендации к комплексу мероприятий по изучению творчества С. В. Михалкова в ДОУ, посвященного 100-летию со дня рождения писателя Дядя Степа в гостях у малышей
Методические рекомендации к комплексу мероприятий по изучению творчества С. В. Михалкова в ДОУ, посвященного 100-летию со дня рождения писателя Дядя Степа в гостях у малышей Ритмопластика для дітей
Ритмопластика для дітей электронно дидактическая игра Безопасность дома и на улице
электронно дидактическая игра Безопасность дома и на улице Понятие и роль справочных правовых систем. (Тема 2)
Понятие и роль справочных правовых систем. (Тема 2) Урал. Географическое положение. История
Урал. Географическое положение. История Первый признак параллелограмма (приложения к уроку). 8 класс
Первый признак параллелограмма (приложения к уроку). 8 класс Стратегический менеджмент. Роль менеджера в формировании стратегии организации
Стратегический менеджмент. Роль менеджера в формировании стратегии организации овышение переваривания кормов сельскохозяйственными животными за счет активации и защищенности нормофлоры ЖКТ
овышение переваривания кормов сельскохозяйственными животными за счет активации и защищенности нормофлоры ЖКТ Великобритания во второй половине XX века
Великобритания во второй половине XX века Развиваем красивую и правильную речь детей вместе
Развиваем красивую и правильную речь детей вместе Кассетный способ производства ЖБИ
Кассетный способ производства ЖБИ Продолжение портфолио Новый год 2015 г.
Продолжение портфолио Новый год 2015 г. Игровое пособие Ковровый городок
Игровое пособие Ковровый городок Родительское собрание Учим детей мыслить
Родительское собрание Учим детей мыслить Управление персоналом в коммуникационных компаниях
Управление персоналом в коммуникационных компаниях Презентация.Мой класс и моя школа
Презентация.Мой класс и моя школа Солнечная система. Планеты
Солнечная система. Планеты Использование энергии солнца на Земле
Использование энергии солнца на Земле Отношение христианина к природе
Отношение христианина к природе Рефлексотерапия/ Иглорефлексотерапия
Рефлексотерапия/ Иглорефлексотерапия