Слайд 2

Жоспар:
Кіріспе
Негізгі бөлім:
1.Электролиттердің жіктелуі
2.Диссоциация туралы жалпы түсінік
3.Қышқылдар мен негіздердің Аррениус және
Льюис бойынша ілімі.
4.Қышқылдар мен негіздердің протолиттік ілімі.
Қорытынды
Пайдаланылған әдебиеттер
Слайд 3

Кіріспе
Қышқылдар мен негіздердің теориясын С.Аррениус өткен ғасырдың соңында ұсынған
болатын.Ол электролиттік диссоциация, бірақ бұл электролиттік диссоциация ілімі органикалық қосылыстардың аминдердің,амидтердің тағы басқа қышқылдық-негіздік қасиеттерін түсіндіре алмады.Бұл теорияны 1923 жылы Бренстед және ағылшын химигі Лоури қышқылдар мен негіздердің протолиттік ілімін ұсынды.Протолиттік ілім бойынша,қышқылдар дегеніміз иондану нәтижесінде протондар түзетін,ал негіздер протонды қосып алатын қосылыстар.Протолиттік теория ілеспелі қышқылдар мен негіздер деген ұғымды енгізді.Қышқылдық-негідік әрекеттесудің барлық реакцияларында,қышқылдан негізге протондар қайтымды тасымалданады тұрады,олар жаңа бөлшектер жұбын түзеді,олардың біреуі қайтадан протон беруге екіншісі оны қабылдап алуға бейім.Протондардың ауысуымен сипатталатын реакцияларды протолиттік реакциялар деп,ал түзілетін тепе-теңдікті протолиттік тепе-теңдік деп атайды.Протолиттік ілімде еріткіштің протолизі маңызды орын алады.Сулы емес еріткіштер де су сияқты сольваттанған протонға және анионға протолизденеді.
Слайд 4

Электролиттердің жіктелуі
Көптеген химиялық реакциялар ерітінділер арасында жүреді. Ерітінділерді электролиттер деп те
атайды. Электролиттер деп еріткіш молекулаларының әсерінен иондарға ыдырап, ерітінділері не балқымалары электр тогын өткізетін заттарды айтады.
Слайд 5
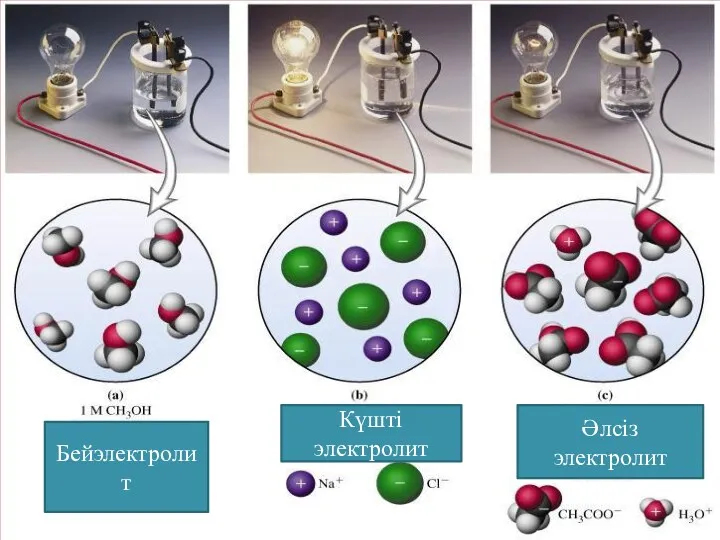
Бейэлектролит
Күшті электролит
Әлсіз электролит
Слайд 6

Электролиттердің ерекшеліктері:
1.Ерітінділері электр
тогын жаксы өткізеді.
2.Электролиттердің
концентрациясы бірдей
ерітінділер
буының
қысымы төмен, қайнау
температурасы жоғары,
қату температурасы
төмен.
3.Электролит
ерітінділерінің осмос
қысымы жоғары.
Слайд 7
Слайд 8

Диссоциация туралы жалпы түсінік
Электр тоғын өткізетін заттар электролиттер, ал өткізбейтін
заттар
бейэлектролиттер болады. Электролит ерітінділеріндегі
кездесетін ауытқуларды швед химигі С. Аррениус ұсынған
электорлиттік диссосация теориясы түсіндірді. Бұл теорияның
негізі мынада:
1.Электролиттік диссоциация-электролиттердің суда ерігенде оң және теріс зарядталған иондарға ыдырауы.
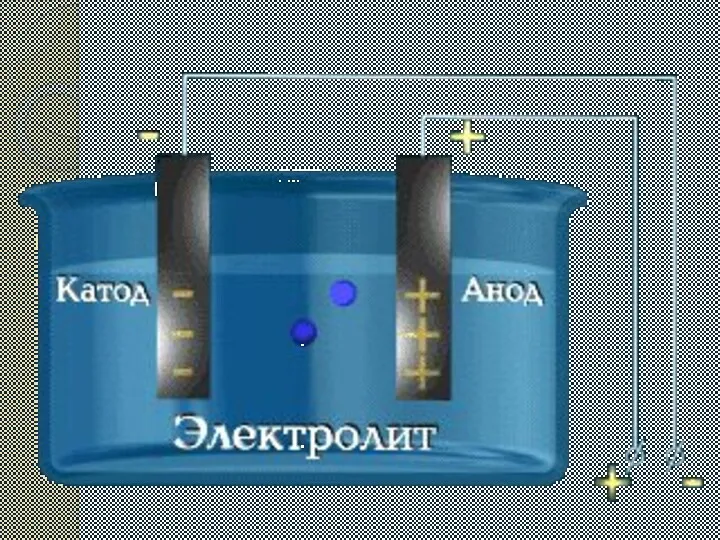
2.Электр тоғының әсерінен теріс полюсқа оң зарядталған иондар жылжиды(катиондар), ал оң полюсқа теріс зарядталған иондар жылжиды(аниондар).
3.Диссоциация – қайтымды процесс. Молекулалардың иондарға ыдырау процесімен қатар иондардың молекулалар процесі жүреді.(ассоциация). Диссоциация теңдеуін құрғанда тепе-теңдік белгісін қояды (=). Мысалы КА затының диссоциациясын былай жазуға болады:
КА =К++А-
Слайд 9

Электролиттік диссоциация теориясы
Электролиттердің еру немесе балқу процессі электр тогын
өткізе алатын зарядталған бөлшектер түзе жүретін процесс. Электролиттік диссоциация ерітіндідегі электролиттер полярлы еріткіштердің әсерінен иондарға ыдырауы. Иондар атомдардан ерекшеленеді.Ерітіндіде иондар ретсіз қозғалады. Тұрақты электр тогы әсерінен электролит ерітіндісіндегі иондар бағытталып қозғалады: катиондар катодқа, аниондар анодқа тартылады.
С. А. Аррениус (1859- 1927)
Слайд 10

Электролиттік диссоциация дәрежесі (α) иондарға ыдыраған молекулалардың электролит молекулаларының жалпы санының
қатынасына тең шама. Мұнда n – иондарға ыдыраған молекулалардың саны. N0 -жалпы молекулалардың саны.
Күшті электролиттерге α › 0,3 (немесе 30%) жоғары, ал әлсіз электролиттер үшін α ≤ 0,03(немесе 3%), орташа электролиттер олардың диссоциациялану дəрежелері 3% пен 30%аралығында болады. Электролиттік диссоциациялану дәрежесі концентрацияға тәуелді, концентрация төмендеген сайын α жоғарлайды.
Слайд 11

Оствальдың сұйылту заңы
Электролиттік диссоциация дәрежесі мен диссоциация
тұрақтысының өзара байланысы сандық
түрде
Оствальдтың сұйылту заңы деп аталатын теңдеуімен
беріледі:
K = α2 C/ 1- α
Әлсіз электролиттер үшін α шамасын ескермеуге болады,
онда 1-α =1 деп алса, теңдеу мына түрде жазылады:
КД ═ α2 ∙ С
Вильгельм Оствальд
Слайд 12

Электролиттік диссоциация константасы
Әлсіз электролиттің иондарға ыдырау қабілеттілігін көрсетеді.
Слайд 13

Әлсіз электролиттердің диссоциациясы қайтымды процесс болғандықтан әрекеттесуші массалар заңына бағынады:
К=[H+][CH3COO-]/[CH3COOH];
К - диссоциациялану константасы.
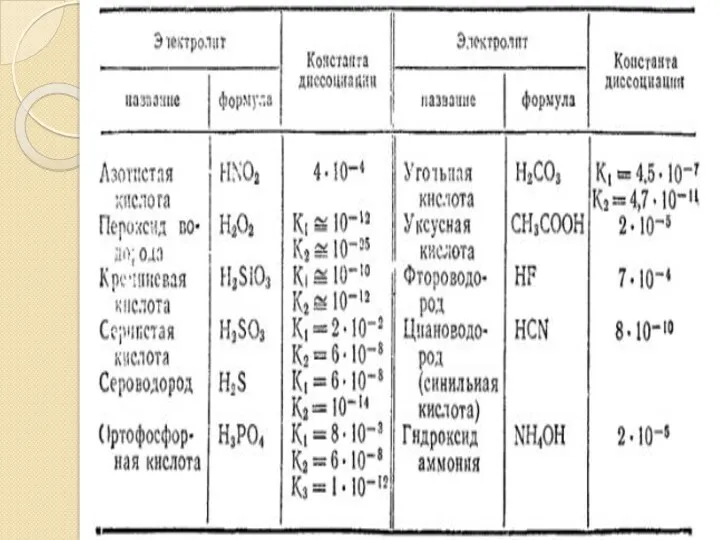
Көп қышқылды негіздер мен көп негізді қышқылдар біртіндеп (сатылап) иондарға ыдырайды және сатының әрқайсысына тиісті мәні бар диссоциациялану константасы сәйкес келеді.
H2CO3 ⇔ H+ + HCO-3 К1 =4,5⋅10-7
HCO-3 ⇔ H+ + CO32- К2=4,7⋅10-11
Слайд 14
Слайд 15

Қышқылдар мен негіздердің Аррениус және Льюис бойынша ілімі.
Льюс анықтамасы
бойынша қышқыл болатын қосылыстар өзіне электрон жұбын қосып алуға қабілетті, ал негіздер – электрон жұбын беруші қосылыстар.Мұндай әрекеттесудің нәтижесінде коваленттік байланыс түзіледі.
Слайд 16

Льюис теориясы бойынша қышқылдар дегеніміз жұп электрон қосып алып коваленттік байланыс
түзетін қосылыс(акцептор), негіздер осы коваленттік байланыс түзу үшін жұп электрондарын бере алатын қосылыстар(донор).
Слайд 17

Қышқылдар мен негіздердің протолиттік ілімі
1923 жылы Бренстед және ағылшын химигі
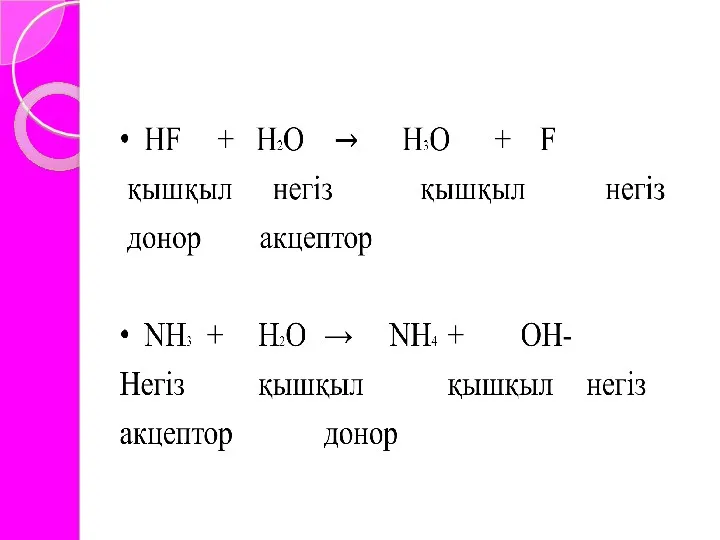
Лоури қышқылдар мен негіздердің протолиттік ілімін ұсынды. Протолиттік ілім бойынша, қышқылдар дегеніміз- иондану нәтижесінде протондар түзетін, ал негіздер дегеніміз протонды қосып алатын қосылыстар
Слайд 18
Слайд 19

Бренстед және Лоури (1923 ж.) ұсынған протолиттiк теория. Бұл теория
бойынша протонды беретiн заттар қышқылдар, ал протонды қосып алатын заттар негiздер деп аталады. Протонның доноры мен соған сәйкес келетiн протонның акцепторы қабысқан қышқылды–негiздiк жұп түзедi.
Протолиттiк теориядан мынадай қорытындылар жасалады :
1.Қышқыл мен негiздiң ролiн иондар мен бейтарап молекулалар атқаруы мүмкiн.
2.Бiр зат белгiлi бiр жағдайларға байланысты қышқыл немесе негiз бола алады.
3.Қышқыл мен негiздiң әрекеттесуi нәтижесiнде жаңа қышқыл мен негiз түзiледi.
Слайд 20

Қорытынды
Тірі ағзаларда протолиттік процестер заттар алмасуында, қанның қышқылдығын сақтауда маңызды
қызмет атқарады. Сутектік көрсеткіш биохимиялық зерттеулерде, клиникалық және фармакологиялық жұмыстарда әртүрлі физиологиялық ерітінділер мен дәрілік препараттардың қышқылдық-негіздік қасиеттерін білу үшін қолданылады.



















 Образование Союза Советских Социалистических Республик
Образование Союза Советских Социалистических Республик Светлое Будущее
Светлое Будущее презентация История робототехники
презентация История робототехники Электромагнитные расходомеры Питерфлоу РС для учета холодной воды
Электромагнитные расходомеры Питерфлоу РС для учета холодной воды Мошенничество в сети Интернет
Мошенничество в сети Интернет Метеостанція на базі модуля ESP32 та Arduino Micro Pro з бездротовим зв'язком та підтримкою ОС Windows та Android
Метеостанція на базі модуля ESP32 та Arduino Micro Pro з бездротовим зв'язком та підтримкою ОС Windows та Android Анализ финансового состояния компании ООО ИНМЕТ и разработка рекомендаций по его улучшению
Анализ финансового состояния компании ООО ИНМЕТ и разработка рекомендаций по его улучшению Аттестация по новой форме
Аттестация по новой форме Дифференциация Ж - Ш
Дифференциация Ж - Ш Аминокислоты и белки
Аминокислоты и белки презентация Оригами. Рыбка.
презентация Оригами. Рыбка. Шиитская ветвь ислама. Мировые религии: история и современность
Шиитская ветвь ислама. Мировые религии: история и современность prava_i_obyazannosti_uchashchihsya_shkoly
prava_i_obyazannosti_uchashchihsya_shkoly Оптовая торговля в электронной коммерции
Оптовая торговля в электронной коммерции Операционные усилители
Операционные усилители Паркинг – место для стоянки автотранспорта
Паркинг – место для стоянки автотранспорта Презентация к педсовету О внедрении ФГОС в 1 классе
Презентация к педсовету О внедрении ФГОС в 1 классе Чёрная курица, или подземные жители
Чёрная курица, или подземные жители Первые весенние цветы - первоцветы
Первые весенние цветы - первоцветы Разработка документации СМК
Разработка документации СМК Классификация зданий по назначению
Классификация зданий по назначению Информационные системы в экономике
Информационные системы в экономике Вторая мировая война 1939 -1945 гг
Вторая мировая война 1939 -1945 гг Прогноз курса доллара
Прогноз курса доллара ОГЭ задание 3. Изобразительно-выразительные средства языка
ОГЭ задание 3. Изобразительно-выразительные средства языка Органические вяжущие вещества и материалы на их основе. Лекция 15
Органические вяжущие вещества и материалы на их основе. Лекция 15 Н.А. Некрасов Железная дорога. Р.И. Фраерман Дикая собака Динго, или Повесть о первой любви
Н.А. Некрасов Железная дорога. Р.И. Фраерман Дикая собака Динго, или Повесть о первой любви Программы для работы с интернетом
Программы для работы с интернетом