Содержание
- 2. Историческая информация о железе
- 3. Метеоритное железо
- 4. Плавка железа в Древнем Египте (воздух подаётся мехами, сшитыми из шкур животных)
- 5. Глиняные печи - горны
- 6. Ковка железа
- 7. Биологическая роль железа Железо играет важную роль в жизнедеятельности живых организмов. Оно входит в состав гемоглобина
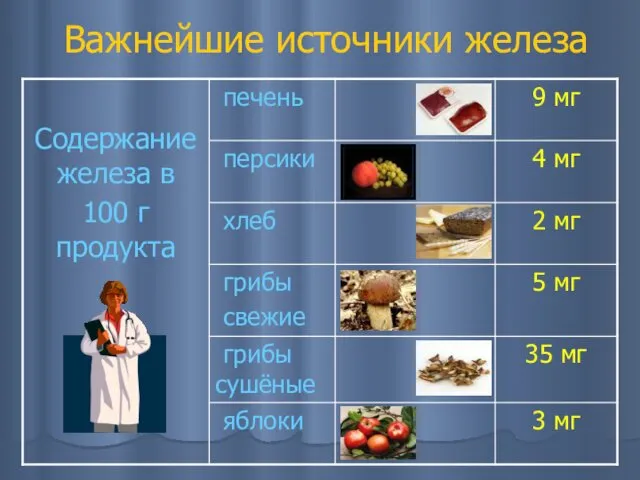
- 8. Важнейшие источники железа
- 9. «ТРЕТИЙ ЛИШНИЙ» Решите анаграммы и исключите лишнее: 1. леруогд 2. иксолодр 3. ддрооов 4. золеже
- 10. Правильный ответ 1. углерод 2. кислород 3. водород 4. железо
- 11. Визитка химического элемента
- 12. Характеристика элемента 4-период, 4ряд, 8-группа, побочная подгруппа, порядковый номер 26 26 электронов, 26 протонов, относительная атомная
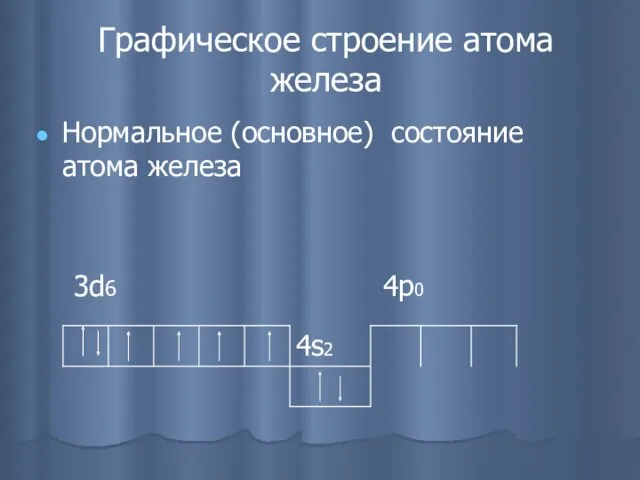
- 13. Графическое строение атома железа Нормальное (основное) состояние атома железа 3d6 4p0
- 14. Задание Используя текст учебника, дайте характеристику физических свойств железа: 1. Цвет 2. Блеск 3. Пластичность 4.
- 15. Физические свойства Железо - сравнительно мягкий, ковкий, серебристо-серый металл. Температура плавления – 1535 0С Температура кипения
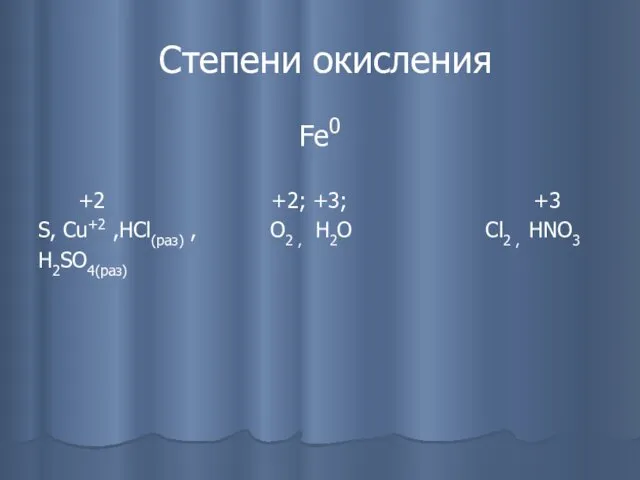
- 16. Степени окисления Fe0 +2 +2; +3; +3 S, Cu+2 ,HCl(раз) , O2 , H2O Cl2 ,
- 17. Химические свойства а) Взаимодействие с простыми веществами +3 -2 +2 -2 1. 3Fe+2O2 = Fe2O3 *
- 18. б) Взаимодействие со сложными веществами с разбавленными кислотами: 0 +1 -1 +2 -1 0 Fe +
- 19. с концентрированной кислотой реагирует при нагревании, без нагревания кислоты пассивируют железо: 0 +6 t +3 +4
- 20. c cолями (в водном растворе) 0 +2 +2 0 Fe + CuSO4=FeSO4+Cu
- 21. c парами воды 0 +1 +3 +2 0 3Fe + 4H2O =Fe2O3 FeO + 4H2
- 22. Внимание! Обратите внимание, что во всех реакциях идущих при нагревании железо окисляется до +3
- 23. «ЛОВИ ОШИБКУ» Задание: какие реакции соответствуют схеме +2 +3 Fe Fe, что неправильно записано в уравнениях?
- 24. Нахождение в природе. Халькопирит с включениями кварца Приморский край Пирит
- 25. Нахождение в природе. Fe Магнитный железняк магнетит Fe3O4 Красный железняк гематит Fe2O3 Бурый железняк Лимонит 2
- 26. «КОНСТРУИРОВАНИЕ ТЕКСТА» Задание: Из предложенных формул соединений составьте генетический ряд Fe+2 (для первого варианта) и генетический
- 27. Качественные реакции на ион 2+ Fe: + 2 +2 1. Fe Cl2+2 NaOH=Fe(OH)2 +2NaCl осадок зеленоватого
- 28. Реакция с красной кровяной солью 2. 3 Fe SO4 +2K3[Fe(CN)6]=Fe3[Fe(CN)6 ]2 +3K2 SO4 красная синий осадок
- 29. Качественные реакции на ион 3+ Fe: +3 +3 1. FeCl3+3NaOH= Fe(OH)3+3NaCl осадок бурого цвета
- 30. Реакция с жёлтой кровяной солью +3 + 1 +3 2. 4FeCl3 + 3K4[Fe(CN)6]=Fe4[Fe(CN)6]3 +12KCl желтая синий
- 31. Реакция с роданидом калия +3 - 1 + 1 - 1 + 2 -1 3. FeCl3
- 33. Скачать презентацию























![Реакция с красной кровяной солью 2. 3 Fe SO4 +2K3[Fe(CN)6]=Fe3[Fe(CN)6](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/42355/slide-27.jpg)



 Малярия:классификация, клиника, диагностика, лечение
Малярия:классификация, клиника, диагностика, лечение Поступление сырья по предприятиям от сельскохозяйственных предприятий и населения за январь-сентябрь 2020 г
Поступление сырья по предприятиям от сельскохозяйственных предприятий и населения за январь-сентябрь 2020 г Цифровая трансформация строительных организаций
Цифровая трансформация строительных организаций Биогеографические доказательства эволюции
Биогеографические доказательства эволюции Типология государств современного мира
Типология государств современного мира Внутренняя политика Павла I
Внутренняя политика Павла I Тренажор Базарного
Тренажор Базарного Методы увеличения углеводородоотдачи
Методы увеличения углеводородоотдачи Первоначальные химические понятия. Химические диктанты.
Первоначальные химические понятия. Химические диктанты. Презентация США
Презентация США актуальные проблемы в условиях введения ФГОС
актуальные проблемы в условиях введения ФГОС Учебно-методическое пособие - презентация Использование метода мнемотехники в развитии мышления и связной речи детей дошкольного возраста.
Учебно-методическое пособие - презентация Использование метода мнемотехники в развитии мышления и связной речи детей дошкольного возраста. Қостанай облысындағы. Бидай өндірісі
Қостанай облысындағы. Бидай өндірісі Дислексия или нарушения чтения. Способы профилактики и коррекции
Дислексия или нарушения чтения. Способы профилактики и коррекции Процессы с участием нуклеиновых кислот
Процессы с участием нуклеиновых кислот Воспитание у учащихся уважения к здоровью как величайшей ценности.
Воспитание у учащихся уважения к здоровью как величайшей ценности. Чернильные пятна. О проективном методе Роршаха
Чернильные пятна. О проективном методе Роршаха Преимущества и недостатки
Преимущества и недостатки ПРЕЗЕНТАЦИЯ к родительскому собранию Семейное воспитание
ПРЕЗЕНТАЦИЯ к родительскому собранию Семейное воспитание Мама... как много в этом слове
Мама... как много в этом слове Недостаточность кровообращения
Недостаточность кровообращения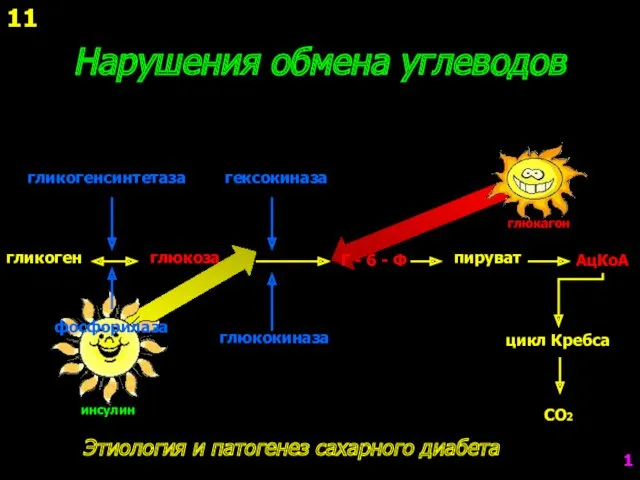 Нарушения обмена углеводов
Нарушения обмена углеводов Линзы. Построение изображений в линзах
Линзы. Построение изображений в линзах Ленинградская область в Российской Федерации
Ленинградская область в Российской Федерации Что англичане считают началом своих свобод
Что англичане считают началом своих свобод Мое портфолио
Мое портфолио Вклад химиков в Великую Победу
Вклад химиков в Великую Победу Праздник Прощание с начальной школой
Праздник Прощание с начальной школой