Содержание
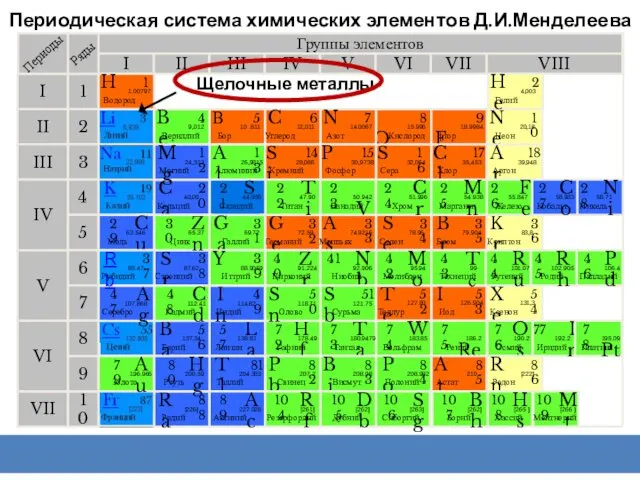
- 2. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
- 3. Группы элементов I III II VIII IV V VI VII II I III VII VI V
- 4. * Fr K Na Li Изменение свойств группе Увеличиваются восстановительные свойства (способность отдавать электроны) Уменьшается прочность
- 5. СТРОЕНИЕ АТОМОВ ЩЕЛОЧНЫХ МЕТАЛЛОВ Строение внешнего энергетического уровня ns1 степень окисления +1.
- 6. ОТКРЫТИЕ ЩЕЛОЧНЫХ МЕТАЛЛОВ Литий был открыт шведским химиком Й. Арфведсоном в 1817 г. И назван литием
- 7. ОТКРЫТИЕ ЩЕЛОЧНЫХ МЕТАЛЛОВ Натрий и калий были впервые получены английским химиком и физиком Г. Дэви в
- 8. * Эти металлы получили название щелочных, потому что большинство их соединений растворимы в воде. По-славянски «выщелачивать»
- 9. Физические свойства Все металлы этой подгруппы имеют серебристо-белый цвет (кроме серебристо-жёлтого цезия). калий рубидий литий натрий
- 10. Франций радиоактивный щелочной металл В природе не существует в таких количествах, которые достаточны для изучения его
- 11. Физические свойства Литий, натрий и калий легче воды и плавают на её поверхности, реагируя с ней.
- 12. Они очень мягкие, их можно резать ножом, скальпелем. Физические свойства
- 13. ХИМИЧЕСКИЕ СВОЙСТВА Из-за высокой химической активности щелочных металлов по отношению к воде, кислороду, и иногда даже
- 14. Нахождение в природе Как очень активные металлы, они встречаются в природе только в виде соединений. Натрий
- 15. Сподуменн LiAl[Si2O6]
- 16. Галит NaСl
- 17. Природные соединения калия Сильвин КСl
- 18. Лепидолит- один из основных источников редких щелочных металлов, рубидия и цезия
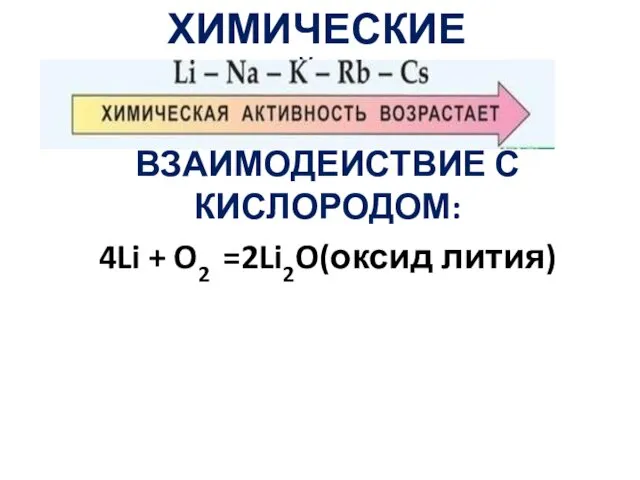
- 19. ХИМИЧЕСКИЕ СВОЙСТВА ВЗАИМОДЕЙСТВИЕ С КИСЛОРОДОМ: 4Li + O2 =2Li2O(оксид лития)
- 20. ВЗАИМОДЕЙСТВИЕ С КИСЛОРОДОМ: Щелочной металл на воздухе легко окисляется до оксида натрия. 2Na + O2 =
- 21. ХИМИЧЕСКИЕ СВОЙСТВА Реакции с неметаллами : 2Li + Cl2 = 2LiCl(галогениды) 2Na + S = Na2S(сульфиды)
- 22. Взаимодействие с водой Li - спокойно, Na - энергично, остальные – со взрывом – воспламеняется выделяющийся
- 23. С кислотами: https://www.youtube.com/watch?v=Td6itaNfJrU&t=3s 2Na+ Н2SО4 = Na2SО4 + Н2 (протекают очень бурно)
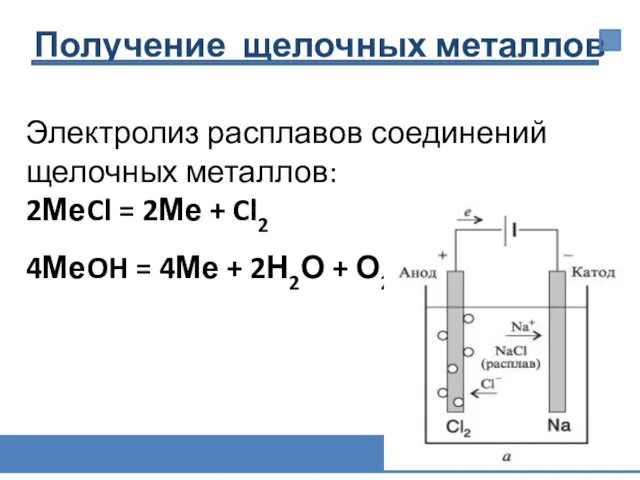
- 24. Электролиз расплавов соединений щелочных металлов: 2МеCl = 2Ме + Cl2 4МеOH = 4Ме + 2Н2О +
- 25. * Окраска пламени ионами щелочных металлов Li+ карминово- красный K+ Na+ желтый Cs+ фиолетовый Качественная реакция
- 26. Оксид натрия Хранить оксид натрия Na2O лучше всего в безводном бензоле.
- 27. Пероксид натрия Na2O2
- 28. ПОЛУЧЕНИЕ ОКСИДОВ Чистый оксид натрия получить непосредственным окислением натрия нельзя, так как образуется смесь, состоящая из
- 29. 1) Для получения оксидов натрия и калия нагревают смеси гидроксида, пероксида или надпероксида с избытком металла
- 30. Общая формула – МеОН Белые кристаллические вещества, гигроскопичны, хорошо растворимы в воде (с выделением тепла). Растворы
- 31. Едкий натр (гидроксид натрия) NaOH
- 32. Едкое кали (гидроксид калия) КOH
- 33. Схема образования гидроксида натрия: Н ОН Na гидроксид натрия
- 34. Фенолфталеин - малиновый
- 35. Они участвуют во всех реакциях, характерных для оснований — реагируют с кислотами, кислотными и амфотерными оксидами,
- 36. Химические свойства 1.С кислотами Основание + кислота = Соль + вода NaOH + HCl = NaCl
- 37. 2. С кислотными оксидами Щёлочь + кислотный оксид = соль + вода (р-ция обмена) Ca(OH)2 +
- 38. 3. С амфотерными гидроксидами: 2 NaOH + Zn(ОН)2 → Na2[Zn(OH)4] Тетрагидроксоцинкат натрия
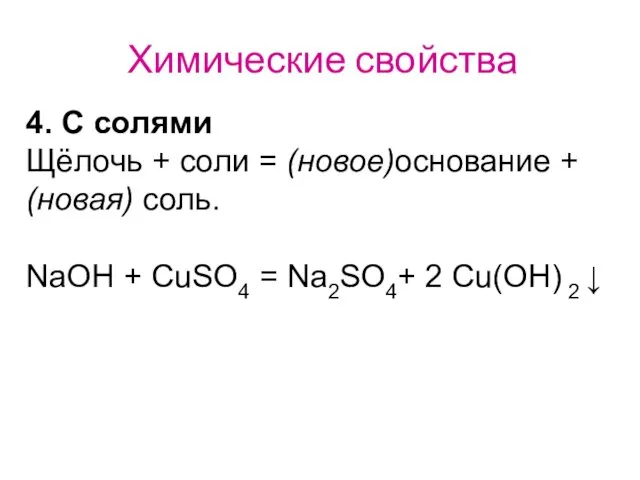
- 39. Химические свойства 4. С солями Щёлочь + соли = (новое)основание + (новая) соль. NaOH + CuSO4
- 40. Соли натрия Na2CO310H2O – кристаллическая сода используется в стекольном производстве, мыловарении, в производстве стиральных и чистящих
- 41. Цезий - самый активный металл на Земле! https://www.youtube.com/watch?v=1gh5JJDvdiQ
- 42. Значение и роль калия в организме Натриий и калий отвечают за нормальный водный баланс в организме.
- 43. источники натрия Натрий содержится в капусте брокколи, цветной капусте, картофеле, фасоли, винограде, арбузе.
- 44. источники калия Калий содержится в продуктах растительного происхождения: фруктах, овощах, картофеле, бобовых и злаковых культурах.
- 45. Мыла – это натриевые или калиевые соли высших жирных кислот, гидролизующихся в водном растворе с образованием
- 46. Рубидий Играет немалую роль в организме и оказывает такое влияние: оказывает антигистаминное воздействие (борется с воздействием
- 47. ПОВТОРИМ: Наиболее выраженные металлические свойства проявляет: ? алюминий ? натрий ? магний ? бериллий ? железо
- 48. Калий взаимодействует с водой с образованием.... и .... ? соли ? водорода ? щелочи ? оксида
- 50. Скачать презентацию












![Сподуменн LiAl[Si2O6]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/42354/slide-14.jpg)




















![3. С амфотерными гидроксидами: 2 NaOH + Zn(ОН)2 → Na2[Zn(OH)4] Тетрагидроксоцинкат натрия](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/42354/slide-37.jpg)









 Жизнь в морях и океанах
Жизнь в морях и океанах Уголовное право. Раздел второй
Уголовное право. Раздел второй Электрические нагрузки. (Лекция 6)
Электрические нагрузки. (Лекция 6) Дидактическая урок-игра по химии Неметаллы IV-VIгрупп 9 класс
Дидактическая урок-игра по химии Неметаллы IV-VIгрупп 9 класс Исследовательская работа на тему: М.В.Ломоносов. Исследования в области географии и метеорологии
Исследовательская работа на тему: М.В.Ломоносов. Исследования в области географии и метеорологии С 8 Марта
С 8 Марта список
список Механика грунтов. Практические занятия
Механика грунтов. Практические занятия Технологія виробництва м'яса нутрії
Технологія виробництва м'яса нутрії Конкуренция и рыночные структуры. (Тема 8)
Конкуренция и рыночные структуры. (Тема 8) Современные проблемы инструментального обеспечения машиностроительного производства. Лекция № 1
Современные проблемы инструментального обеспечения машиностроительного производства. Лекция № 1 Высказывания и высказывательные формы
Высказывания и высказывательные формы Товароведная характеристика мандаринов
Товароведная характеристика мандаринов Установка по призводству битумной эмульсии
Установка по призводству битумной эмульсии Обмен нуклеиновых кислот
Обмен нуклеиновых кислот Бессмертный полк: из семейного архива
Бессмертный полк: из семейного архива Аппаратное обеспечение ПК
Аппаратное обеспечение ПК Роль синтеза искусств в развитии музыкальной отзывчивости детей старшего дошкольного возраста.
Роль синтеза искусств в развитии музыкальной отзывчивости детей старшего дошкольного возраста. Team Roles “Coming together is a beginning. Keeping together is progress. Working together is success” Henry Ford
Team Roles “Coming together is a beginning. Keeping together is progress. Working together is success” Henry Ford Презентация к классному часу Мой путь к доброте 2 кл
Презентация к классному часу Мой путь к доброте 2 кл Химия вокруг нас
Химия вокруг нас BioLink FingerPass IC Биометрический терминал контроля доступа и учета рабочего времени
BioLink FingerPass IC Биометрический терминал контроля доступа и учета рабочего времени Корреляционный и регрессионный анализ. Анализ парных взаимосвязей
Корреляционный и регрессионный анализ. Анализ парных взаимосвязей Общий порядок подготовки к судебному заседанию
Общий порядок подготовки к судебному заседанию Развитие индивидуального жилищного строительства в Российской Федерации АО Банк ДОМ.РФ
Развитие индивидуального жилищного строительства в Российской Федерации АО Банк ДОМ.РФ Системы ввода-вывода и периферийные устройства
Системы ввода-вывода и периферийные устройства Советы для родителей Пальчиковая гимнастика в стихах
Советы для родителей Пальчиковая гимнастика в стихах Саул. Царственные задатки и непослушание, гордость, зависть
Саул. Царственные задатки и непослушание, гордость, зависть