Содержание
- 2. 1. Классификация и физико-химические свойства протеиногенных аминокислот
- 3. Протеиногенные аминокислоты – аминокислоты, из которых синтезируются белки, т.е. это те аминокислоты, которые кодируются геномом (20
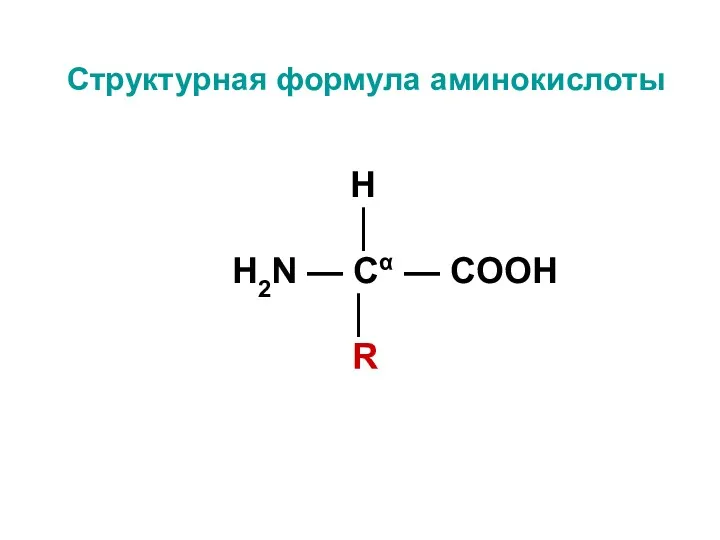
- 4. Структурная формула аминокислоты H │ H2N — Cα — COOH │ R
- 5. Классификации аминокислот: 1. Структурная (по строению бокового радикала) – ациклические (алифатические), циклические (ароматические, гетероциклические), иминокислота –
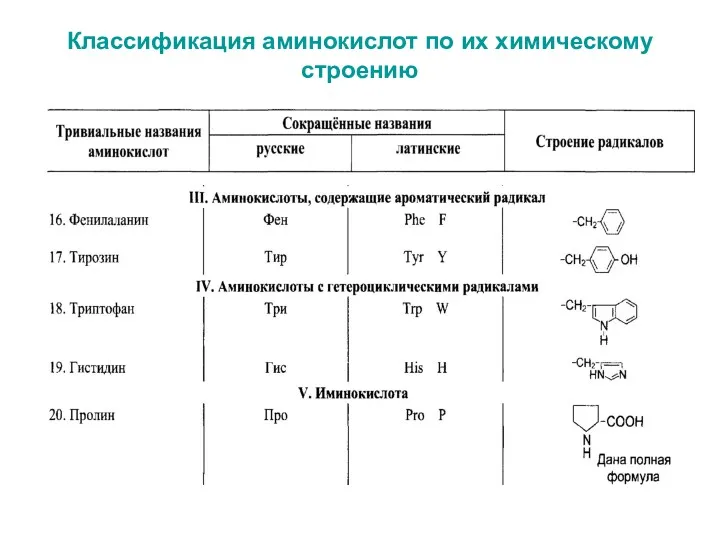
- 6. Классификация аминокислот по их химическому строению
- 7. Классификация аминокислот по их химическому строению
- 8. Классификация аминокислот по их химическому строению
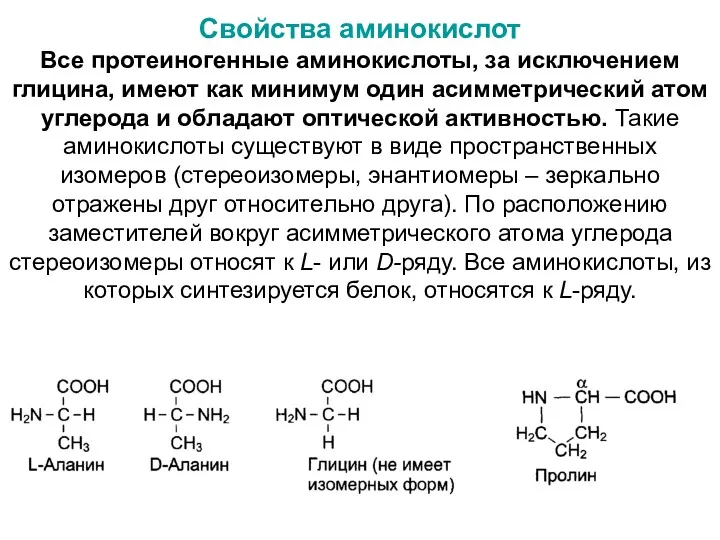
- 9. Свойства аминокислот Все протеиногенные аминокислоты, за исключением глицина, имеют как минимум один асимметрический атом углерода и
- 10. Свойства стереоизомеров аминокислот
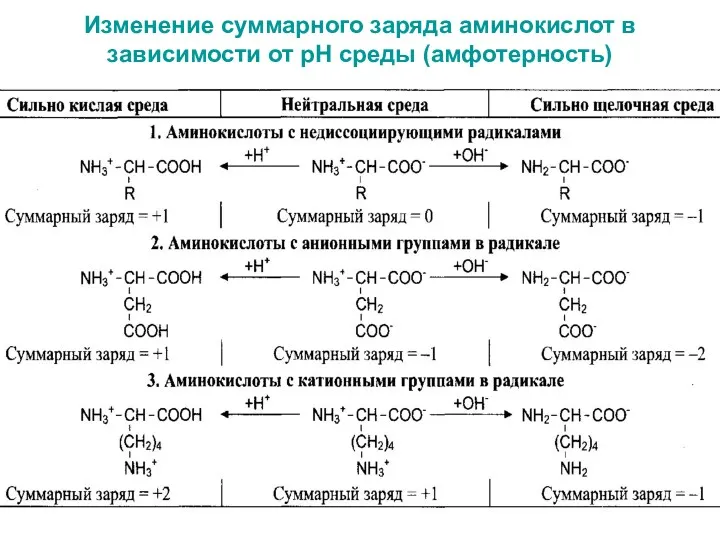
- 11. Изменение суммарного заряда аминокислот в зависимости от рН среды (амфотерность)
- 12. В зависимости от рН среды аминокислоты имеют суммарный нулевой, положительный или отрицательный заряд. Состояние, в котором
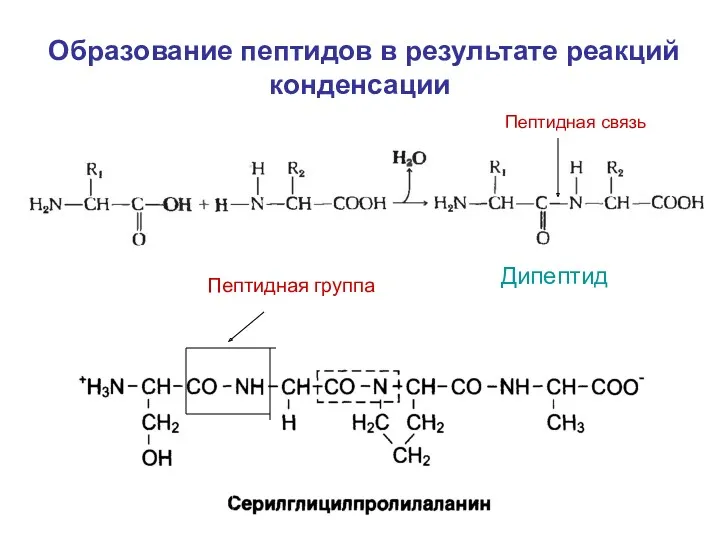
- 13. Образование пептидов в результате реакций конденсации Дипептид Пептидная связь Пептидная группа
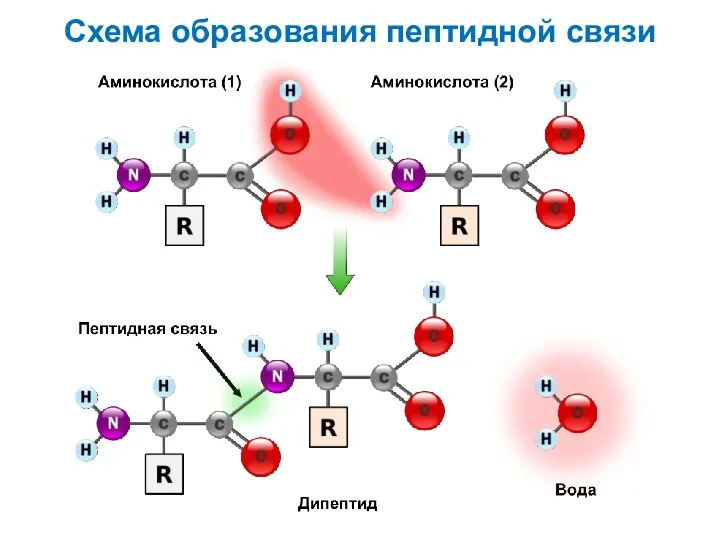
- 14. Схема образования пептидной связи
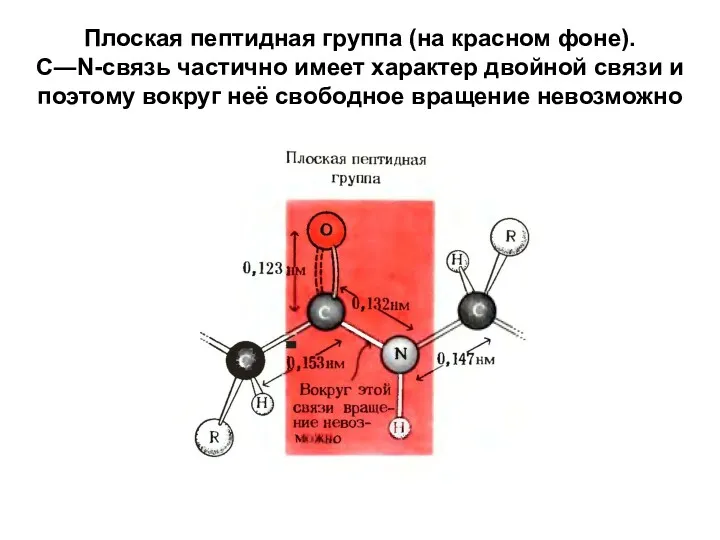
- 15. Плоская пептидная группа (на красном фоне). C―N-связь частично имеет характер двойной связи и поэтому вокруг неё
- 16. 2. Классификация белков: простые и сложные, глобулярные и фибриллярные, мономерные и олигомерные
- 17. Классификация пептидов и белков по количеству аминокислотных остатков Олигопептиды – пептиды, содержащие до 10 аминокислот (трипептид,
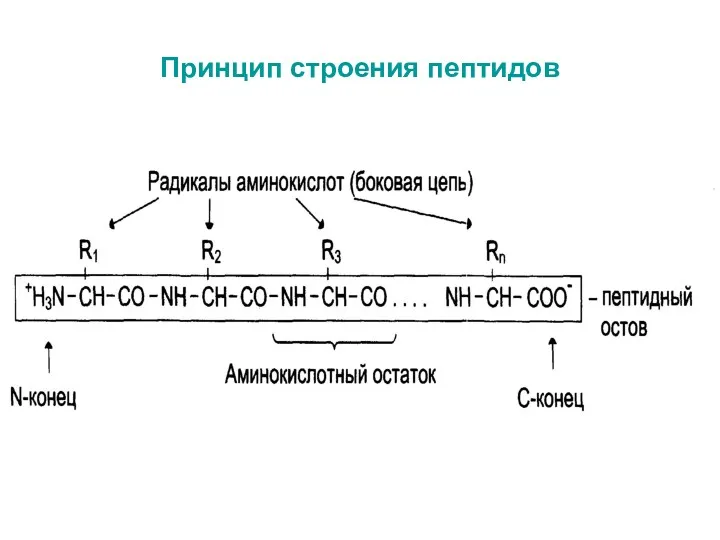
- 18. Принцип строения пептидов
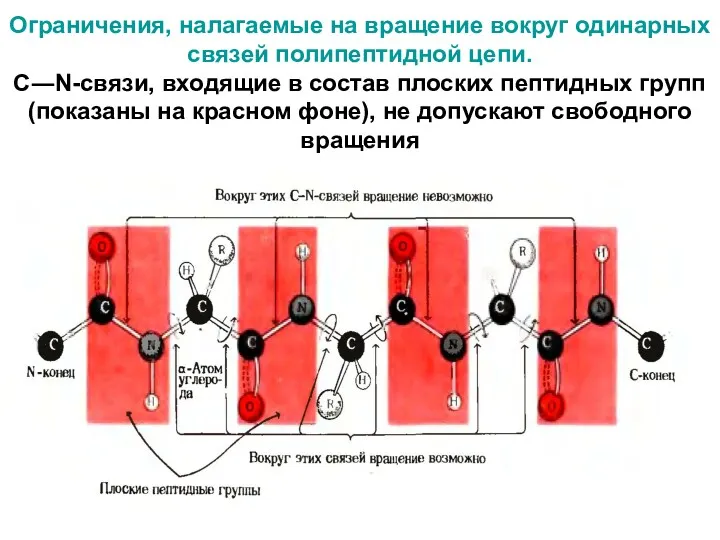
- 19. Ограничения, налагаемые на вращение вокруг одинарных связей полипептидной цепи. C―N-связи, входящие в состав плоских пептидных групп
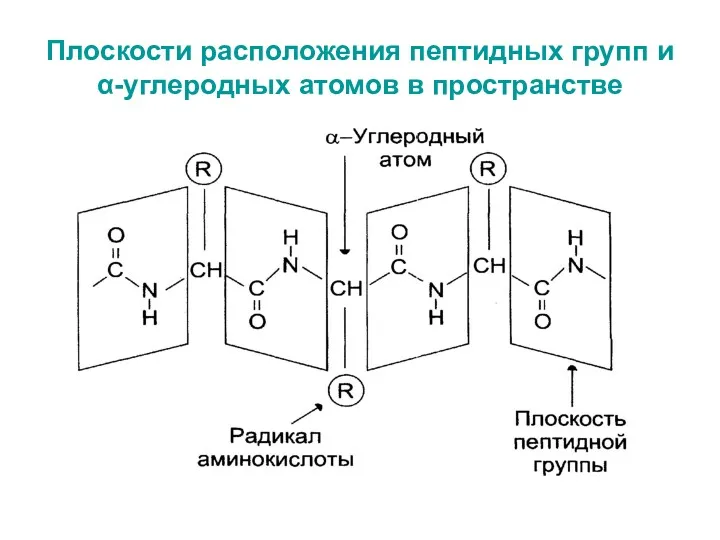
- 20. Плоскости расположения пептидных групп и α-углеродных атомов в пространстве
- 21. Классификация пептидов по физиологическому действию Пептиды, обладающие гормональной активностью (окситоцин, вазопрессин, рилизинг-гормоны, меланоцитстимулирующий гормон, глюкагон и
- 22. Виды классификаций белков: 1. По составу (простые и сложные). 2. По форме (глобулярные и фибриллярные). 3.
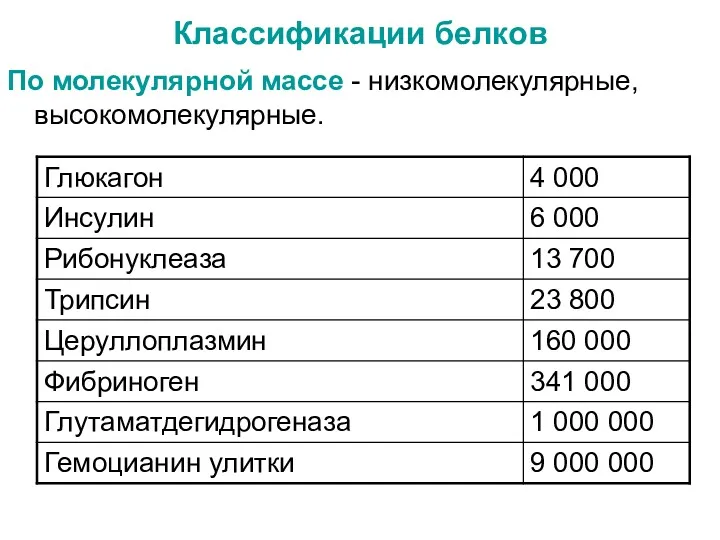
- 23. Классификации белков По молекулярной массе - низкомолекулярные, высокомолекулярные.
- 24. Классификации белков По химическому строению (отсутствие или наличие небелковой части – простые или сложные): простые (при
- 25. Классификации белков По локализации в клетке (ядерные, цитоплазматические, мембраносвязанные, лизосомальные и др.). По локализации в организме
- 26. Количество протомеров в структуре олигомерных белков В состав олигомерных белков может входить от 2 до нескольких
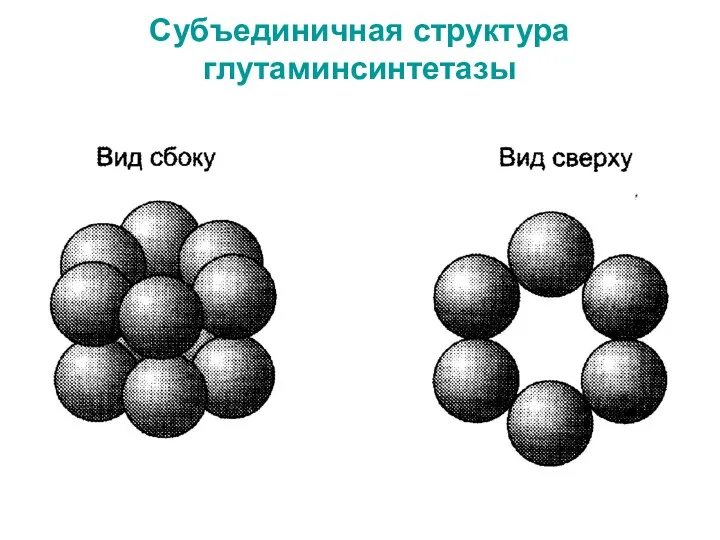
- 27. Субъединичная структура глутаминсинтетазы
- 28. Классификации белков По форме молекул (глобулярные, фибриллярные). Глобулярные (соотношение продольной и поперечной осей не превышает 1:10,
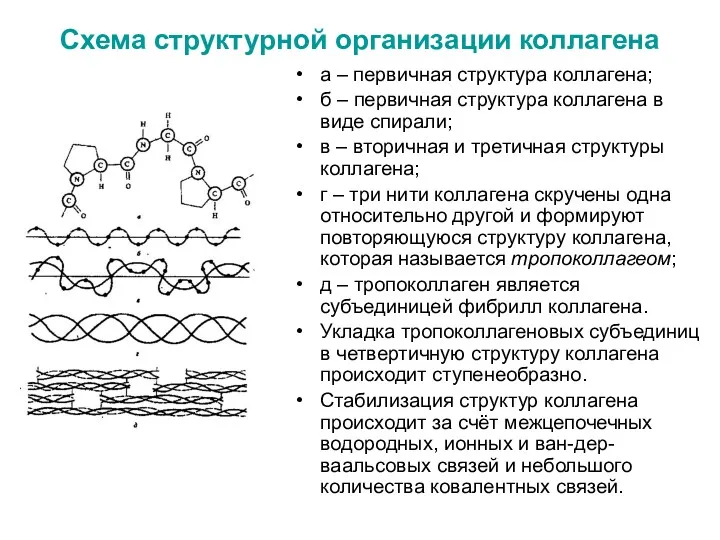
- 29. Схема структурной организации коллагена а – первичная структура коллагена; б – первичная структура коллагена в виде
- 30. 3. Физико-химические свойства белков: растворимость, амфотерность, ионизация, гидратация, осаждение
- 31. Физико-химические свойства белков: растворимость; амфотерность; ионизация; гидратация белков; осаждение; буферные свойства; коллоидные и осмотические свойства; оптические
- 32. 4. Уровни структурной организации белков: первичная, вторичная, надвторичная, третичная и четвертичная структуры, домены, надмолекулярные структуры. Связи,
- 33. Структура белков Белки представляют собой цепи, содержащие десятки, сотни и тысячи аминокислотных остатков, соединённых прочными ковалентными
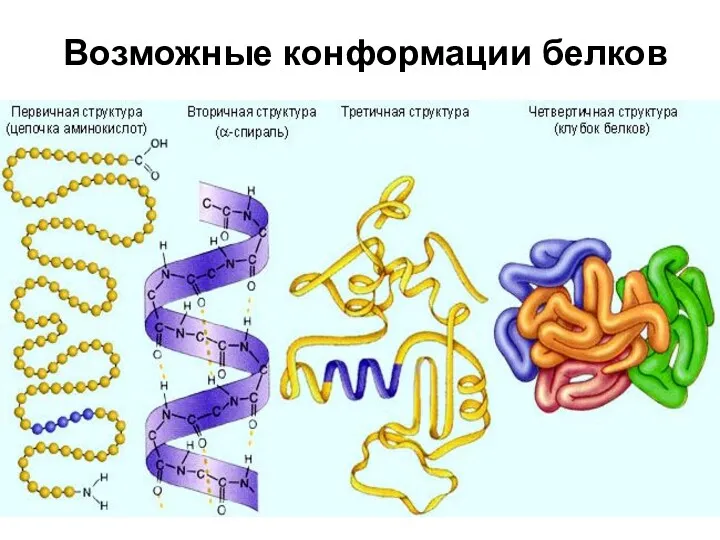
- 34. Возможные конформации белков
- 35. Первичная структура белков Первичная структура белков – последовательность аминокислот в полипептидной цепи, качественный и количественный состав
- 36. Вторичная структура белков Вторичная структура белков – пространственная структура, образующаяся в результате взаимодействий между функциональными группами,
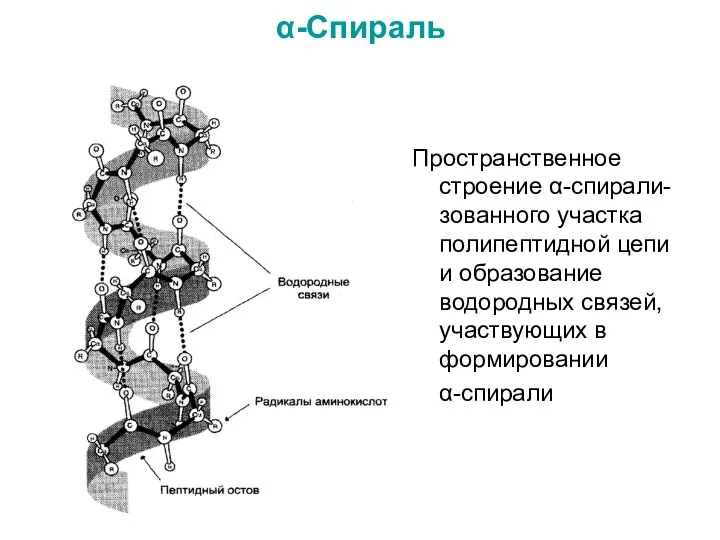
- 37. α-Спираль Пространственное строение α-спирали-зованного участка полипептидной цепи и образование водородных связей, участвующих в формировании α-спирали
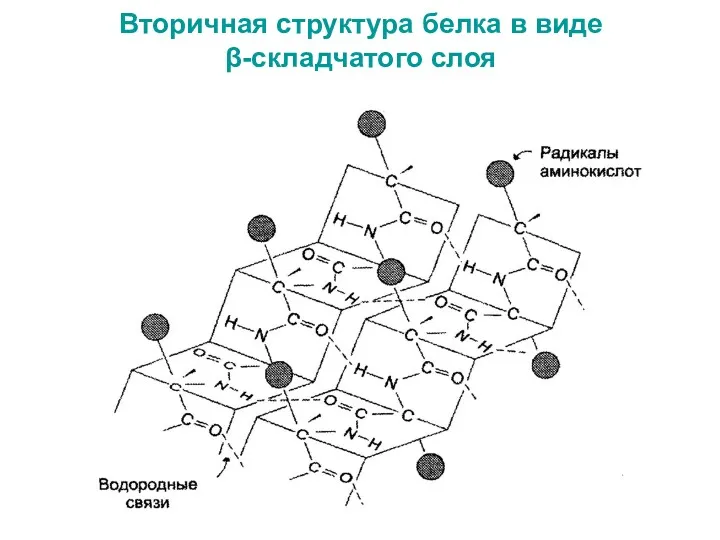
- 38. Вторичная структура белка в виде β-складчатого слоя
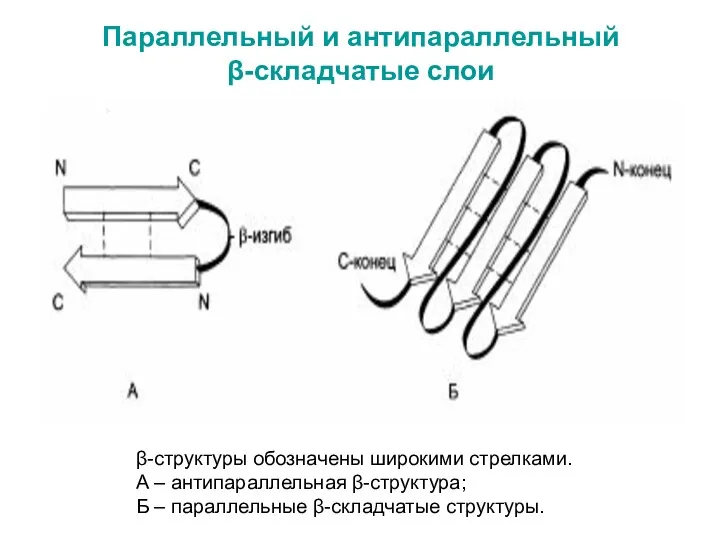
- 39. Параллельный и антипараллельный β-складчатые слои β-структуры обозначены широкими стрелками. А – антипараллельная β-структура; Б – параллельные
- 40. Супервторичная (надвторичная) структура белков Специфический порядок формирования вторичной структуры, содержащий сочетания элементов вторичной структуры (α-спирали и
- 41. Классификация супервторичных структур («структурные мотивы») «α-спираль-поворот-α-спираль» (ДНК-связывающий белок); «структура β-бочонка» (домен пируваткиназы, триозофосфатизомераза); «лейциновая застёжка-молния» (молекулы
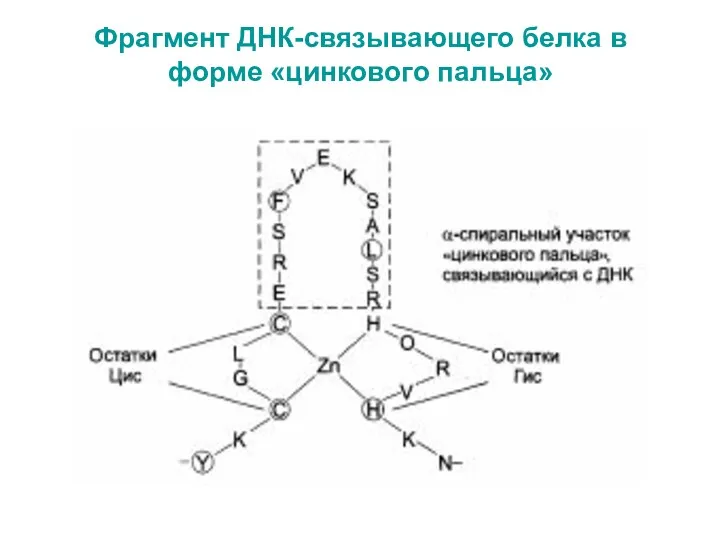
- 42. Фрагмент ДНК-связывающего белка в форме «цинкового пальца»
- 43. Если полипептидная цепь белка содержит более 200 аминокислот, то, как правило, её пространственная структура сформирована в
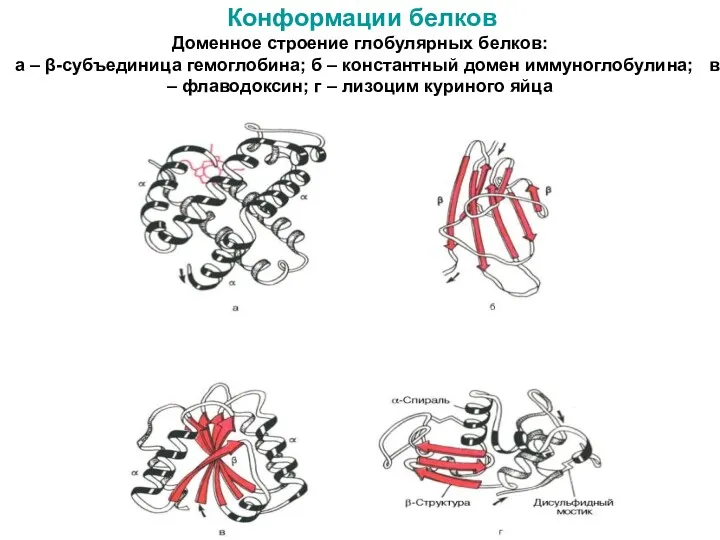
- 44. Конформации белков Доменное строение глобулярных белков: а – β-субъединица гемоглобина; б – константный домен иммуноглобулина; в
- 45. Конформации белков Третичная структура белков – трехмерная пространственная структура, образующаяся за счет взаимодействий между радикалами аминокислот,
- 46. Связи, принимающие участие в формировании третичной структуры белков
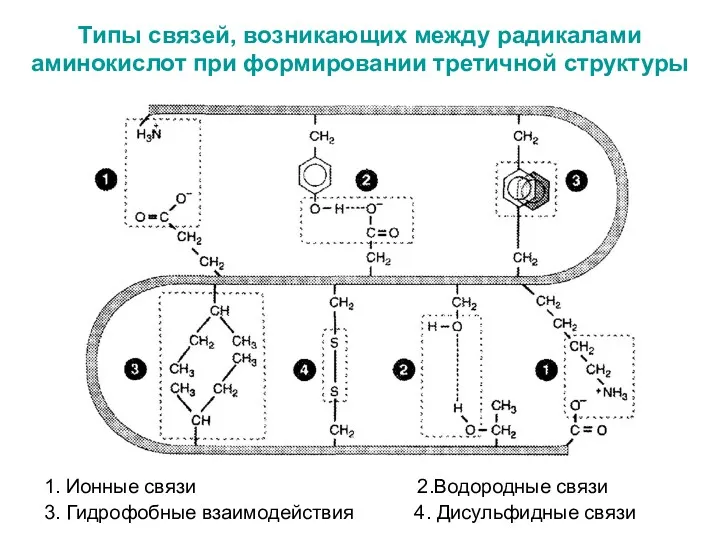
- 47. Типы связей, возникающих между радикалами аминокислот при формировании третичной структуры 1. Ионные связи 2.Водородные связи 3.
- 48. Связи, принимающие участие в формировании третичной структуры белков Гидрофобные радикалы аминокислот стремятся к объединению внутри глобулярной
- 49. Связи, принимающие участие в формировании третичной структуры белков Ионные связи могут возникать между отрицательно заряженными (анионными)
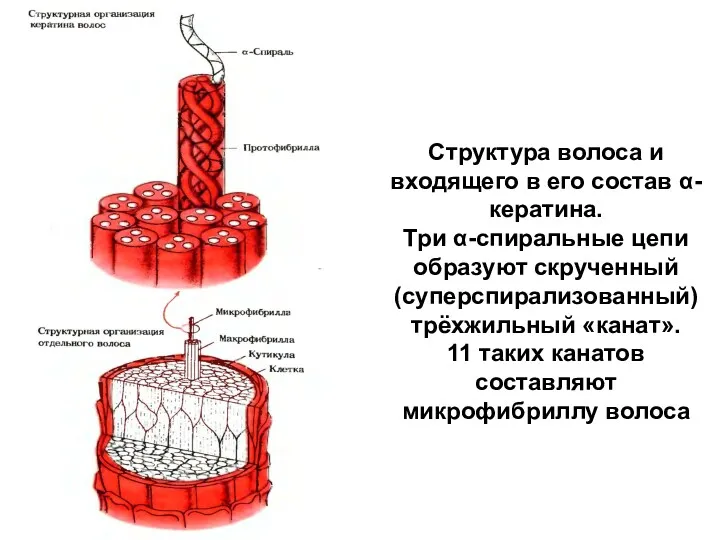
- 50. Структура волоса и входящего в его состав α-кератина. Три α-спиральные цепи образуют скрученный (суперспирализованный) трёхжильный «канат».
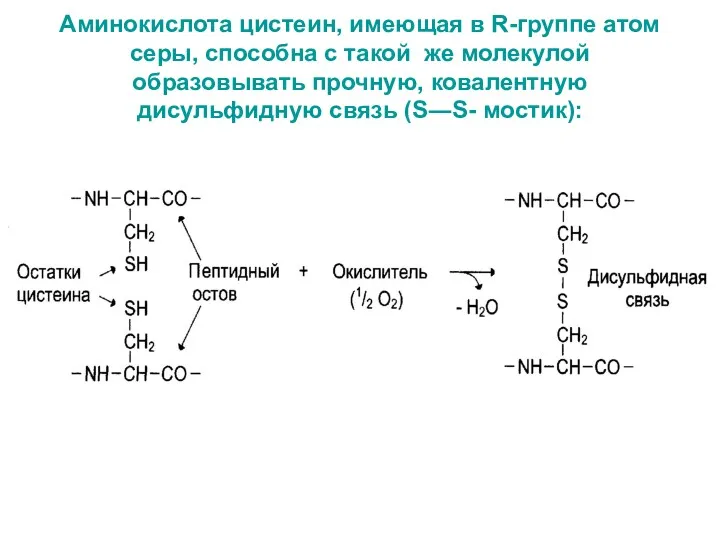
- 51. Аминокислота цистеин, имеющая в R-группе атом серы, способна с такой же молекулой образовывать прочную, ковалентную дисульфидную
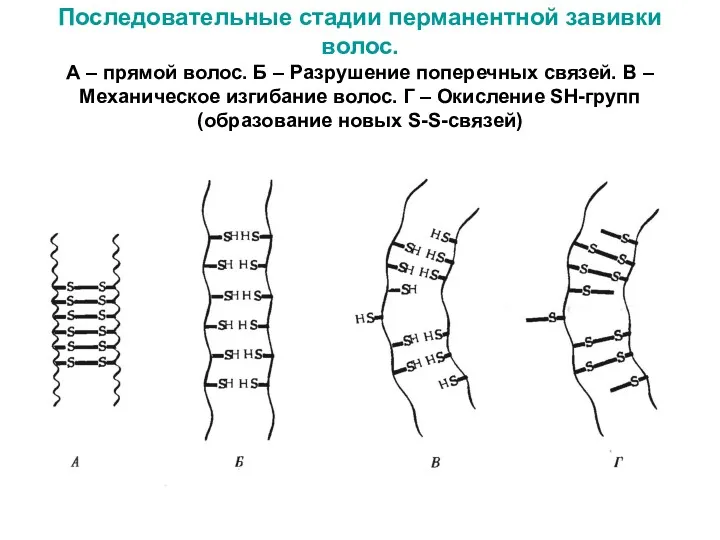
- 52. Последовательные стадии перманентной завивки волос. А – прямой волос. Б – Разрушение поперечных связей. В –
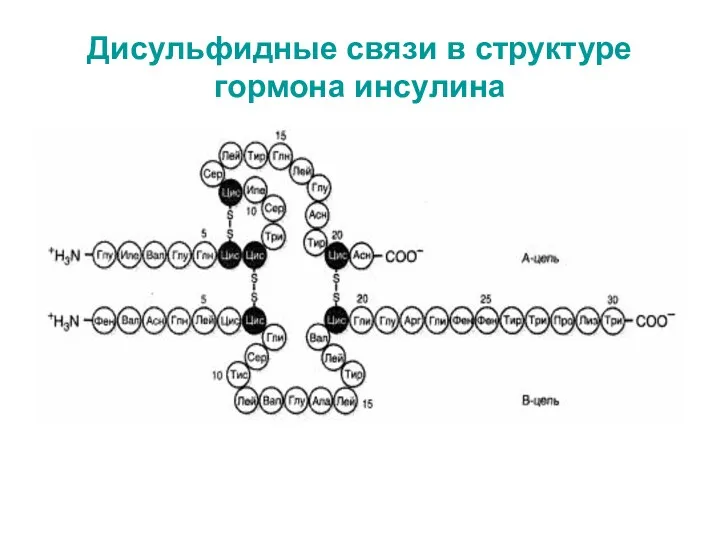
- 53. Дисульфидные связи в структуре гормона инсулина
- 54. Все белки с одинаковой первичной структурой, находящиеся в одинаковых условиях, приобретают одинаковую, характерную для данного индивидуального
- 55. Конформации белков Количество и взаиморасположение полипептидных цепей в пространстве называют «четвертичная структура белков». Отдельные полипептидные цепи
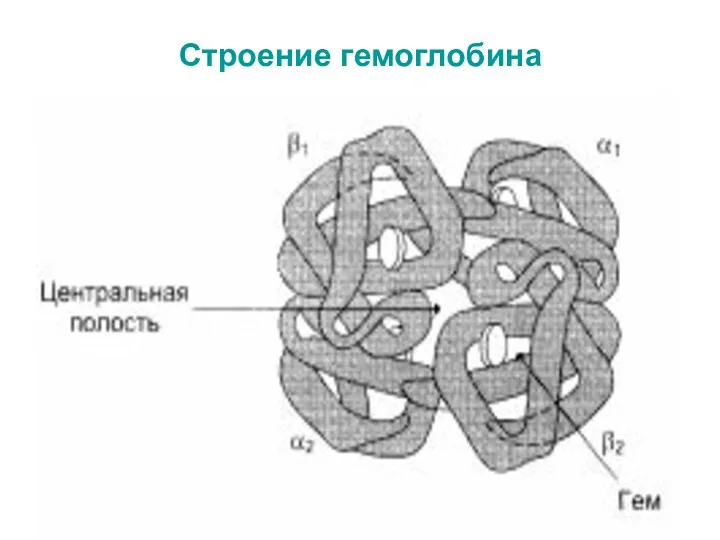
- 56. Строение гемоглобина
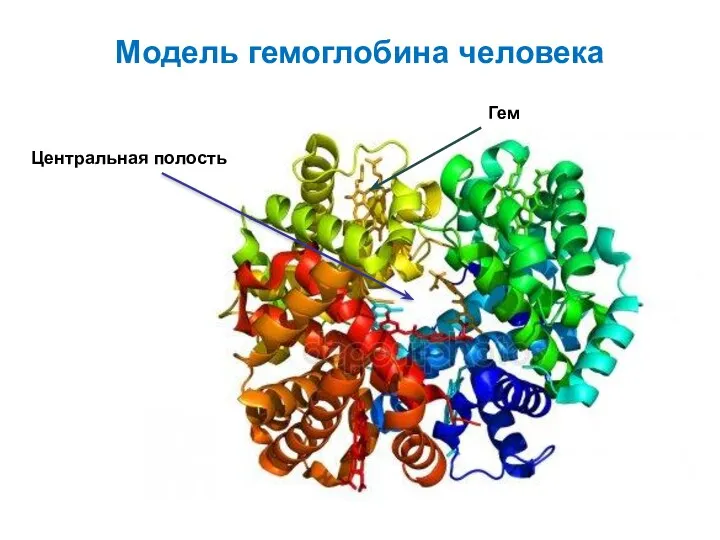
- 57. Модель гемоглобина человека Центральная полость Гем
- 58. 5. Взаимосвязь структуры и функции. Денатурация и ренатурация
- 59. Денатурация – изменение нативной структуры белка под действием различных факторов (химические – концентрированные кислоты, щёлочи, спирты
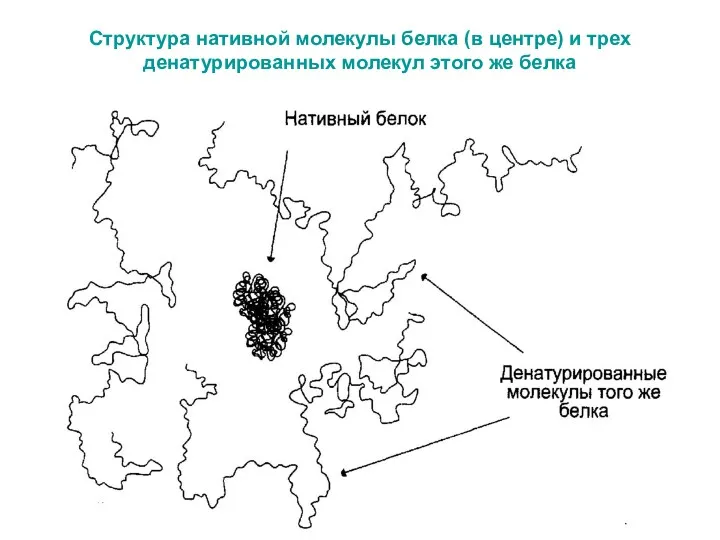
- 60. Структура нативной молекулы белка (в центре) и трех денатурированных молекул этого же белка
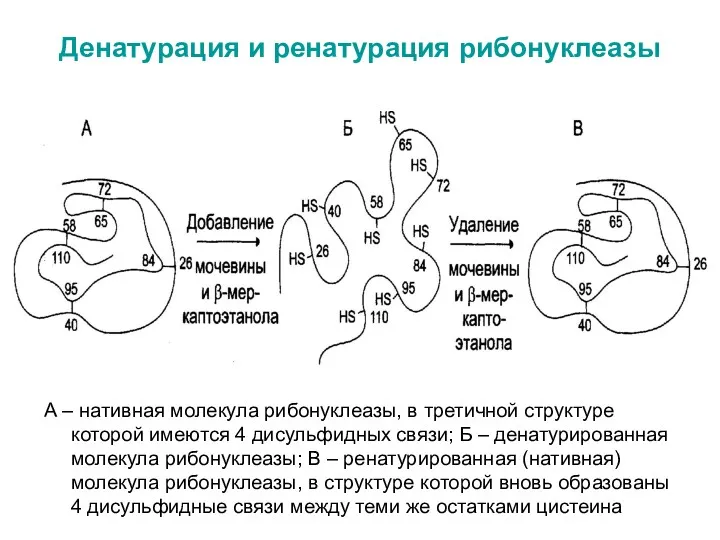
- 61. Денатурация и ренатурация рибонуклеазы А – нативная молекула рибонуклеазы, в третичной структуре которой имеются 4 дисульфидных
- 62. Формирование трёхмерной структуры белка в клетке
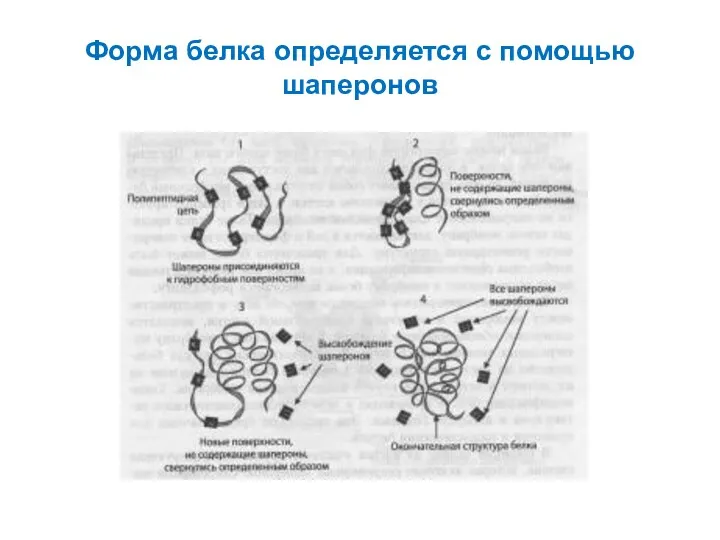
- 63. Форма белка определяется с помощью шаперонов
- 64. Болезни, связанные с нарушением фолдинга белков Некоторые растворимые в воде белки при изменении условий могут приобретать
- 65. 6. Функции белков: структурная, каталитическая, транспортная, рецепторная, регуляторная, защитная, сократительная и др.
- 66. Классификации белков По выполняемым функциям: ферменты (катализаторы – каталаза, амилаза и др.), регуляторные (гормоны и др.),
- 67. 7. Свойства простых белков. Гистоны, альбумины. Структурные белки: тубулины, кератины, коллаген, эластин
- 68. Простые белки при гидролизе распадаются только на свободные аминокислоты. Простые белки делятся на основании некоторых условно
- 69. Гистоны – являются белками основного характера, растворимы в солевых растворах. Гистоны выполняют две основные функции: они
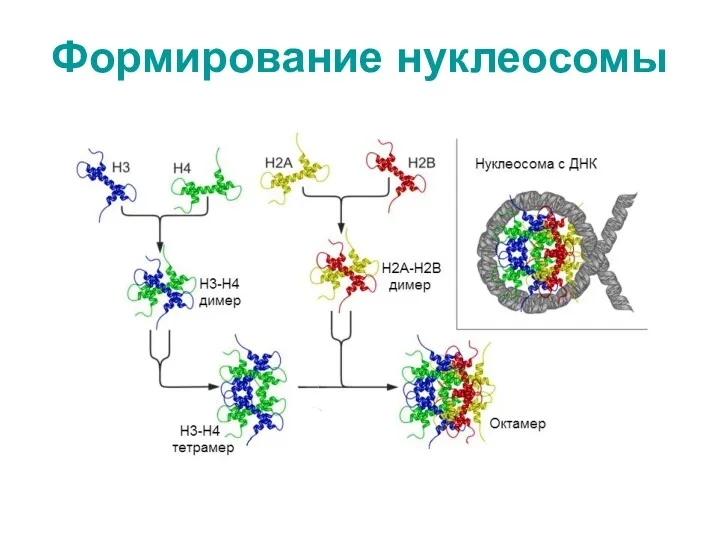
- 70. Формирование нуклеосомы
- 71. Альбумины (от лат. albumen, род. падеж albuminis – белок) – растворимы в воде и солевых растворах,
- 72. Кератины – семейство фибриллярных белков, обладающих механической прочностью, которая среди материалов биологического происхождения уступает лишь хитину.
- 73. Тубулин – основной белок микротрубочек, обладающий сократительными функциями; димер, состоящий из α- и β-цепей с молекулярными
- 74. Коллаген – составляет 25-33% от общего количества белка организма взрослого человека, или 6% от массы тела.
- 75. Эластин – основной белковый компонент, из которого состоят эластические волокна. При ферментативном гидролизе эластина в гидролизате
- 77. Скачать презентацию












































 Тип Кишечнополостные. Тип Гребневики. Жизненные циклы кишечнополостных
Тип Кишечнополостные. Тип Гребневики. Жизненные циклы кишечнополостных The endangered animals
The endangered animals Пищеварение в ротовой полости и желудке
Пищеварение в ротовой полости и желудке Постельные клопы
Постельные клопы Мочеполовой аппарат. Органы мочеотделения. (Лекция 5)
Мочеполовой аппарат. Органы мочеотделения. (Лекция 5) Педсовет Современные подходы к преподаванию в условиях ФГОС
Педсовет Современные подходы к преподаванию в условиях ФГОС Размножение организмов. (Лекция 5)
Размножение организмов. (Лекция 5) Оснащение микробиологической лаборатории
Оснащение микробиологической лаборатории Кора большого мозга
Кора большого мозга Венозная система. Лекция № 19
Венозная система. Лекция № 19 Лабораторная диагностика нарушений обмена белков плазмы крови (Преальбумин, С-РБ, Фибронектин, Фибриноген)
Лабораторная диагностика нарушений обмена белков плазмы крови (Преальбумин, С-РБ, Фибронектин, Фибриноген) Теории происхождения жизни. (Лекция 15)
Теории происхождения жизни. (Лекция 15) Становление наук о человеке
Становление наук о человеке Рябина обыкновенная
Рябина обыкновенная Строение сердечно-сосудистой системы
Строение сердечно-сосудистой системы Қызыл балдырлардың түрлерінің жалпы
Қызыл балдырлардың түрлерінің жалпы Различия в строении клеток эукариот и прокариот
Различия в строении клеток эукариот и прокариот Объекты дендрологии. Понятие о жизненной форме у древесных растений
Объекты дендрологии. Понятие о жизненной форме у древесных растений Мышцы туловища, головы, шеи
Мышцы туловища, головы, шеи презентация Орган слуха
презентация Орган слуха Різноманітність ссавців
Різноманітність ссавців Высшие жирные кислоты. Липиды
Высшие жирные кислоты. Липиды Вирусы, вирусология.
Вирусы, вирусология. Обмін білків
Обмін білків Симпатический отдел автономной нервной системы
Симпатический отдел автономной нервной системы Биотические связи
Биотические связи Углеводы. 9 класс
Углеводы. 9 класс Строение клетки растения и животного
Строение клетки растения и животного