Содержание
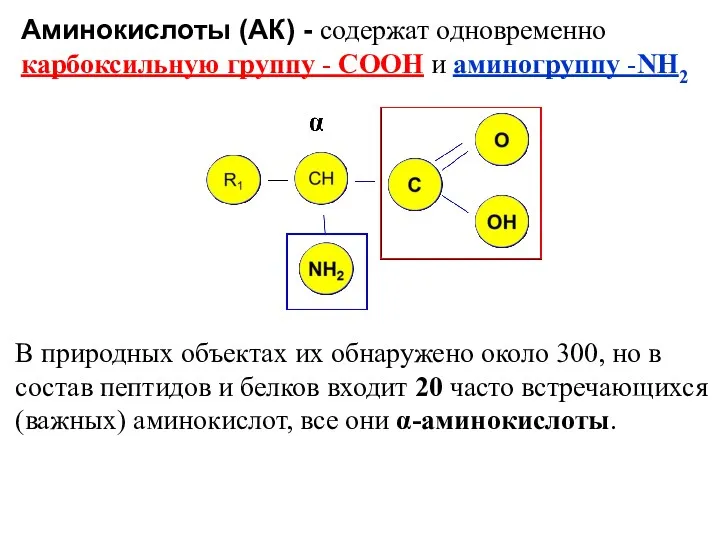
- 2. В природных объектах их обнаружено около 300, но в состав пептидов и белков входит 20 часто
- 3. КЛАССИФИКАЦИЯ α-АМИНОКИСЛОТ САМОСТОЯТЕЛЬНО Литература: 1. Биоорганическая химия: учебник для вузов / Н.А. Тюкавкина, Ю.И. Бауков –
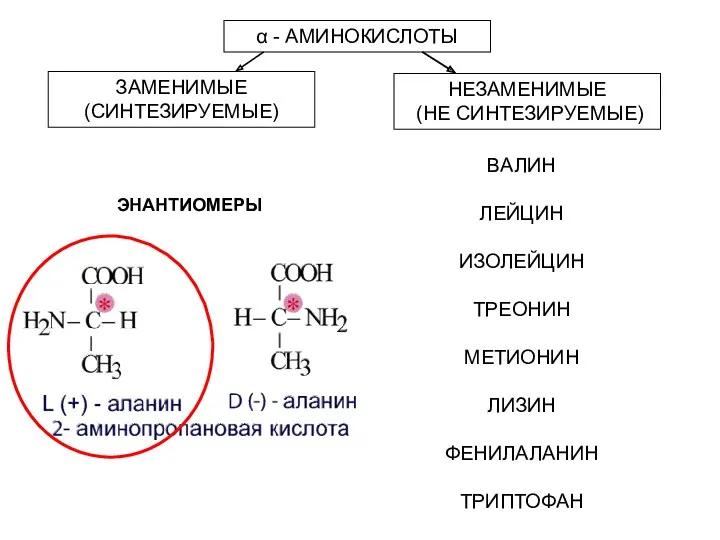
- 4. α - АМИНОКИСЛОТЫ ЗАМЕНИМЫЕ (СИНТЕЗИРУЕМЫЕ) НЕЗАМЕНИМЫЕ (НЕ СИНТЕЗИРУЕМЫЕ) ВАЛИН ЛЕЙЦИН ИЗОЛЕЙЦИН ТРЕОНИН МЕТИОНИН ЛИЗИН ФЕНИЛАЛАНИН ТРИПТОФАН
- 5. По кислотно-основным свойствам аминокислоты делят на три группы: Кислые - с карбоксильными группами в боковом радикале:
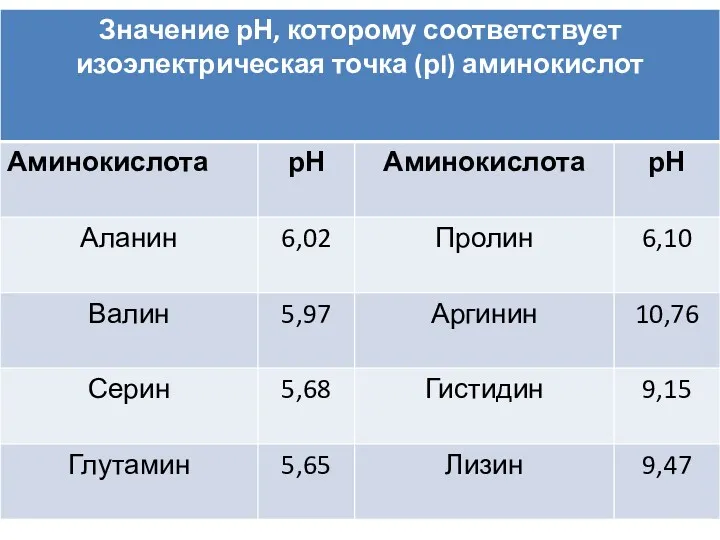
- 6. Изоэлектрическая точка (ИЭТ) – это значение pH раствора, при котором молекулы существуют в виде диполярных ионов.
- 7. Биологически важные реакции α-аминокислот
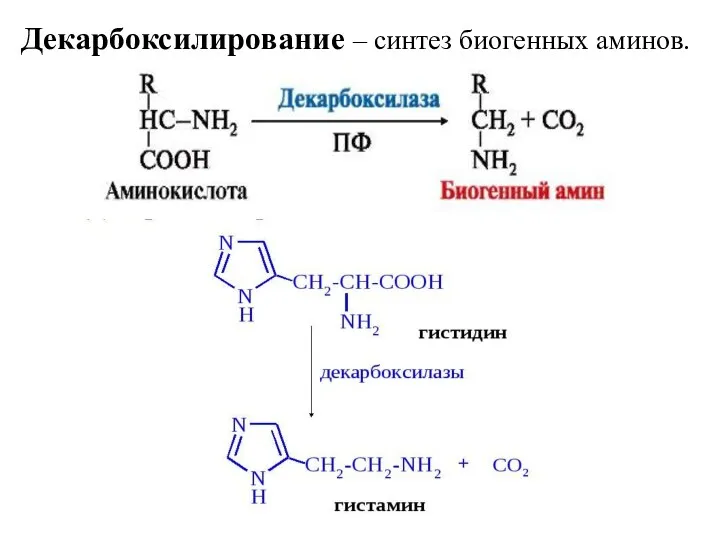
- 8. Декарбоксилирование – синтез биогенных аминов.
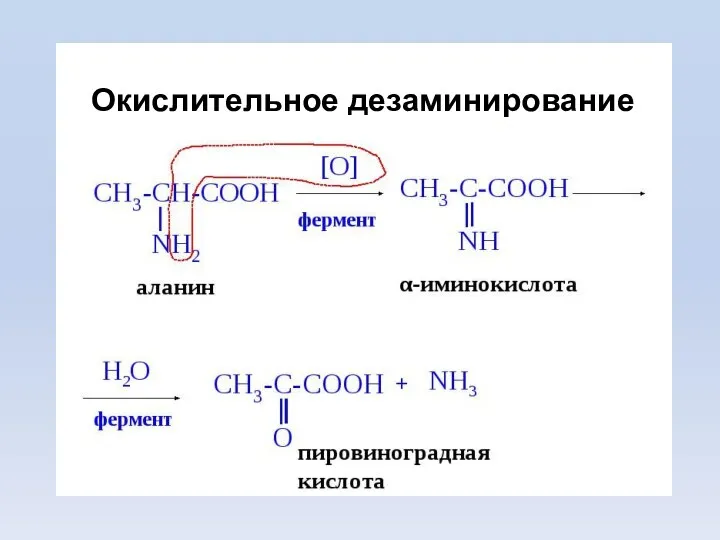
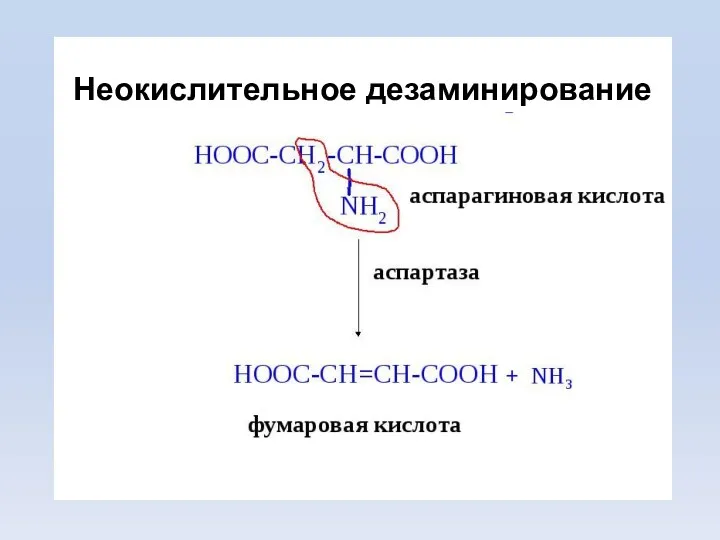
- 9. Дезаминирование – удаления α-АК, которая выделяется в виде NH3 и образования α-кетокислоты. Общее количество АК уменьшается.
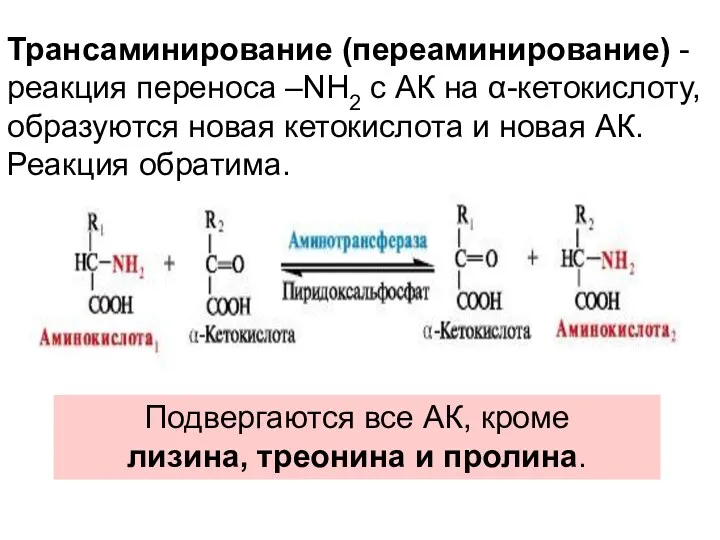
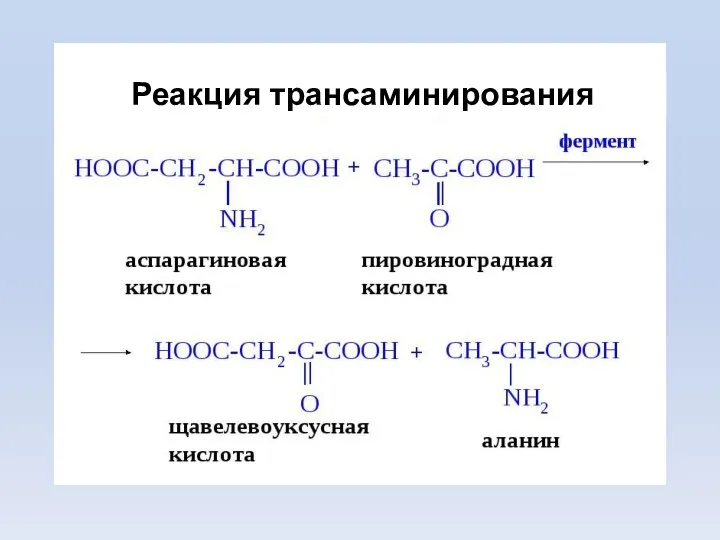
- 12. Трансаминирование (переаминирование) - реакция переноса –NH2 с АК на α-кетокислоту, образуются новая кетокислота и новая АК.
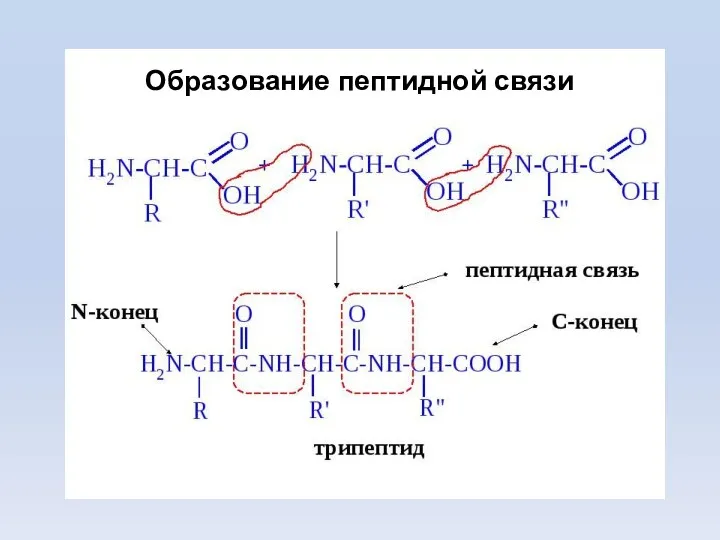
- 14. Образование пептидной связи
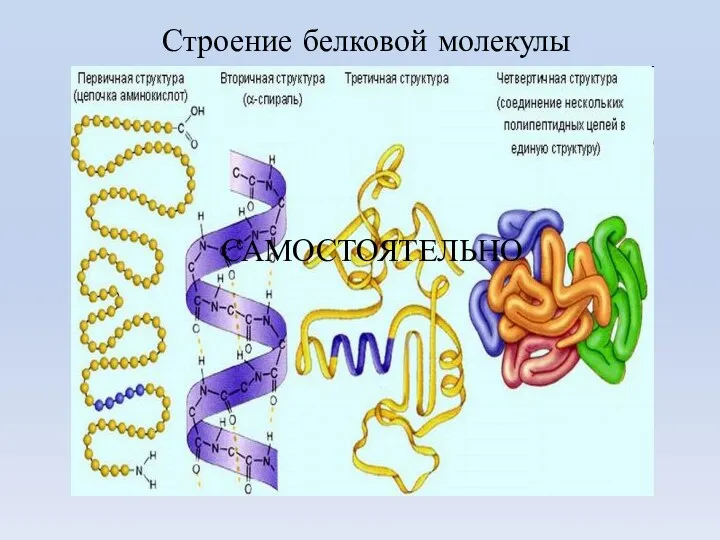
- 15. Строение белковой молекулы САМОСТОЯТЕЛЬНО
- 17. Скачать презентацию




 насекомые,особенности внешнего строения Божья коровка
насекомые,особенности внешнего строения Божья коровка Презентация к уроку биологии Взаимоотношения у животных 1 часть
Презентация к уроку биологии Взаимоотношения у животных 1 часть Dogs and cats
Dogs and cats Проводящие пути. 1
Проводящие пути. 1 Бионика. Влияние природы на развитие инженерии и архитектуры
Бионика. Влияние природы на развитие инженерии и архитектуры Загадочный Иван-чай или чудесное превращение Кипрея
Загадочный Иван-чай или чудесное превращение Кипрея Психические процессы. Ощущение и восприятие
Психические процессы. Ощущение и восприятие Предмет и объект биогеографии
Предмет и объект биогеографии Социально-биологические основы физической культуры
Социально-биологические основы физической культуры Cевообороты в лесных питомниках. Лекция 2
Cевообороты в лесных питомниках. Лекция 2 Физиология растений
Физиология растений Каратауский заповедник
Каратауский заповедник Зат және энергия алмасу
Зат және энергия алмасу Анатомия и физиология собак
Анатомия и физиология собак Ткани. Гистология
Ткани. Гистология Побег и почки. Внешнее строение листа
Побег и почки. Внешнее строение листа Биологический КВН Мир пёстрых плавничков
Биологический КВН Мир пёстрых плавничков презентация Позвоночные животные
презентация Позвоночные животные Редкие и интересные грибы
Редкие и интересные грибы Как среди неживой природы зародилась жизнь (6 класс)
Как среди неживой природы зародилась жизнь (6 класс) Гүл, оның құрылысы мен маңызы
Гүл, оның құрылысы мен маңызы Органы пищеварения и обмен веществ
Органы пищеварения и обмен веществ Клетка
Клетка Дополнительная презентация Декоративные растения в интерьерек элективному курсу Основы фитодизайна, 9 класс
Дополнительная презентация Декоративные растения в интерьерек элективному курсу Основы фитодизайна, 9 класс Презентация Человеческие расы
Презентация Человеческие расы Ствол мозга
Ствол мозга Типы питания клеток. Автотрофы и гетеротрофы
Типы питания клеток. Автотрофы и гетеротрофы Importance of excretion
Importance of excretion