Содержание
- 2. Стратегия: от белка к гену Изолировать белок на основе его функциональной активности (например, энзиматической или гормональной)
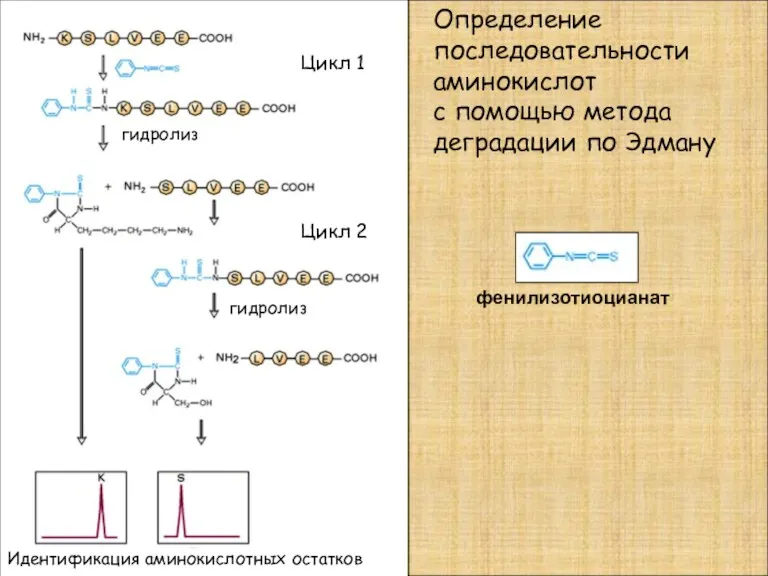
- 3. Определение последовательности аминокислот с помощью метода деградации по Эдману фенилизотиоцианат гидролиз Цикл 1 Цикл 2 Идентификация
- 4. Стратегия: от гена к белку Изолировать геномный клон, соответствующий измененному белку в мутанте (например, ауксотрофия, наследственные
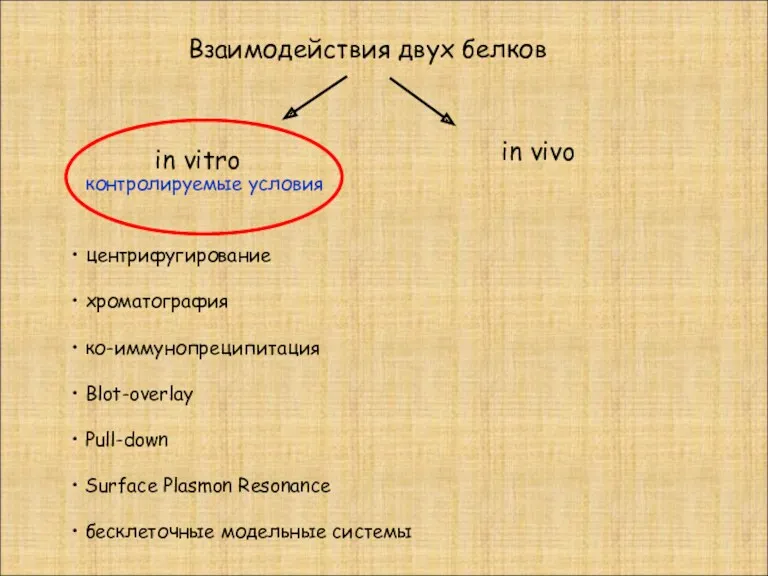
- 5. Взаимодействия двух белков in vivo in vitro центрифугирование хроматография ко-иммунопреципитация Blot-overlay Pull-down Surface Plasmon Resonance бесклеточные
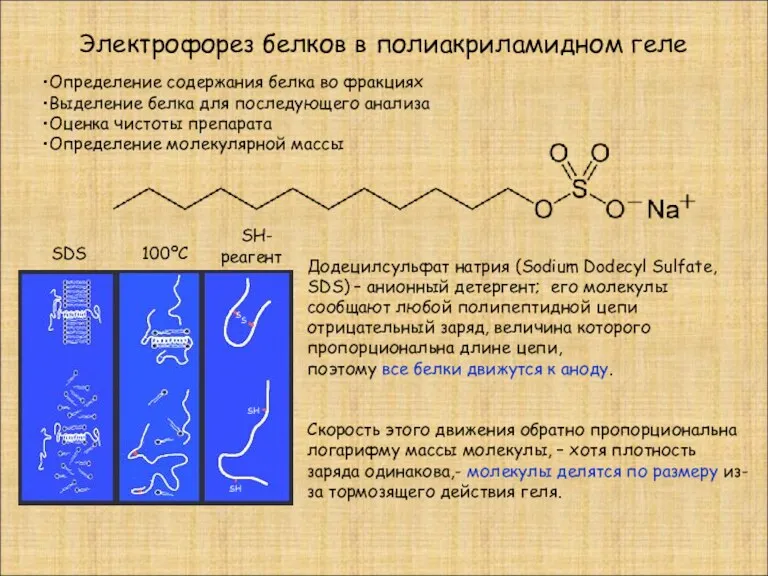
- 6. Электрофорез белков в полиакриламидном геле Определение содержания белка во фракциях Выделение белка для последующего анализа Оценка
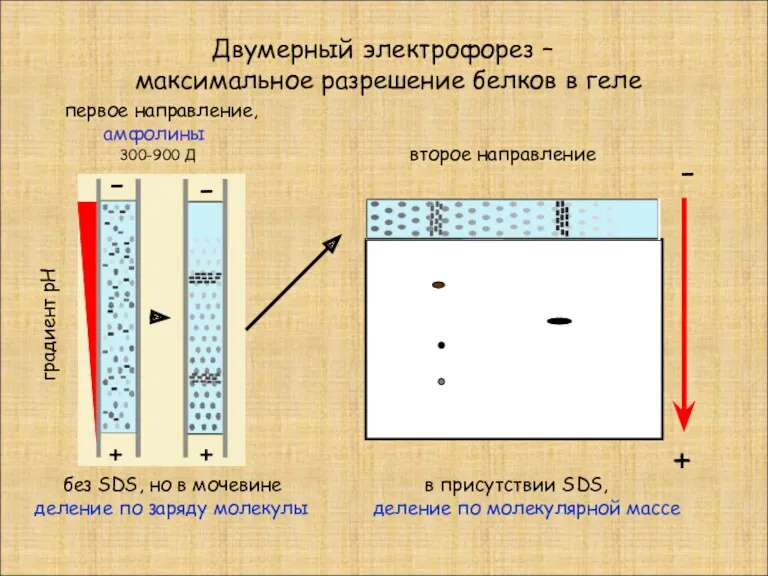
- 7. Двумерный электрофорез – максимальное разрешение белков в геле - - + + без SDS, но в
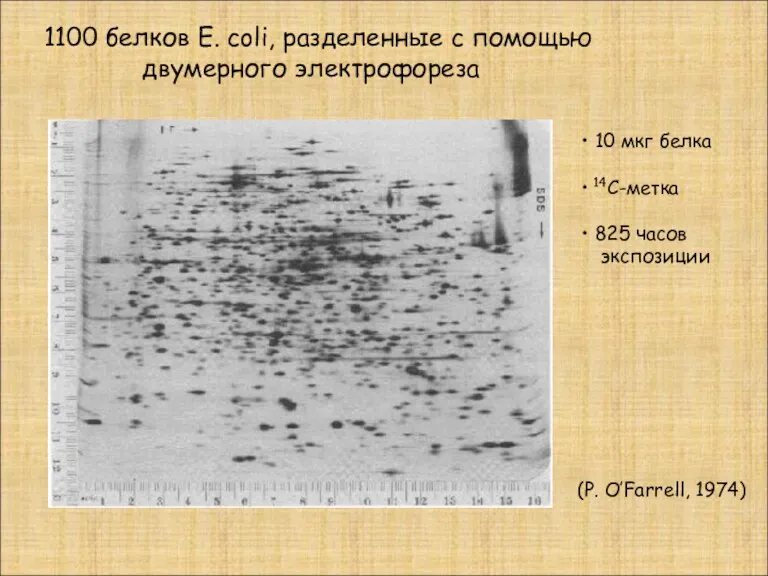
- 8. 10 мкг белка 14С-метка 825 часов экспозиции 1100 белков E. сoli, разделенные с помощью двумерного электрофореза
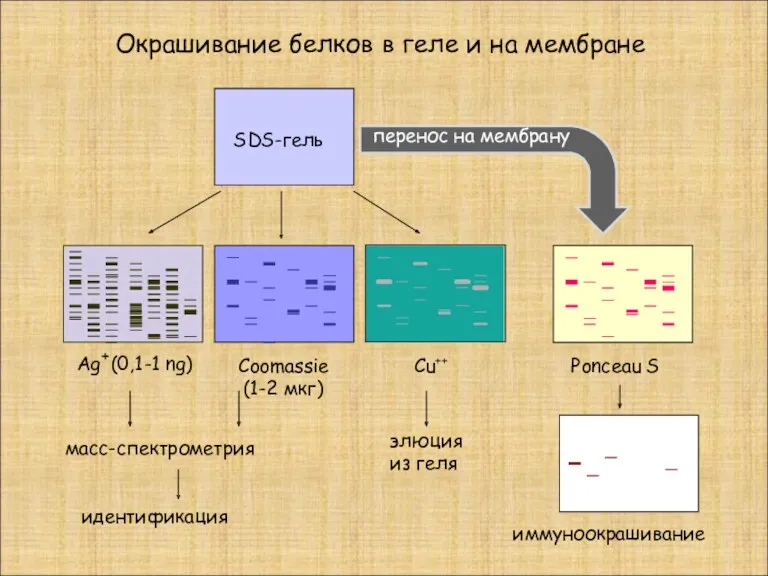
- 9. Окрашивание белков в геле и на мембране SDS-гель перенос на мембрану Ag (0,1-1 ng) Coomassie (1-2
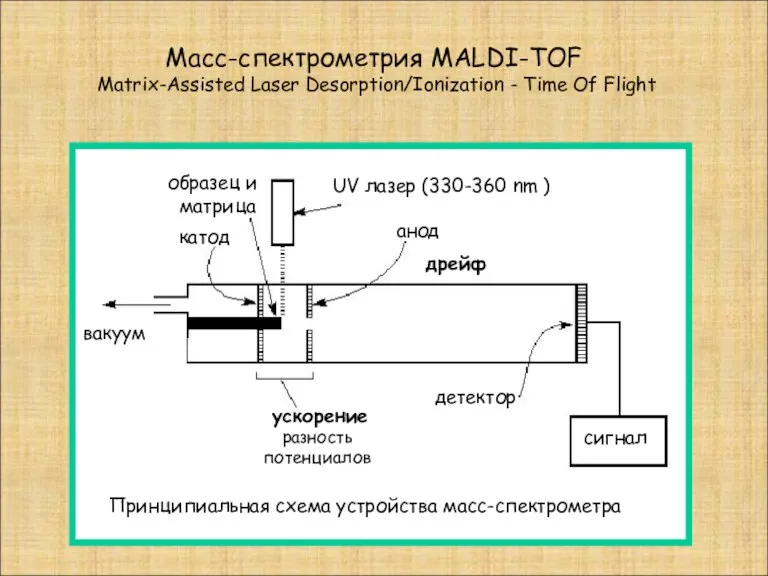
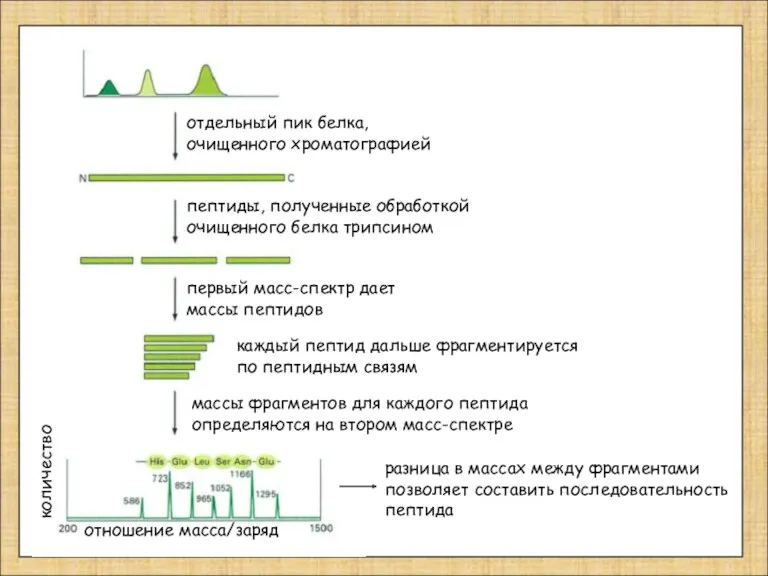
- 10. Масс-спектрометрия MALDI-TOF Matrix-Assisted Laser Desorption/Ionization - Time Of Flight UV лазер (330-360 nm ) катод анод
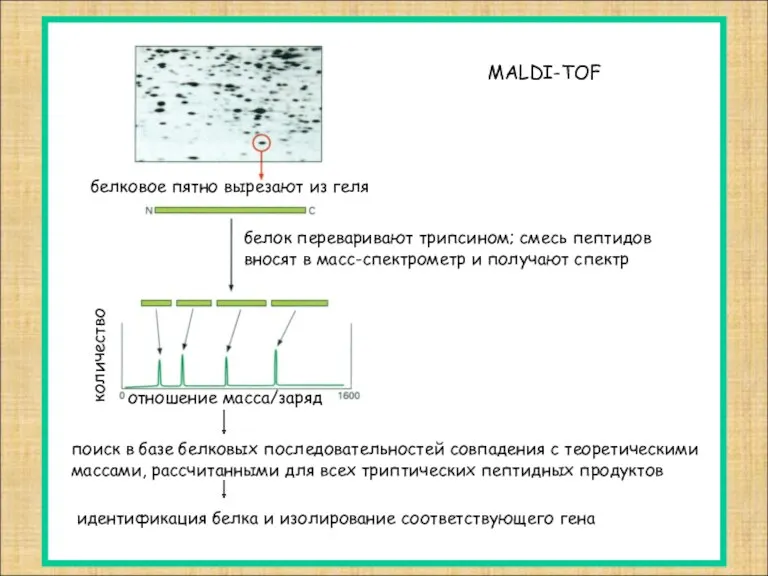
- 11. белковое пятно вырезают из геля белок переваривают трипсином; смесь пептидов вносят в масс-спектрометр и получают спектр
- 12. отдельный пик белка, очищенного хроматографией пептиды, полученные обработкой очищенного белка трипсином первый масс-спектр дает массы пептидов
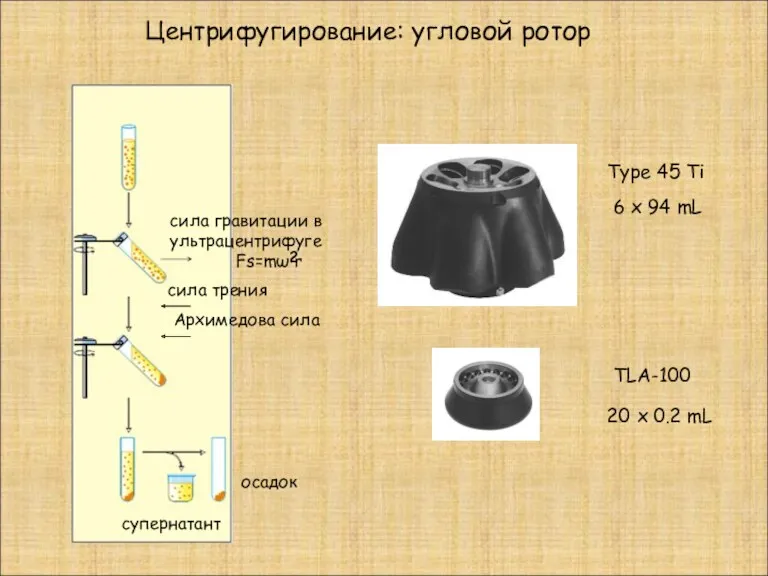
- 13. Центрифугирование: угловой ротор сила гравитации в ультрацентрифуге Fs=mω r супернатант осадок Type 45 Ti 6 x
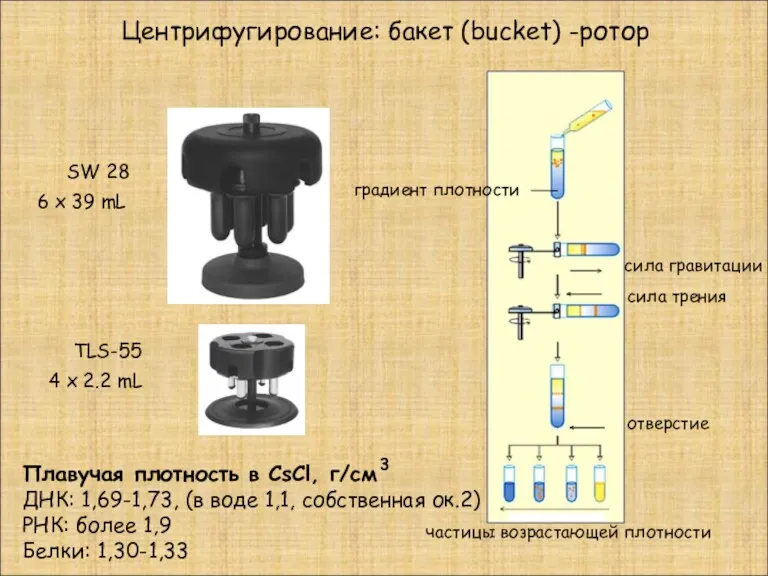
- 14. градиент плотности отверстие частицы возрастающей плотности сила гравитации TLS-55 4 x 2.2 mL 6 x 39
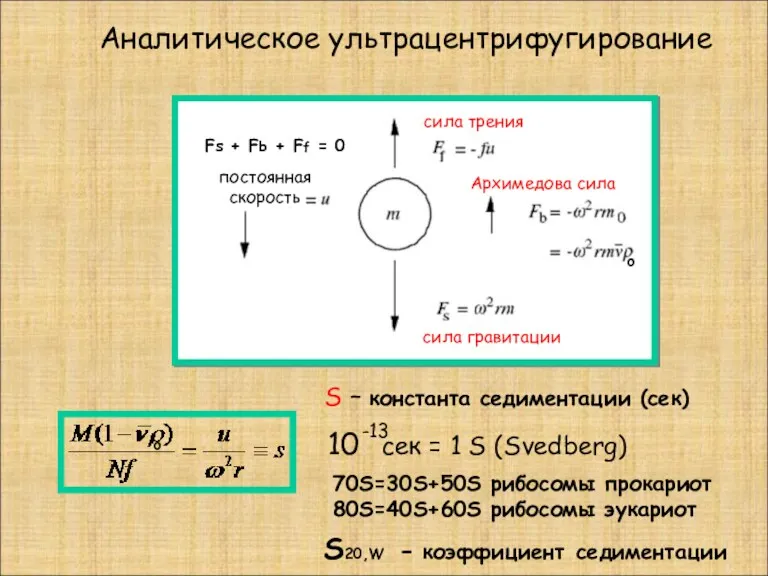
- 15. Аналитическое ультрацентрифугирование S – константа седиментации (сек) 10 сек = 1 S (Svedberg) -13 постоянная скорость
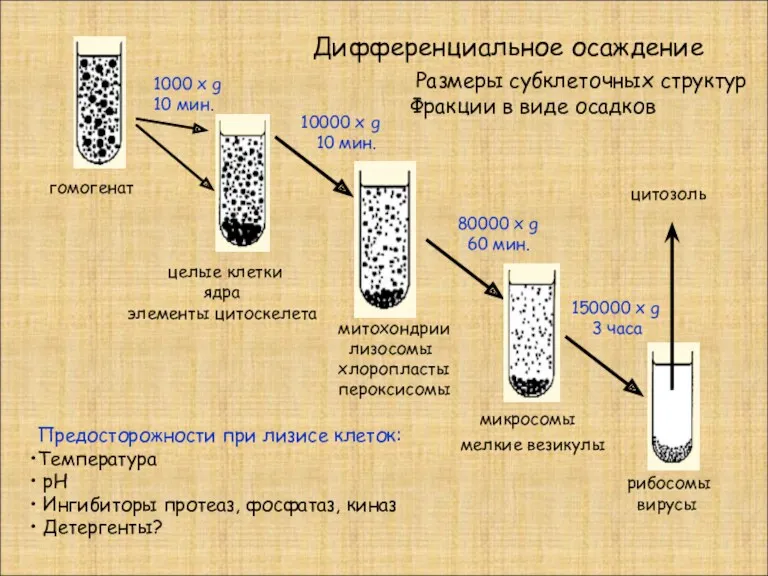
- 16. Дифференциальное осаждение гомогенат целые клетки ядра элементы цитоскелета митохондрии лизосомы хлоропласты пероксисомы микросомы мелкие везикулы рибосомы
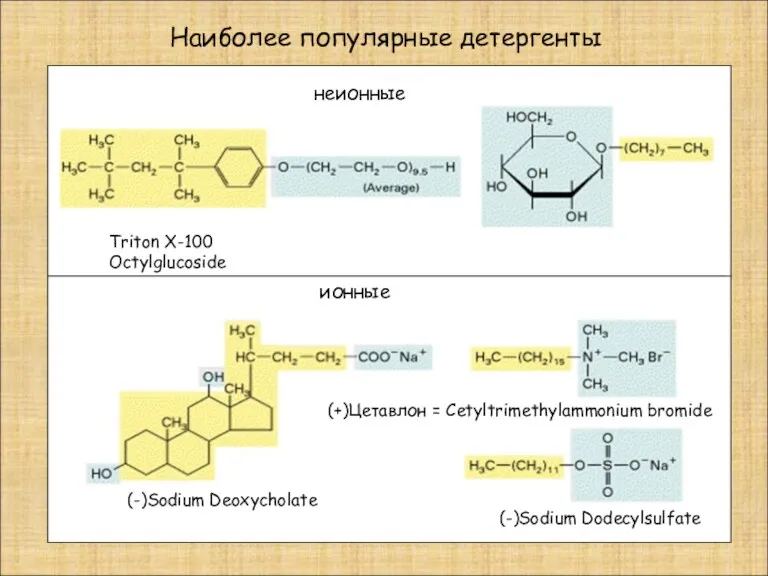
- 17. Наиболее популярные детергенты неионные ионные Triton X-100 Octylglucoside (-)Sodium Deoxycholate (-)Sodium Dodecylsulfate (+)Цетавлон = Cetyltrimethylammonium bromide
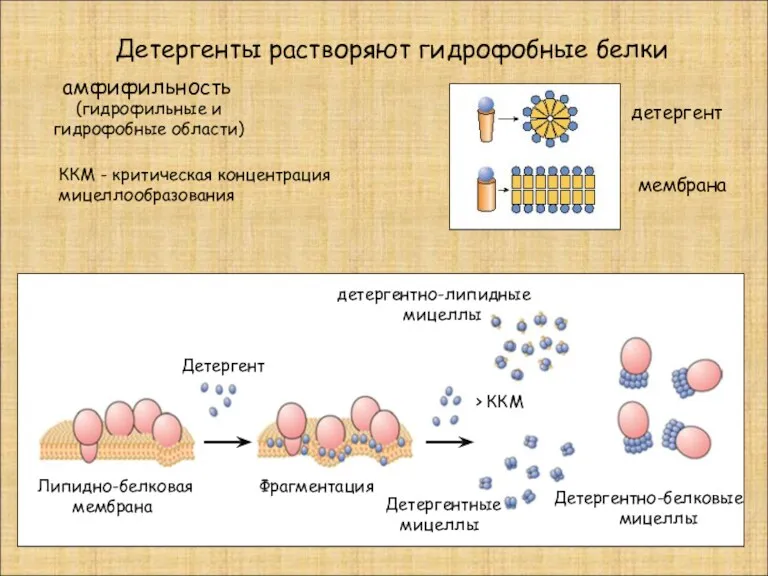
- 18. Детергенты растворяют гидрофобные белки детергентно-липидные мицеллы Детергент Детергентно-белковые мицеллы Детергентные мицеллы Фрагментация Липидно-белковая мембрана ККМ -
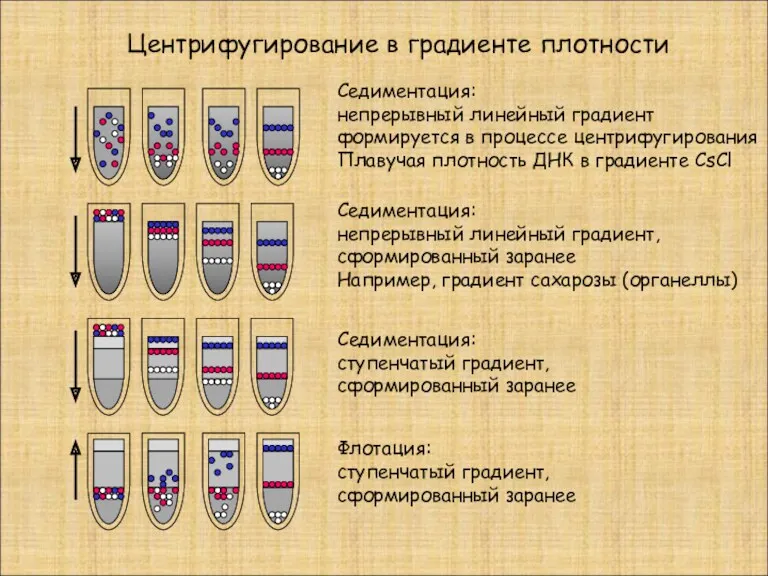
- 19. Центрифугирование в градиенте плотности Седиментация: непрерывный линейный градиент формируется в процессе центрифугирования Плавучая плотность ДНК в
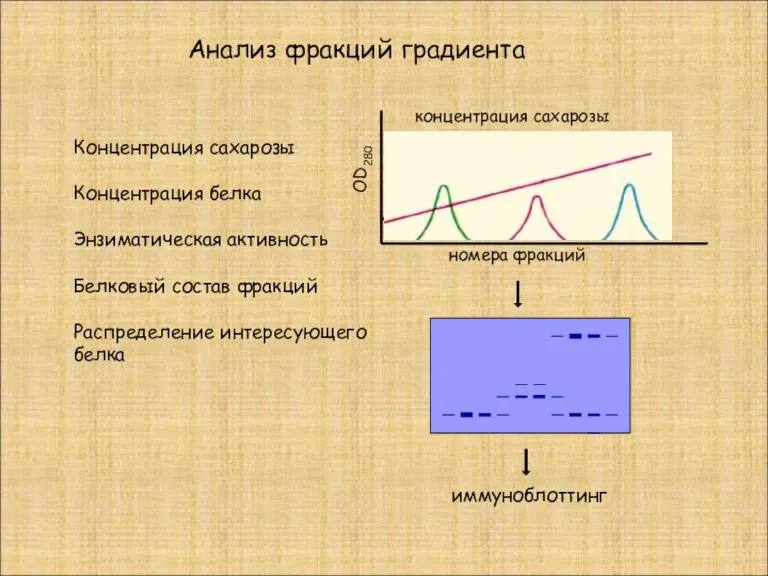
- 20. Анализ фракций градиента номера фракций OD280 концентрация сахарозы Концентрация сахарозы Концентрация белка Энзиматическая активность Белковый состав
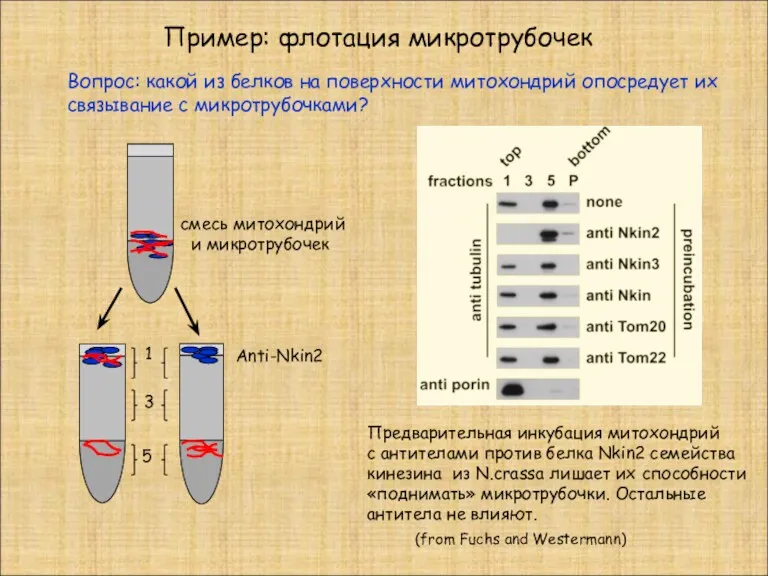
- 21. Пример: флотация микротрубочек (from Fuchs and Westermann) 1 3 5 смесь митохондрий и микротрубочек Anti-Nkin2 Предварительная
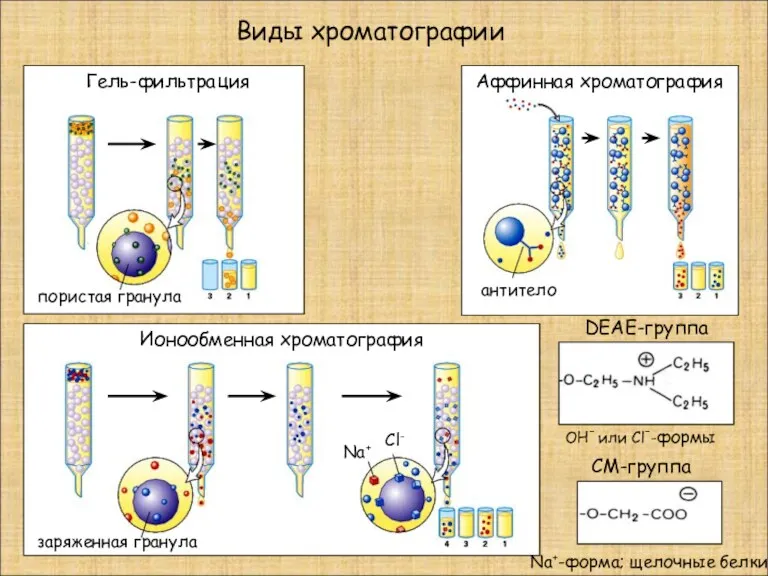
- 22. Гель-фильтрация Аффинная хроматография Ионообменная хроматография Виды хроматографии антитело пористая гранула заряженная гранула Na+ Cl- DEAE-группа CM-группа
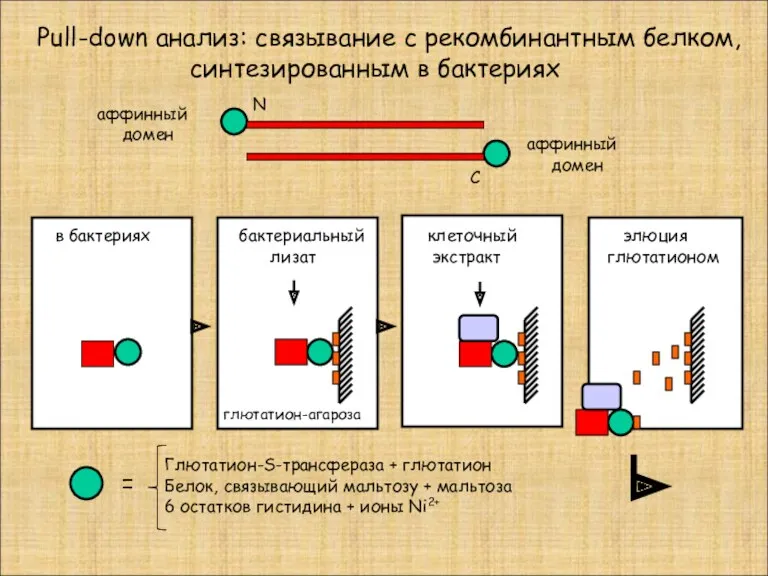
- 23. Pull-down анализ: связывание с рекомбинантным белком, синтезированным в бактериях в бактериях аффинный домен аффинный домен N
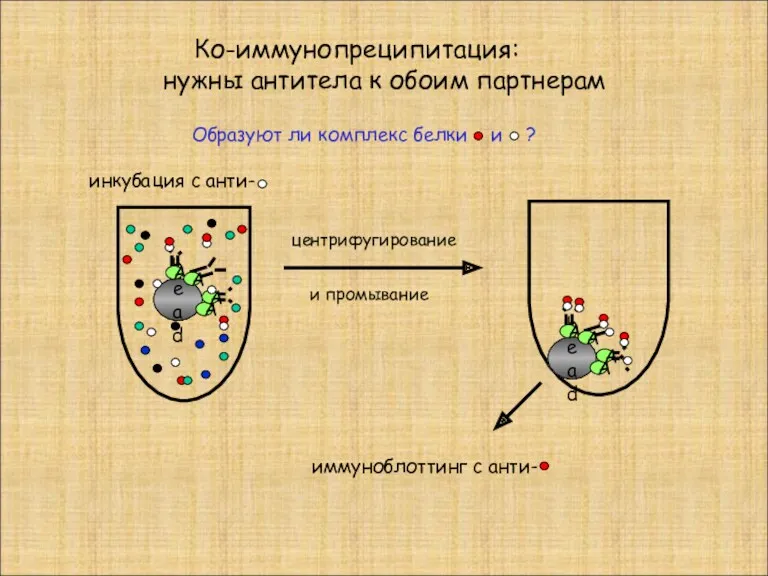
- 24. Ко-иммунопреципитация: нужны антитела к обоим партнерам bead А А А А центрифугирование и промывание bead А
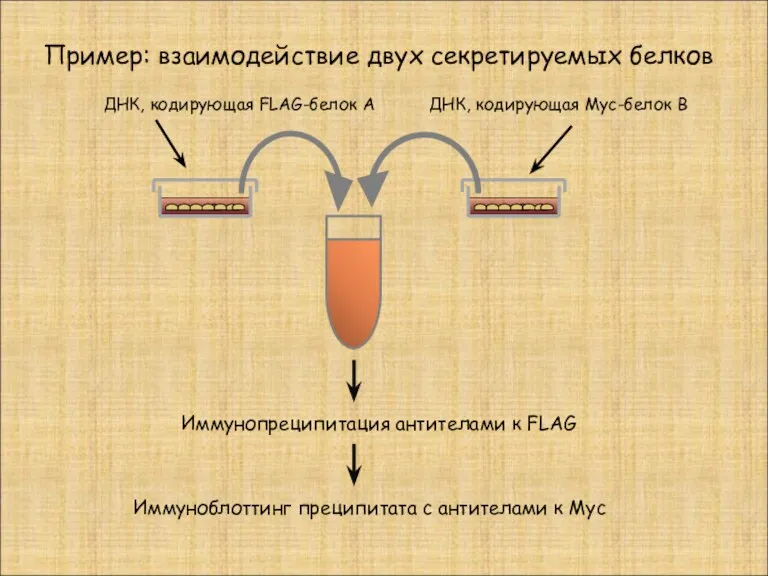
- 25. Пример: взаимодействие двух секретируемых белков ДНК, кодирующая FLAG-белок А ДНК, кодирующая Myc-белок В Иммунопреципитация антителами к
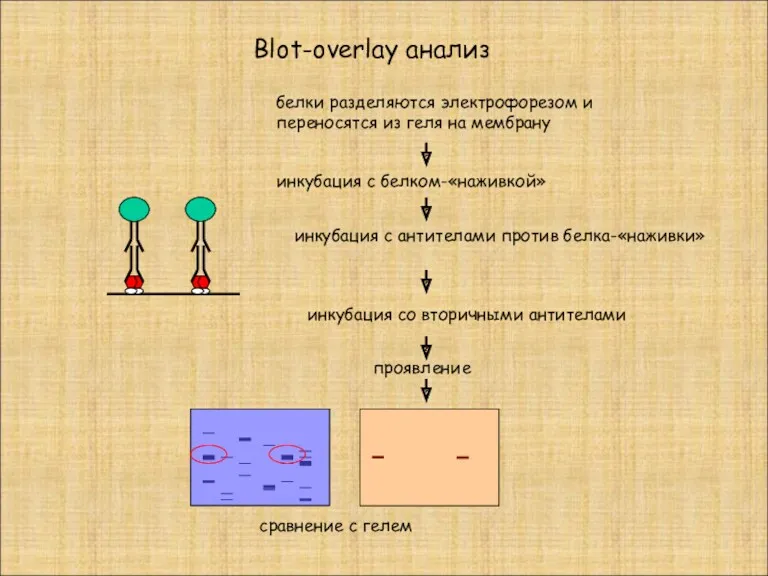
- 26. белки разделяются электрофорезом и переносятся из геля на мембрану инкубация с белком-«наживкой» инкубация с антителами против
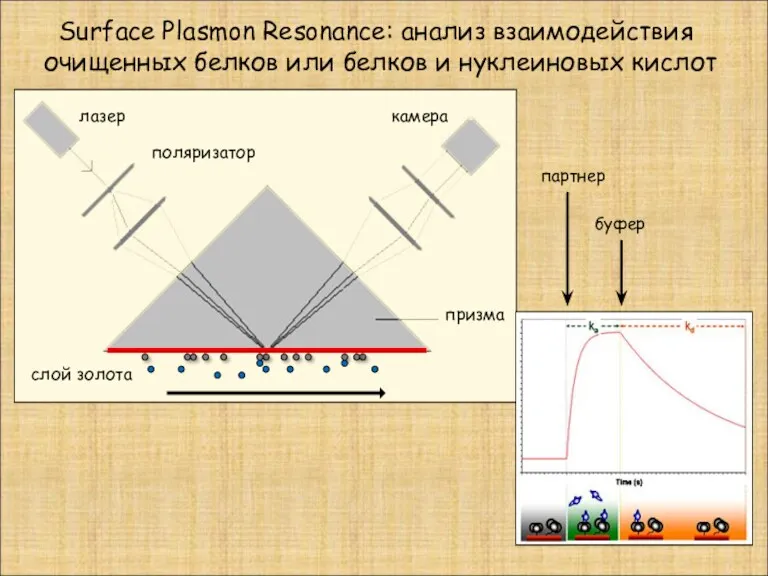
- 27. Surface Plasmon Resonance: анализ взаимодействия очищенных белков или белков и нуклеиновых кислот призма лазер камера поляризатор
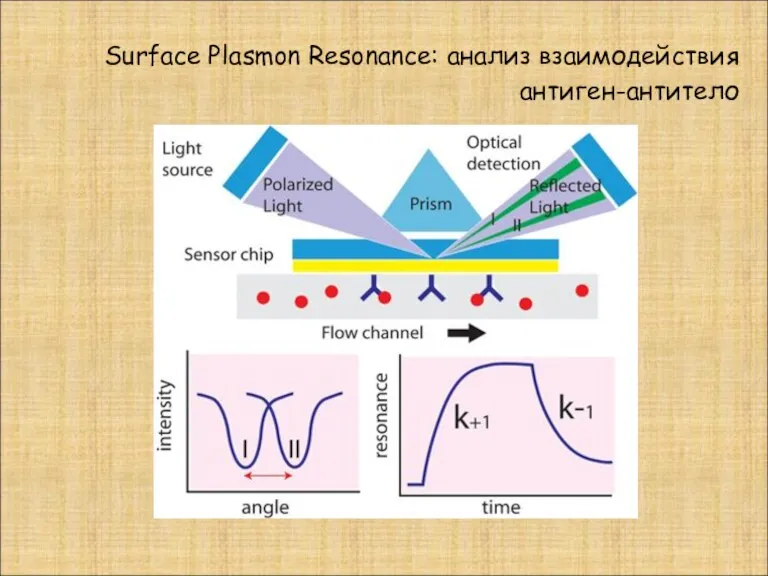
- 28. Surface Plasmon Resonance: анализ взаимодействия антиген-антитело
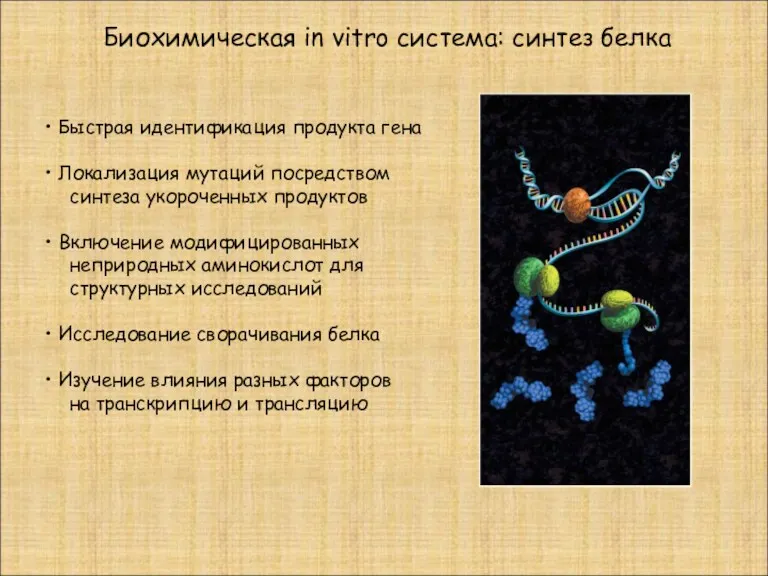
- 29. Быстрая идентификация продукта гена Локализация мутаций посредством синтеза укороченных продуктов Включение модифицированных неприродных аминокислот для структурных
- 30. Обычно используемые системы 1. Экстракт ретикулоцитов кролика. Ретикулоцит – предшественник эритроцита, он уже не имеет ядра.
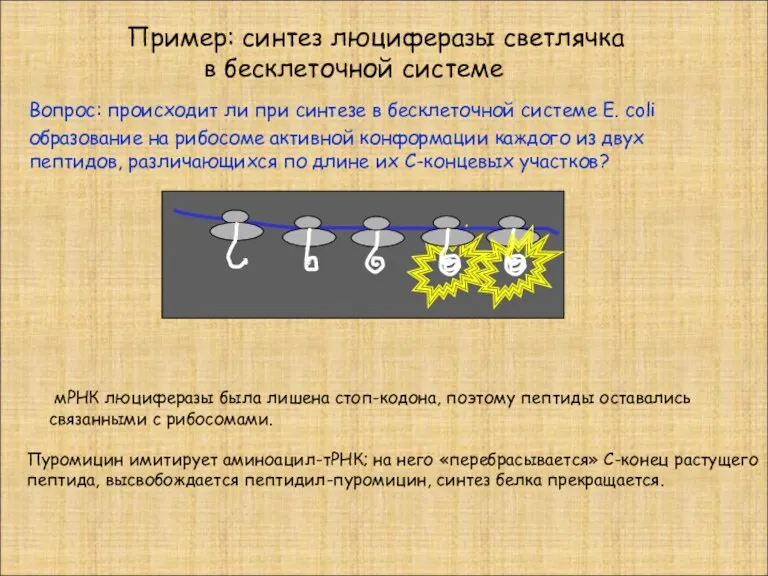
- 31. Пример: синтез люциферазы светлячка в бесклеточной системе Вопрос: происходит ли при синтезе в бесклеточной системе E.
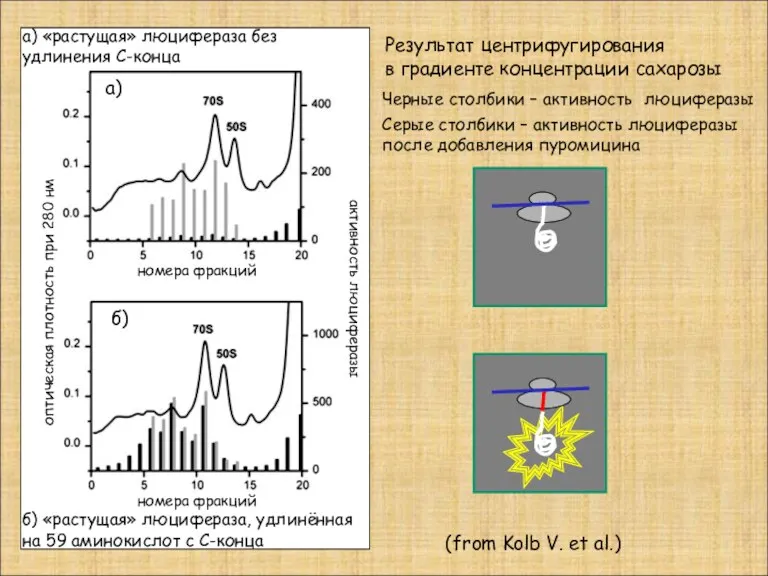
- 32. Черные столбики – активность люциферазы Серые столбики – активность люциферазы после добавления пуромицина (from Kolb V.
- 33. Лекция 7 Взаимодействия in vivo
- 34. Электрофорез в неденатурирующих условиях Химическая сшивка Иммунопреципитация хроматина Колокализация в клетке Pull-down из клеточного лизата Дигибридная
- 35. Электрофорез белков в неденатурирующих условиях 1. Получение белка в очищенном нативном виде 2. Определение свойств выделенного
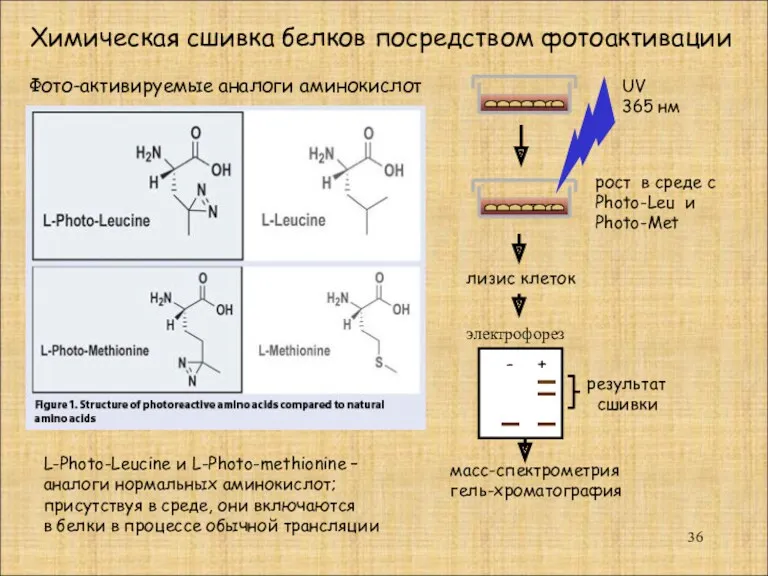
- 36. Фото-активируемые аналоги аминокислот L-Photo-Leucine и L-Photo-methionine – аналоги нормальных аминокислот; присутствуя в среде, они включаются в
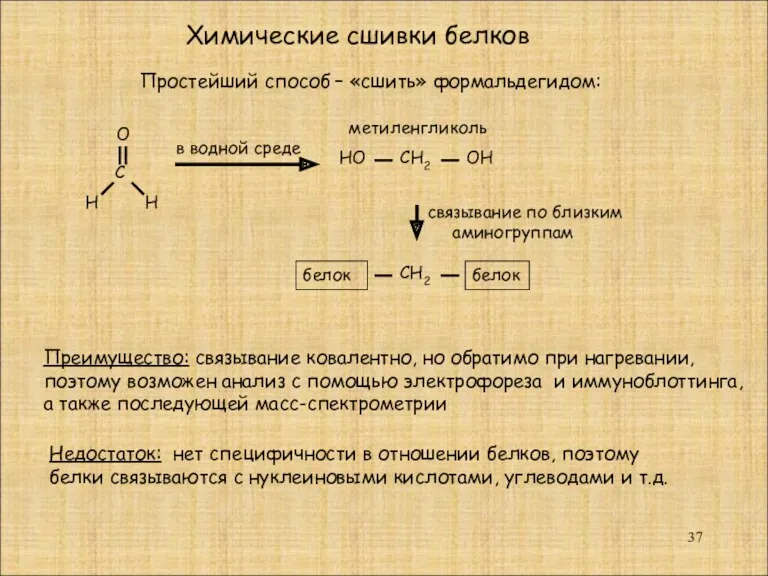
- 37. Химические сшивки белков С О Н Н Простейший способ – «сшить» формальдегидом: в водной среде НО
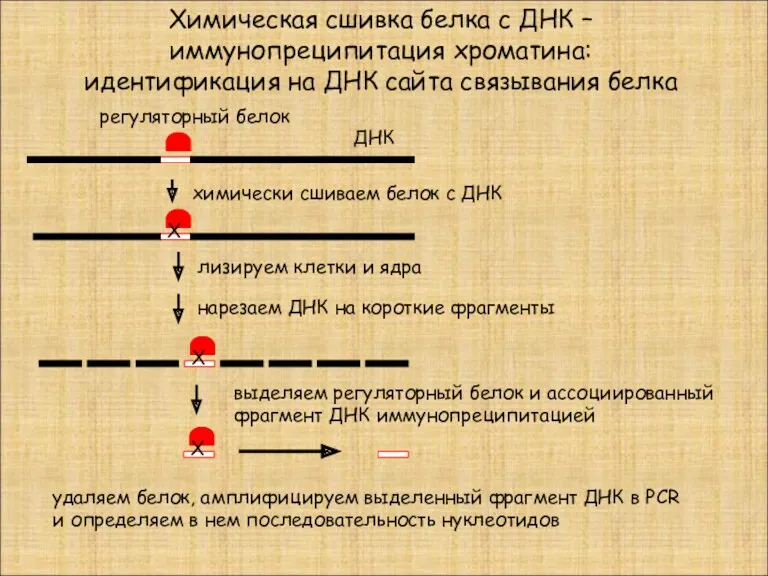
- 38. Химическая сшивка белка с ДНК – иммунопреципитация хроматина: идентификация на ДНК сайта связывания белка Х химически
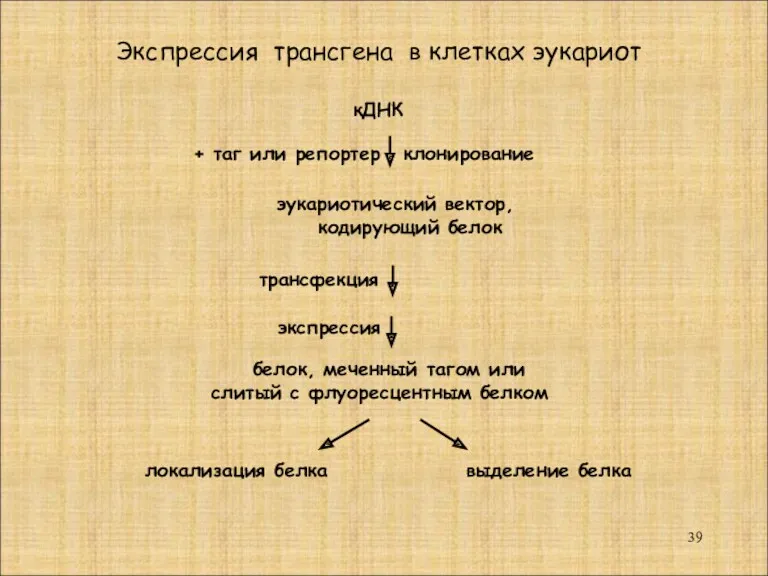
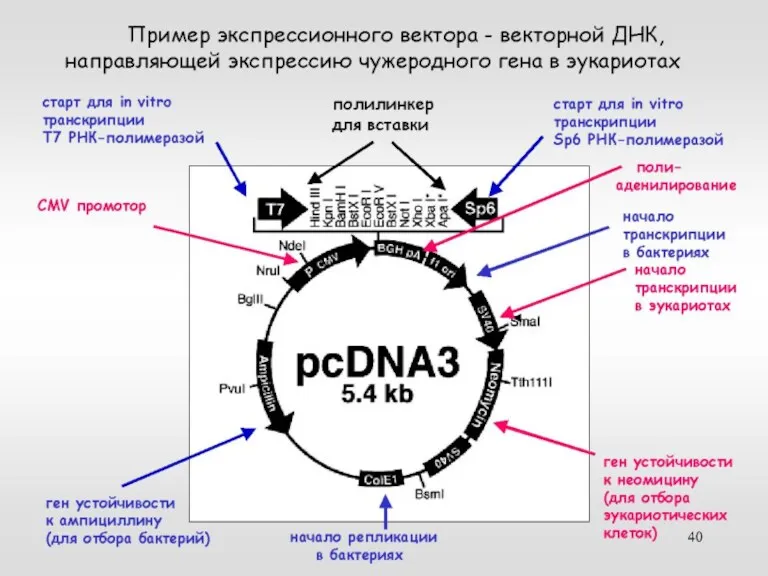
- 39. кДНК эукариотический вектор, кодирующий белок + таг или репортер клонирование экспрессия Экспрессия трансгена в клетках эукариот
- 41. Доставка крупных молекул в клетки Микроинъекция: ДНК, мРНК, белок Липосомная трансфекция: ДНК, мРНК Са-фосфатная трансфекция: ДНК
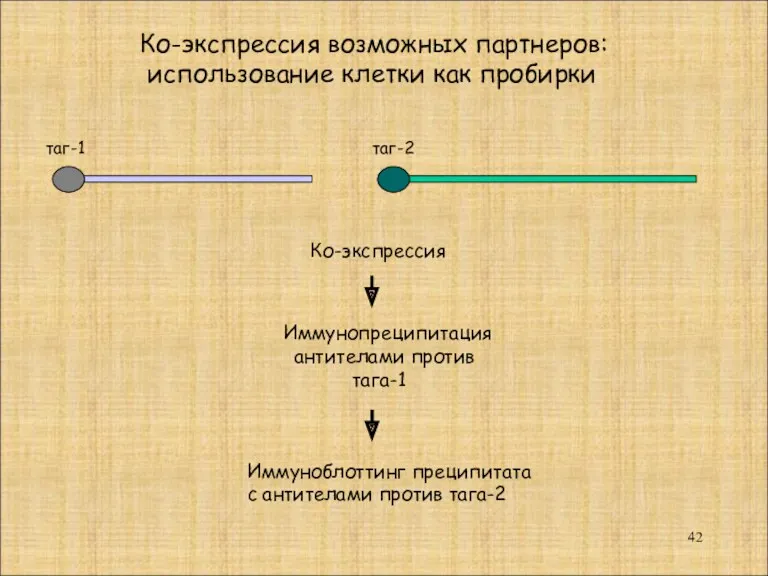
- 42. таг-1 таг-2 Ко-экспрессия Иммунопреципитация антителами против тага-1 Иммуноблоттинг преципитата с антителами против тага-2 Ко-экспрессия возможных партнеров:
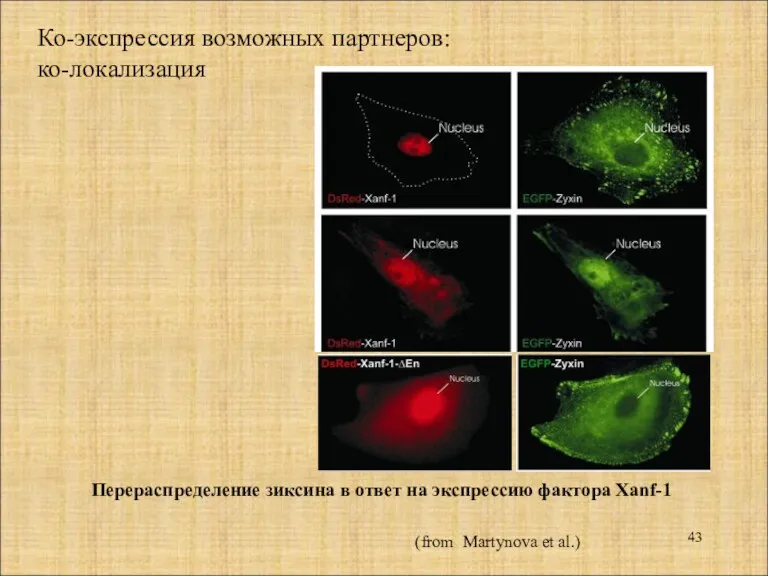
- 43. Ко-экспрессия возможных партнеров: ко-локализация Перераспределение зиксина в ответ на экспрессию фактора Xanf-1 (from Martynova et al.)
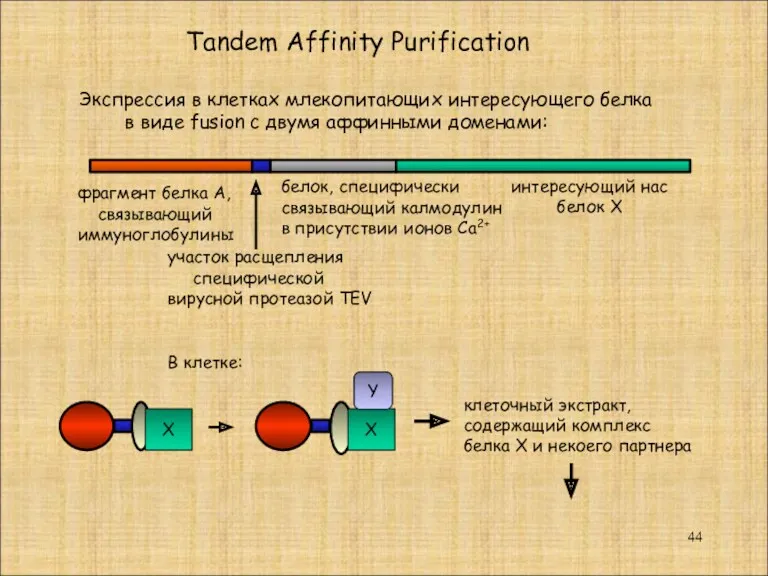
- 44. фрагмент белка А, связывающий иммуноглобулины белок, специфически связывающий калмодулин в присутствии ионов Са2+ В клетке: клеточный
- 46. Скачать презентацию







 Репликация. Эукариоты. Часть 2
Репликация. Эукариоты. Часть 2 Тип Хордовые. Бесчерепные. Ланцетник
Тип Хордовые. Бесчерепные. Ланцетник Механика и энергетика мышц
Механика и энергетика мышц Система опоры и движения. Опорно-двигательная система ОДС
Система опоры и движения. Опорно-двигательная система ОДС Обмен веществ и превращение энергии
Обмен веществ и превращение энергии Витамин B1
Витамин B1 Биотехнология: достижения и перспективы развития
Биотехнология: достижения и перспективы развития Обонятельный и вкусовой анализаторы
Обонятельный и вкусовой анализаторы Питание клетки.Фотосинтез.
Питание клетки.Фотосинтез. Соединительная ткань
Соединительная ткань Эволюция. Развитие представлений о возникновении жизни на Земле (часть 1)
Эволюция. Развитие представлений о возникновении жизни на Земле (часть 1) Естественный отбор – главная движущая сила эволюции
Естественный отбор – главная движущая сила эволюции Рисовая косметика
Рисовая косметика Краснокнижные виды растений и животных РТ
Краснокнижные виды растений и животных РТ Флокуляційне очищення питної води за допомогою катіонних та аніонних флокулянтів
Флокуляційне очищення питної води за допомогою катіонних та аніонних флокулянтів Транскрипция. Биосинтез белка
Транскрипция. Биосинтез белка Клетки и их разнообразие в многоклеточном организме
Клетки и их разнообразие в многоклеточном организме Охрана растений. Красная книга Архангельской области
Охрана растений. Красная книга Архангельской области Группы крови. Резус-фактор
Группы крови. Резус-фактор Липиды - сложные эфиры высших карбоновых кислот и ряда спиртов
Липиды - сложные эфиры высших карбоновых кислот и ряда спиртов Презентация Моллюски
Презентация Моллюски Пищевые цепи
Пищевые цепи Анатомия, физиология и методы исследования органа зрения
Анатомия, физиология и методы исследования органа зрения Проектно-исследовательская деятельность в условиях внедрения ФГОС ООО
Проектно-исследовательская деятельность в условиях внедрения ФГОС ООО Презентации к уроку по теме: Иммунитет
Презентации к уроку по теме: Иммунитет Отряды млекопитающих
Отряды млекопитающих Физиология прокариот
Физиология прокариот Вегетативное размножение растения
Вегетативное размножение растения