Содержание
- 2. Литература Овчинников Ю.А. Биоорганическая химия – М.: Просвещение, 1987. Молекулярная биология. Структура и функции белков. /
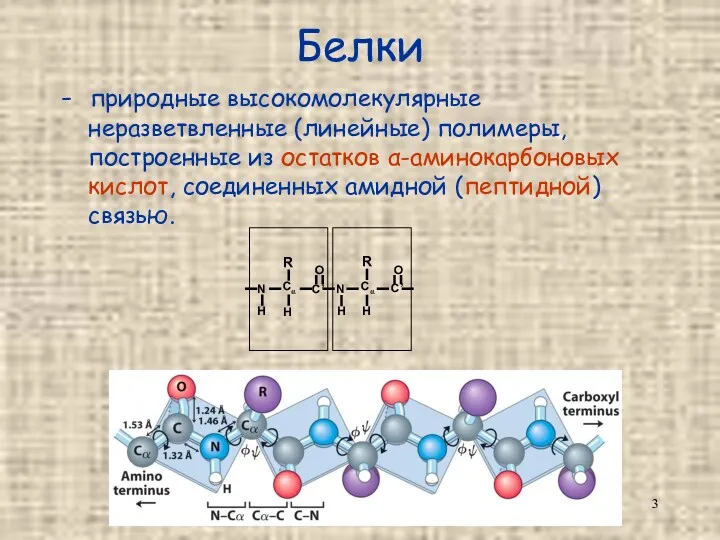
- 3. Белки - природные высокомолекулярные неразветвленные (линейные) полимеры, построенные из остатков α-аминокарбоновых кислот, соединенных амидной (пептидной) связью.
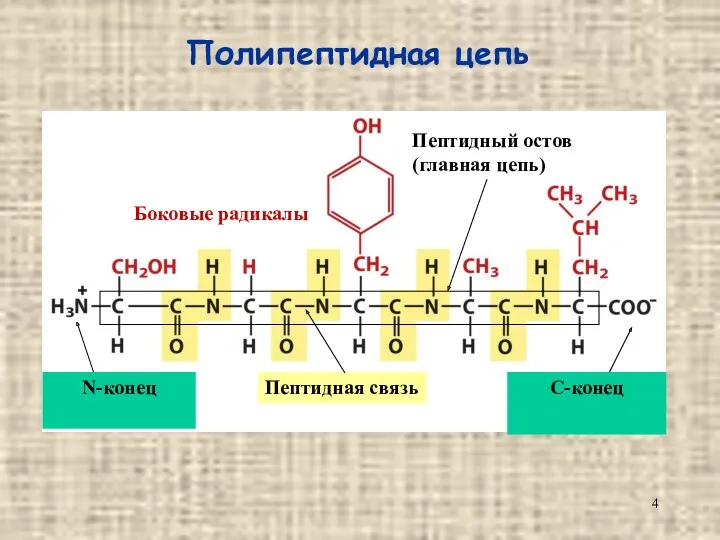
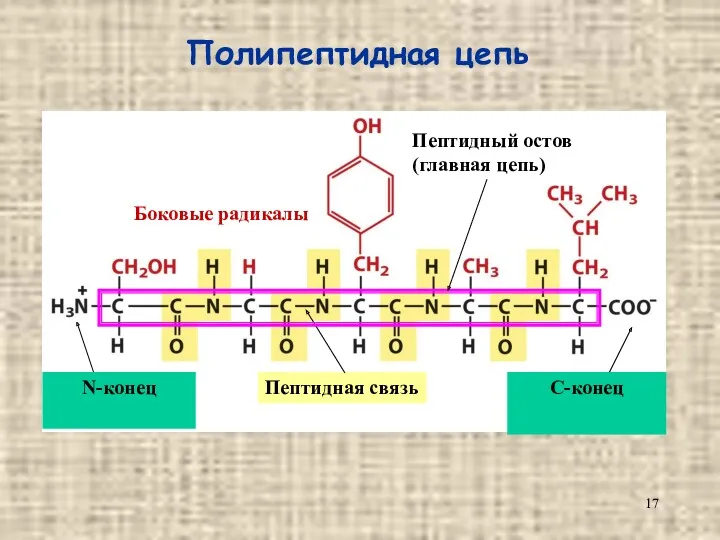
- 4. Полипептидная цепь N-конец C-конец Пептидная связь Боковые радикалы Пептидный остов (главная цепь)
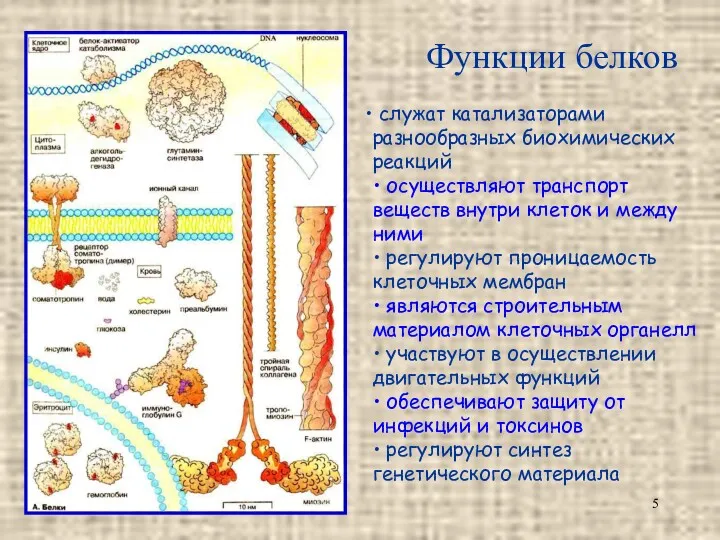
- 5. Функции белков служат катализаторами разнообразных биохимических реакций • осуществляют транспорт веществ внутри клеток и между ними
- 6. ПРОТЕОМ – полный набор белков, который данный организм может синтезировать
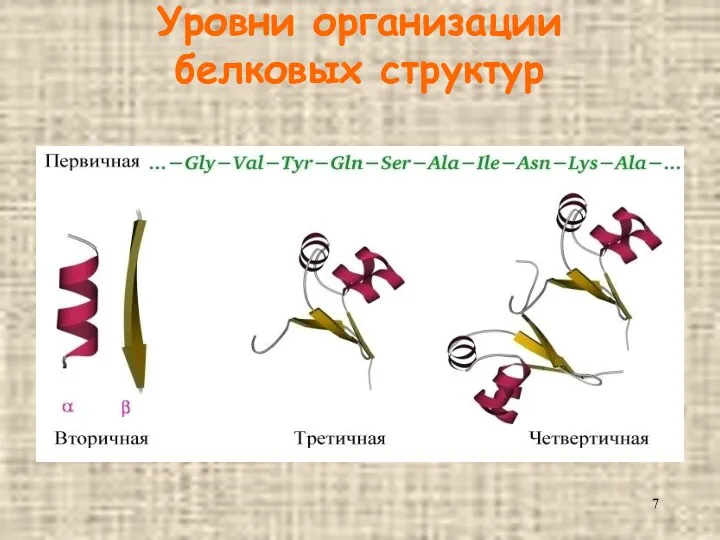
- 7. Уровни организации белковых структур
- 8. Иерархия белковых структур Последовательность аминокислот α-спирали, β-слои, петли Мотивы Домены Многодоменный белок Белок, состоящий из нескольких
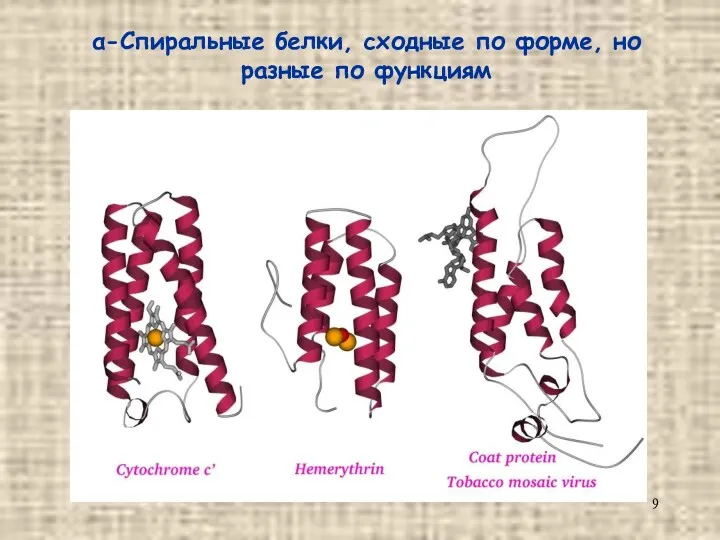
- 9. α-Спиральные белки, сходные по форме, но разные по функциям
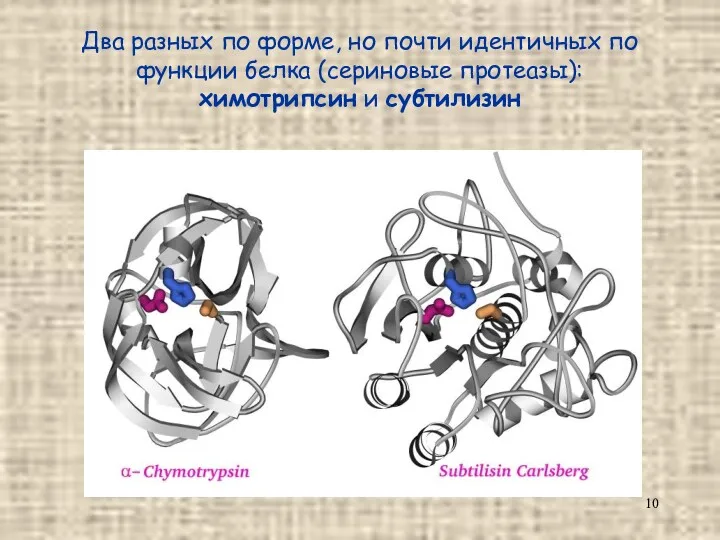
- 10. Два разных по форме, но почти идентичных по функции белка (сериновые протеазы): химотрипсин и субтилизин
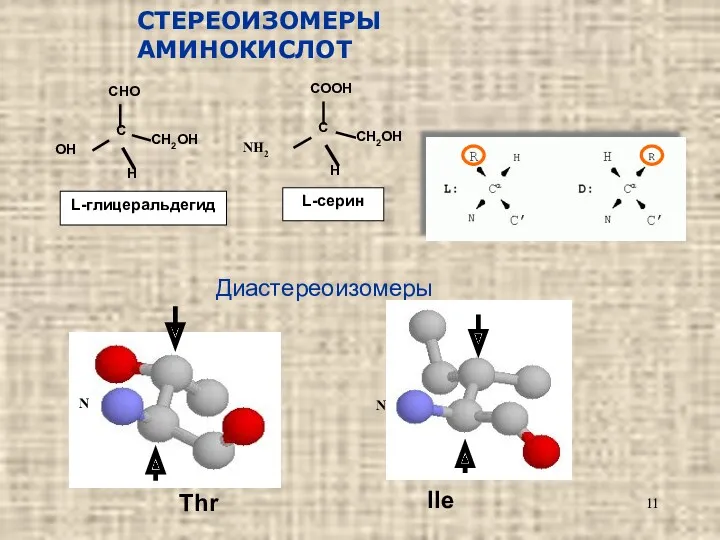
- 11. СТЕРЕОИЗОМЕРЫ АМИНОКИСЛОТ Диастереоизомеры Thr Ile
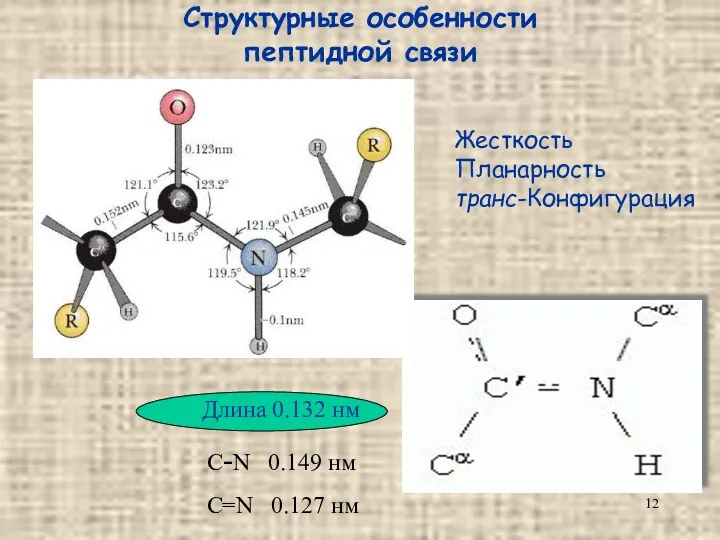
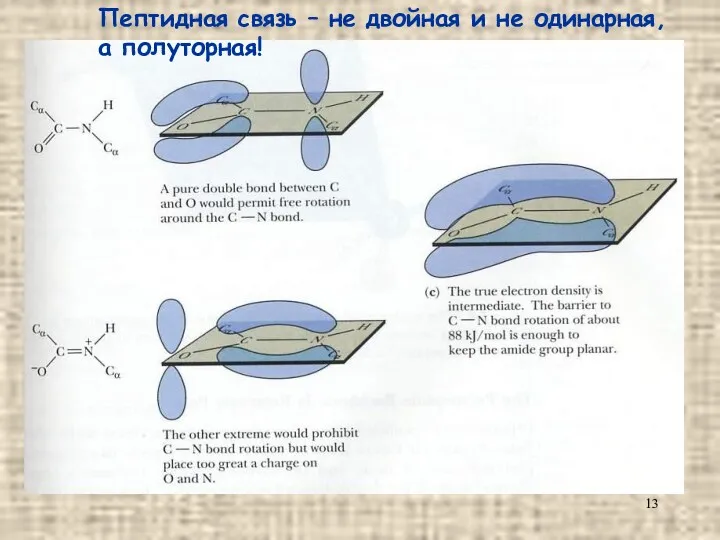
- 12. Структурные особенности пептидной связи С-N 0.149 нм С=N 0.127 нм Жесткость Планарность транс-Конфигурация
- 13. Пептидная связь – не двойная и не одинарная, а полуторная!
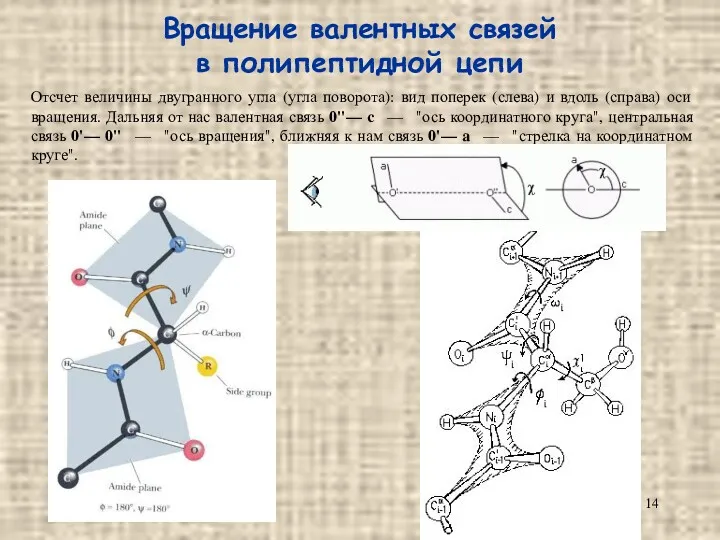
- 14. Вращение валентных связей в полипептидной цепи Отсчет величины двугранного угла (угла поворота): вид поперек (слева) и
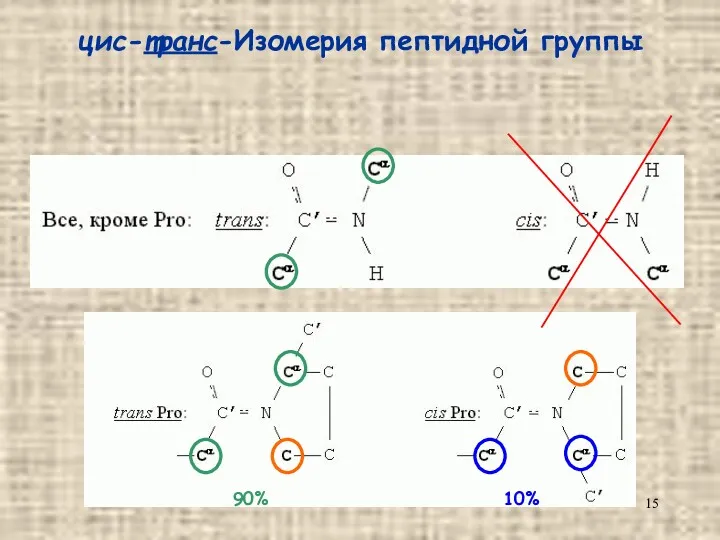
- 15. цис-транс-Изомерия пептидной группы 90% 10%
- 16. Вторичная структура белков Вторичной структурой называют пространственное расположение атомов главной цепи молекулы белка на отдельных, более
- 17. Полипептидная цепь N-конец C-конец Пептидная связь Боковые радикалы Пептидный остов (главная цепь)
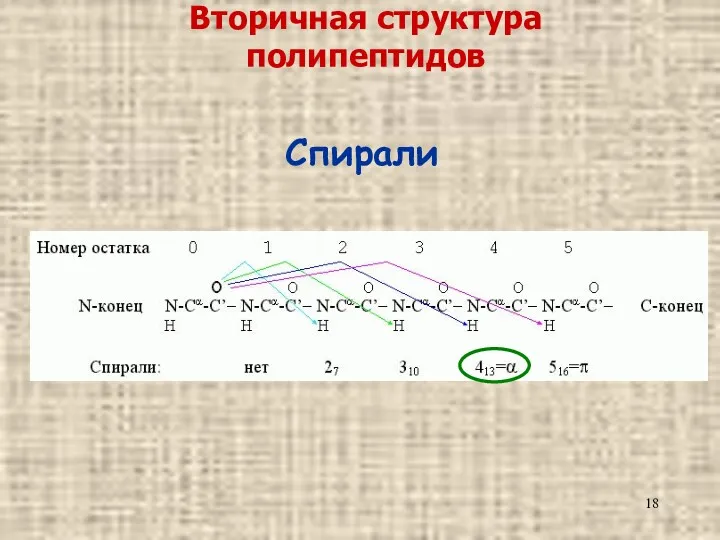
- 18. Вторичная структура полипептидов Спирали
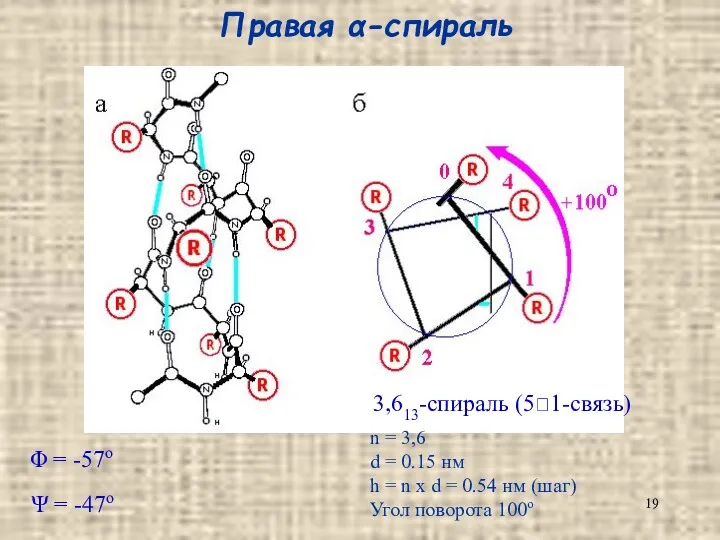
- 19. Правая α-спираль 3,613-спираль (5?1-связь) n = 3,6 d = 0.15 нм h = n x d
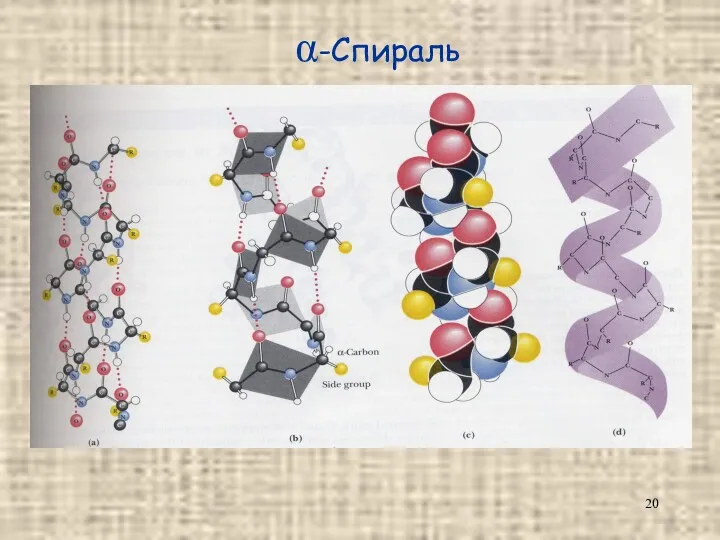
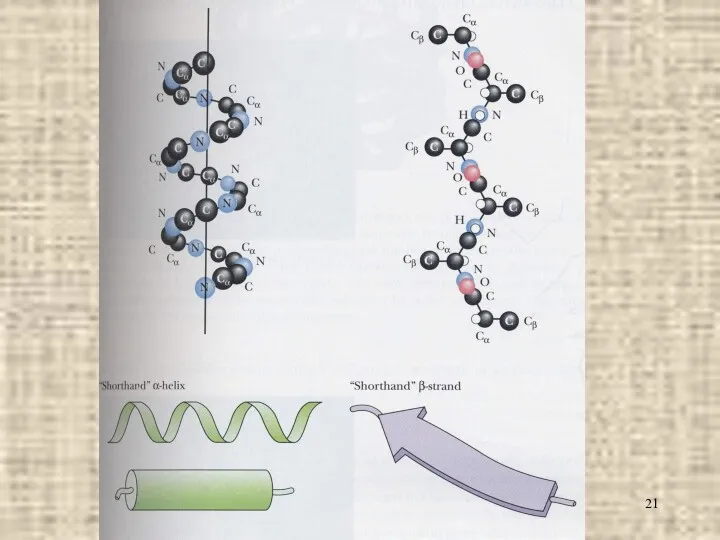
- 20. α-Спираль
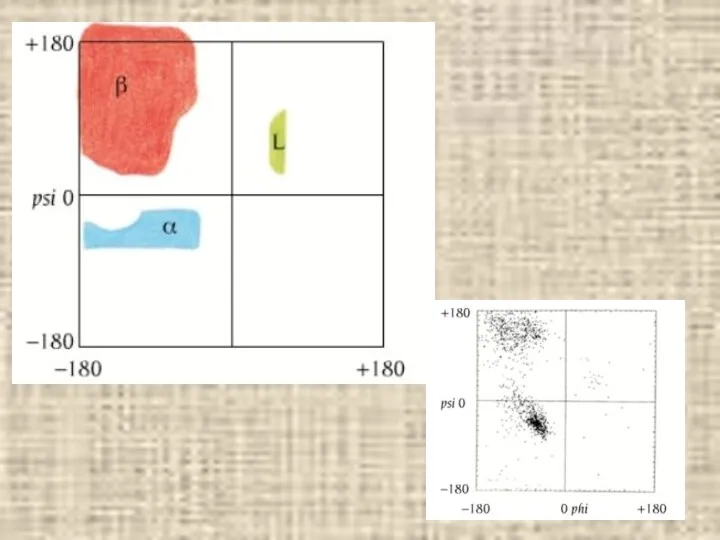
- 22. Конформационные карты Рамачандрана Конформации различных вторичных структур на фоне карты разрешенных и запрещенных конформаций аминокислотных остатков.
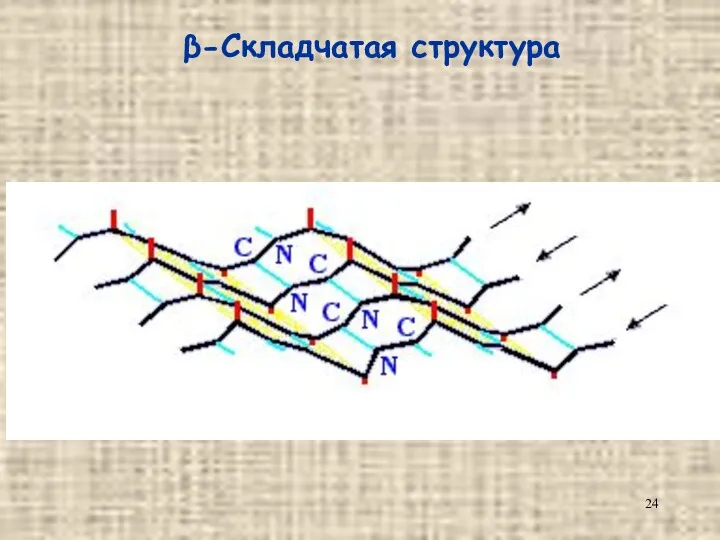
- 24. β-Складчатая структура
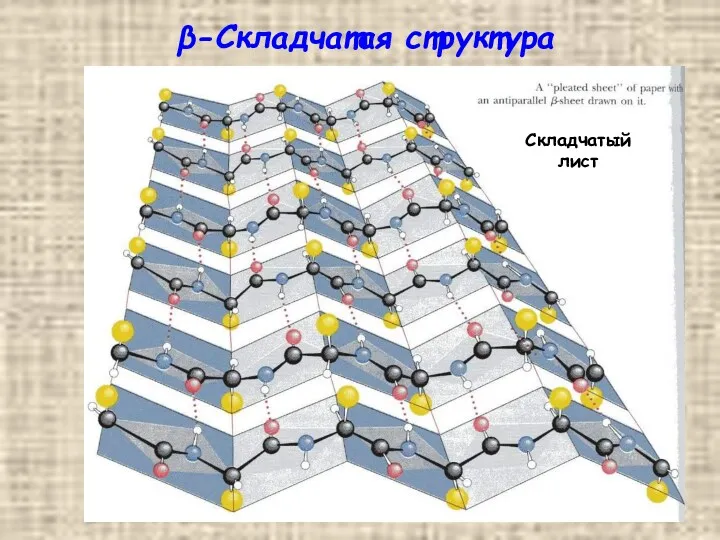
- 25. β-Складчатая структура Складчатый лист
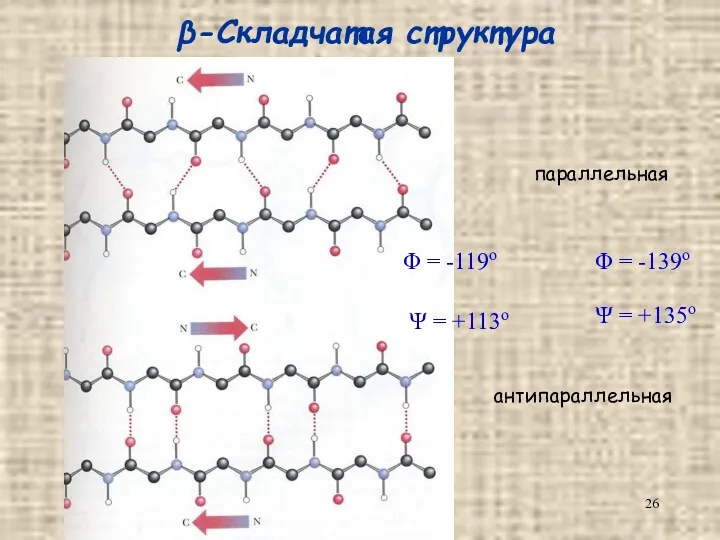
- 26. β-Складчатая структура параллельная антипараллельная
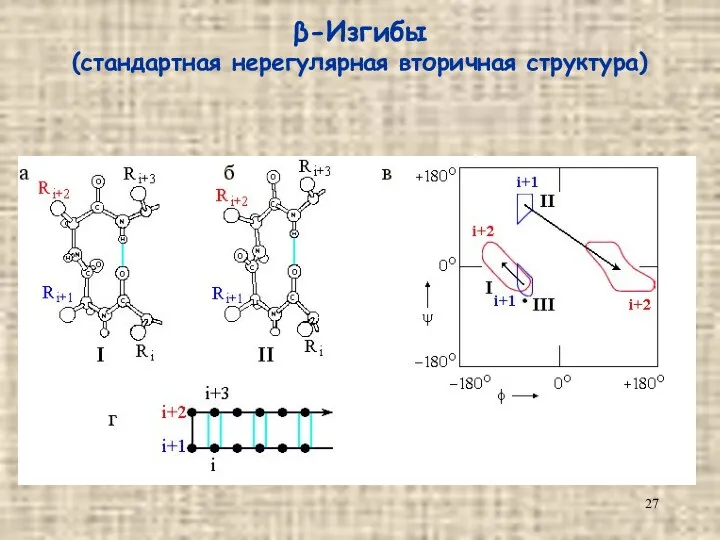
- 27. β-Изгибы (стандартная нерегулярная вторичная структура)
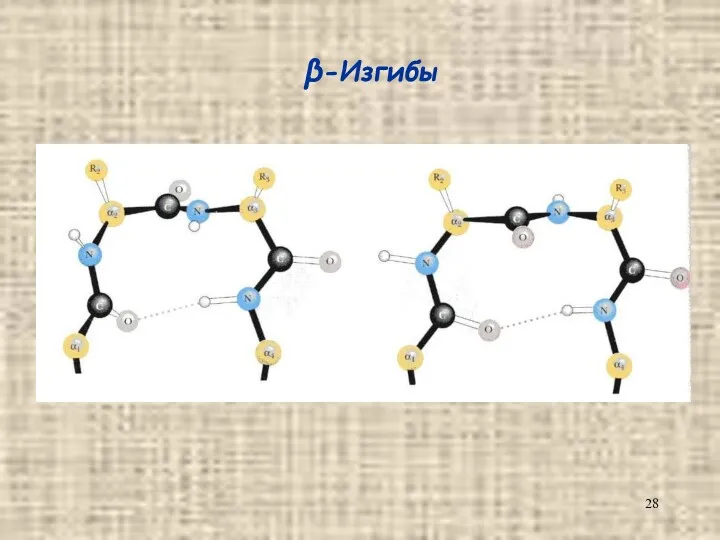
- 28. β-Изгибы
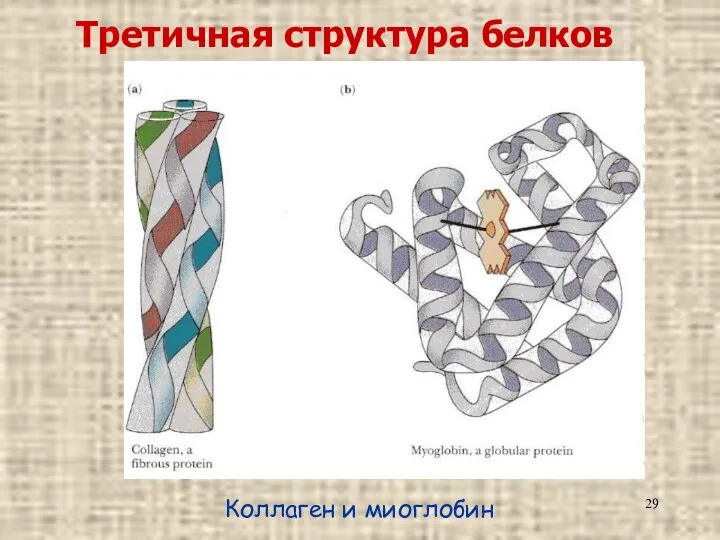
- 29. Третичная структура белков Коллаген и миоглобин
- 30. Третичная структура белков Третичной структурой называют - расположение в пространстве всех атомов молекулы белка. - свойственный
- 31. Вторичная структура
- 32. Третичная структура зависит от всей суммы взаимодействий в белковой глобуле: Ван-дер-Ваальсовы взаимодействия Водородные связи Гидрофобные взаимодействия
- 33. Доменная структура белков Начиная примерно с мол. массы 14-16 кДа прослеживается тенденция к формированию белковой молекулы
- 34. Что такое домен? Домен – это часть полипептидной цепи (или вся цепочка) , которая сворачивается независимо
- 35. Глобулярные домены в γ-кристаллине Классификация типов глобулярных белковых структур («чистые» β-белки, «чистые» α-белки, и «смешанные» α/β
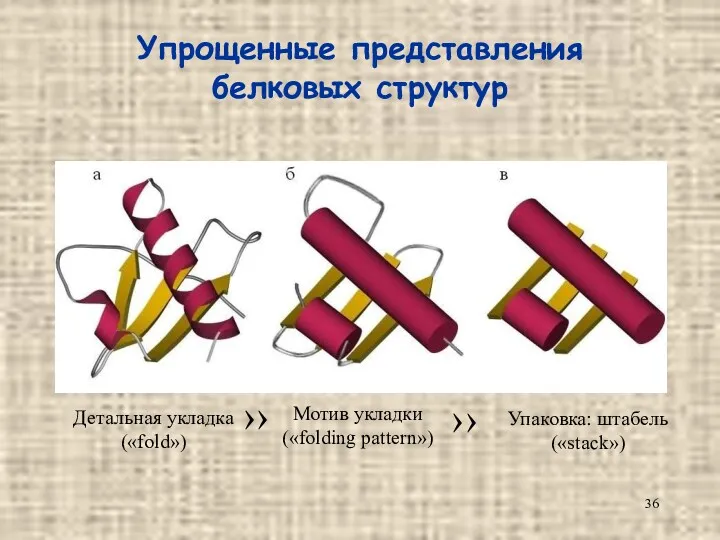
- 36. Упрощенные представления белковых структур Детальная укладка («fold») Мотив укладки («folding pattern») Упаковка: штабель («stack») ›› ››
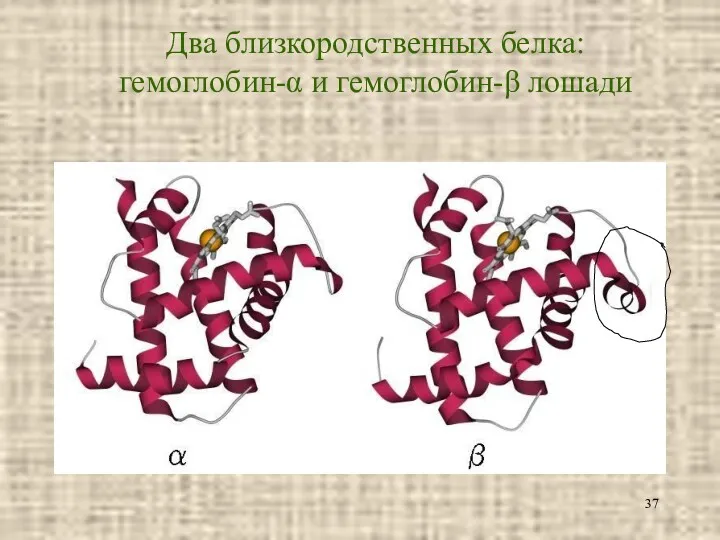
- 37. Два близкородственных белка: гемоглобин-α и гемоглобин-β лошади
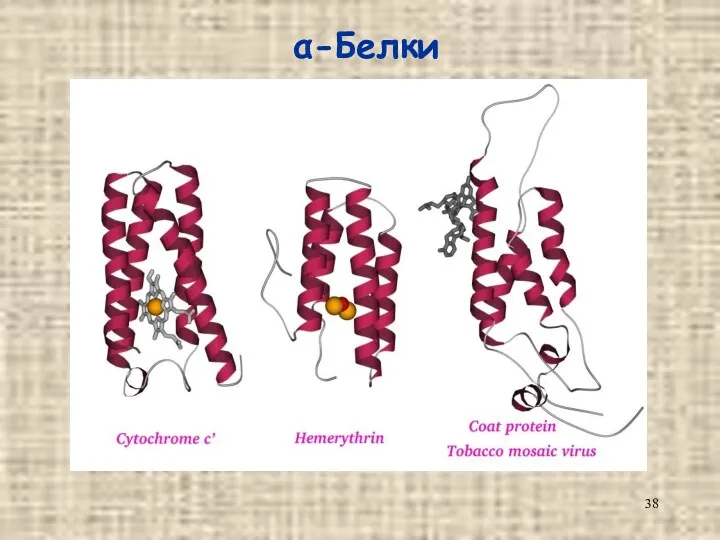
- 38. α-Белки
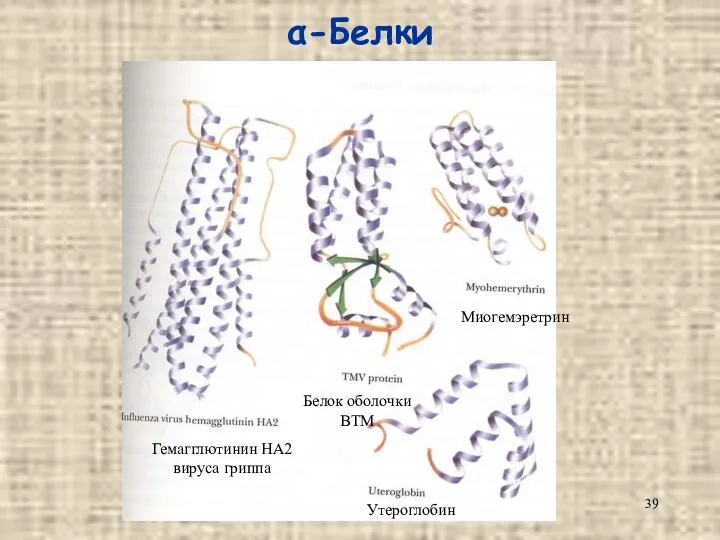
- 39. α-Белки Гемагглютинин HA2 вируса гриппа Белок оболочки ВТМ Миогемэретрин Утероглобин
- 40. β-Белки Ингибитор субтилизина из Streptomyces Домен 2 глицеральдегид- дегидрогеназы Р Домен 3 глутатион-редуктазы
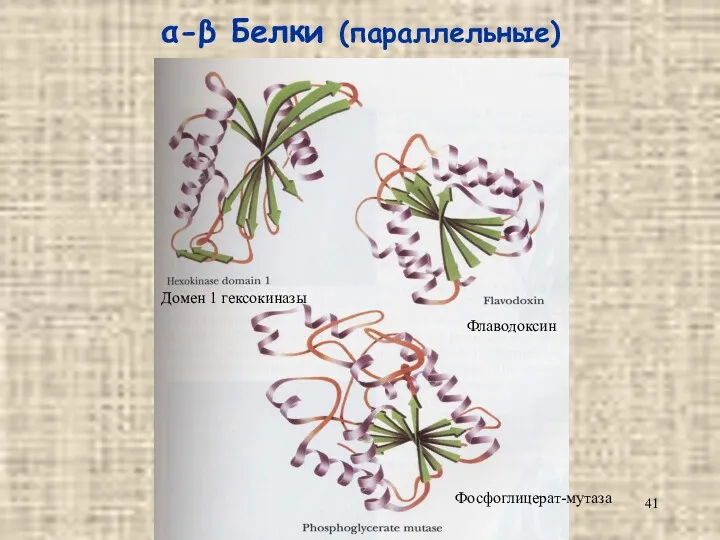
- 41. α-β Белки (параллельные) Домен 1 гексокиназы Флаводоксин Фосфоглицерат-мутаза
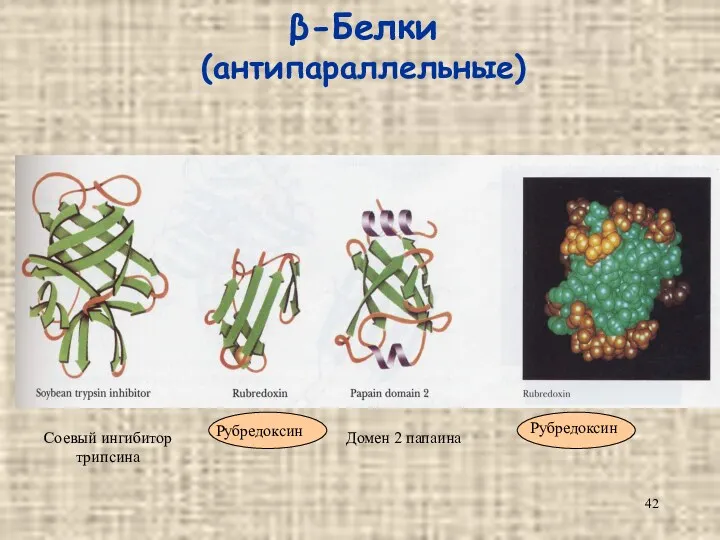
- 42. β-Белки (антипараллельные) Соевый ингибитор трипсина Рубредоксин Домен 2 папаина Рубредоксин
- 43. α/β-Белки Триозофосфат-изомераза (вид сбоку) Пируват-киназа Триозофосфат-изомераза (вид сверху)
- 44. Гемоглобин – белок с четвертичной структурой
- 46. Четвертичная структура белков
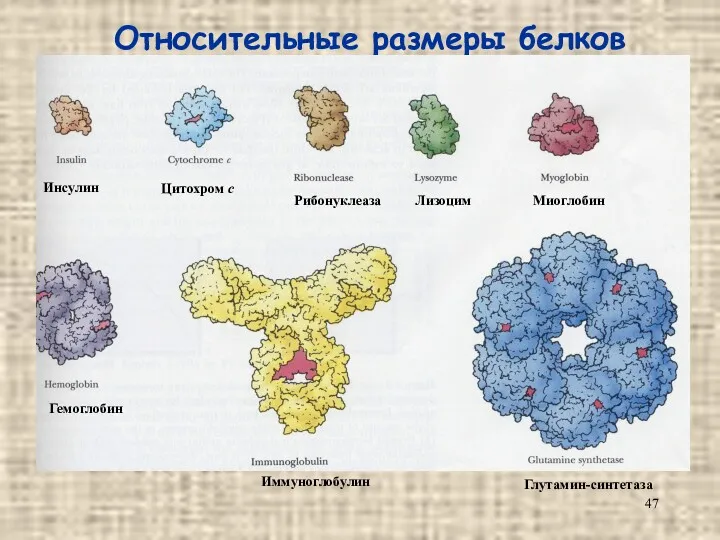
- 47. Относительные размеры белков Инсулин Глутамин-синтетаза Иммуноглобулин Гемоглобин Миоглобин Лизоцим Рибонуклеаза Цитохром с
- 49. Скачать презентацию















 Лікарські рослини - поряд
Лікарські рослини - поряд Система виділення. Механізми утворення сечі
Система виділення. Механізми утворення сечі класс двудольные семейство розоцветные
класс двудольные семейство розоцветные Презентация Лист. внешнее и внутреннее строение.
Презентация Лист. внешнее и внутреннее строение. Дерматовенерология. Анатомия, гистология, физиология кожи
Дерматовенерология. Анатомия, гистология, физиология кожи Как повысить плодородие почвы?
Как повысить плодородие почвы? Тип Плоские черви
Тип Плоские черви Красная книга Прикамья. 6 класс
Красная книга Прикамья. 6 класс Эндемики Австралии
Эндемики Австралии Тест. Человек. (Окружающий мир, 3 класс)
Тест. Человек. (Окружающий мир, 3 класс) Тіршілік құбылыстарының молекулалық негіздері туралы ғылым
Тіршілік құбылыстарының молекулалық негіздері туралы ғылым Нуклеиновые кислоты. ДНК
Нуклеиновые кислоты. ДНК Основні групи організмів: бактерії, археї
Основні групи організмів: бактерії, археї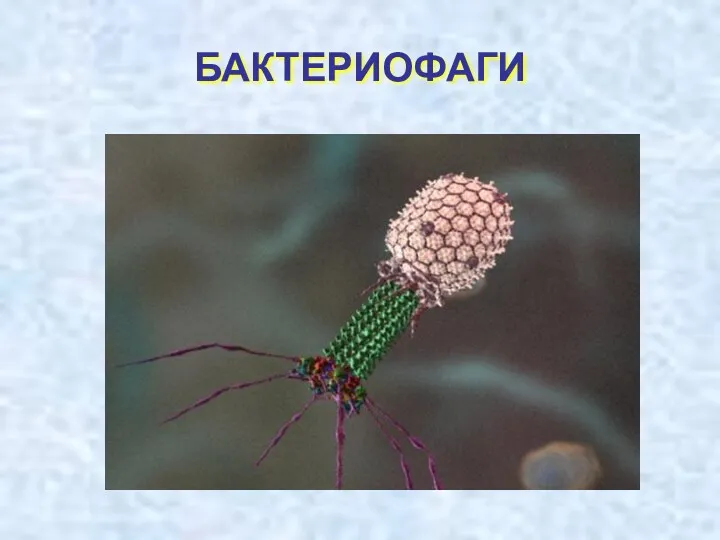 Бактериофаги. Особенности бактериофагов
Бактериофаги. Особенности бактериофагов Оборудование для культивирования микроорганизмов. Биореакторы периодического действия (лекция 2)
Оборудование для культивирования микроорганизмов. Биореакторы периодического действия (лекция 2) Вода и здоровье человека
Вода и здоровье человека Перелетные птицы
Перелетные птицы Лимбическая система
Лимбическая система Птицы Тюльганского района
Птицы Тюльганского района Своя игра. Мир растений
Своя игра. Мир растений Биологиялық мембраналар. Биологиялық мембраналар арқылы зат тасымалы
Биологиялық мембраналар. Биологиялық мембраналар арқылы зат тасымалы Задание к теме:формы естественного отбора.
Задание к теме:формы естественного отбора. Sunflower seeds
Sunflower seeds Всероссийская проверочная работа по биологии. 5 класс, 3 вариант
Всероссийская проверочная работа по биологии. 5 класс, 3 вариант Ферментология, как наука
Ферментология, как наука Биотические связи
Биотические связи Микробы - источник белка
Микробы - источник белка Интерактивный кроссворд к теме Сенсорные системы
Интерактивный кроссворд к теме Сенсорные системы