Содержание
- 2. Уровни организации структуры белка 25.02.2013 Пространственная организация белков Первичная структура – последовательность аминокислотных остатков Вторичная структура
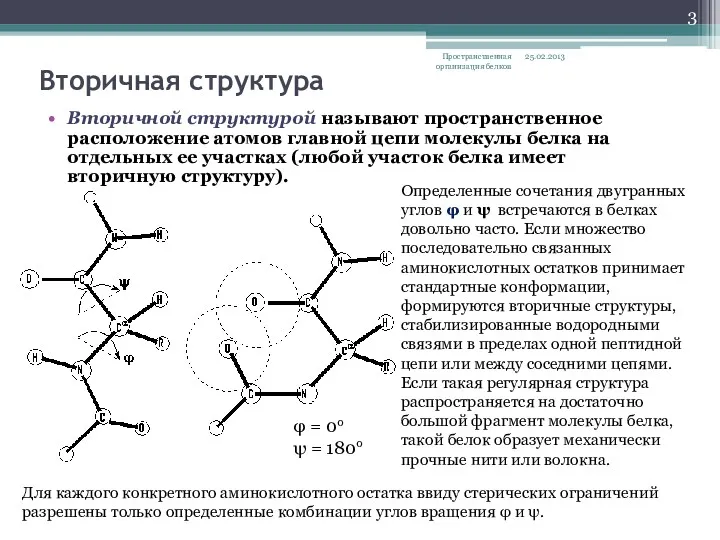
- 3. Вторичная структура Вторичной структурой называют пространственное расположение атомов главной цепи молекулы белка на отдельных ее участках
- 4. Карта Рамачандрана 25.02.2013 Пространственная организация белков Основные варианты вторичной структуры на фоне разрешённых и запрещённых областей
- 5. Спирали (Л. Полинг, Р.Кори, 1951) Важнейшие спирали в полипептидной цепи держатся водородными связями, С=О группы остова
- 6. Альфа спираль (αR) 25.02.2013 Пространственная организация белков Наиболее распространенным элементом вторичной структуры является правая α-спираль (αR).
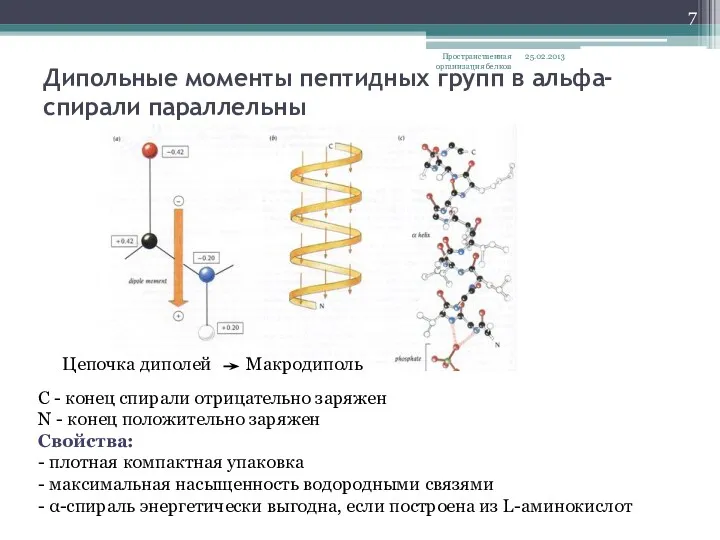
- 7. Дипольные моменты пептидных групп в альфа- спирали параллельны 25.02.2013 Пространственная организация белков Цепочка диполей Макродиполь С
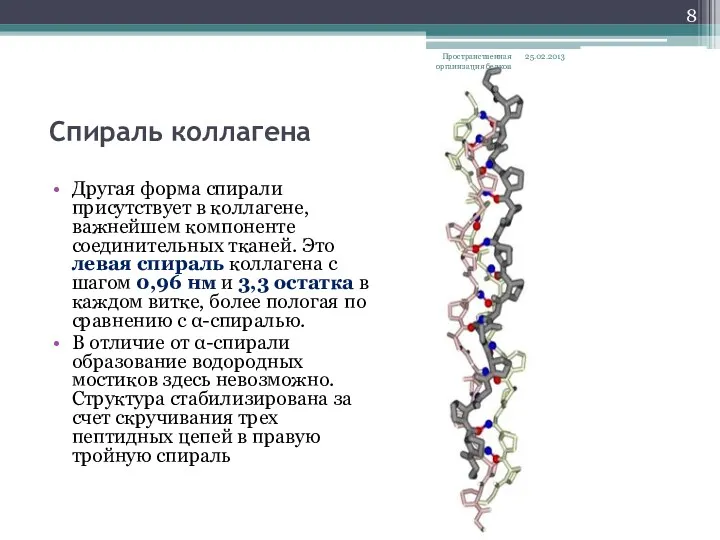
- 8. Спираль коллагена Другая форма спирали присутствует в коллагене, важнейшем компоненте соединительных тканей. Это левая спираль коллагена
- 9. Складчатые структуры Бета цепи (β-цепи) - регулярные структуры без водородных связей вдоль цепи, но соединенные водородными
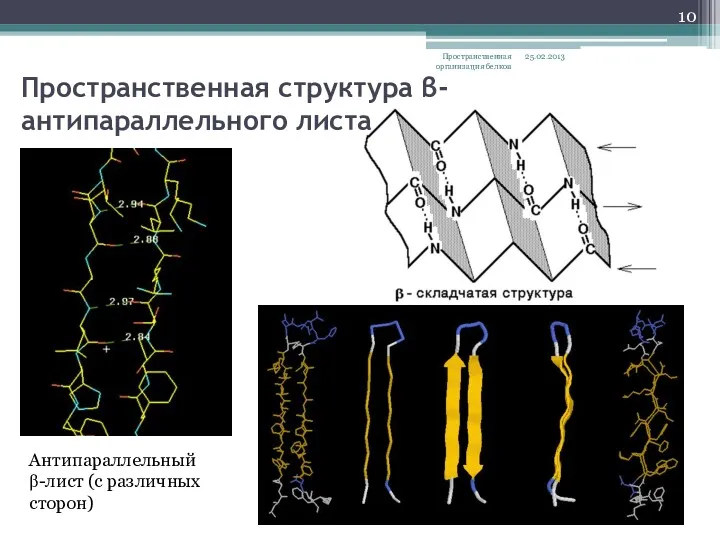
- 10. Пространственная структура β- антипараллельного листа 25.02.2013 Пространственная организация белков Антипараллельный β-лист (с различных сторон)
- 11. Регулярные вторичные структуры Основное свойство: максимальное число Н-связей 25.02.2013 Пространственная организация белков Основные геометрические параметры наиболее
- 12. Неупорядоченное состояние (петли) значения φ, ψ вне области регулярных вторичных структур стабилизация за счет взаимодействий боковых
- 13. β-Петля (β-изгиб) В тех участках, где пептидная цепь изгибается достаточно круто, часто находится β-петля. Это короткий
- 14. Относительное содержание разных типов вторичных структур в глобулярных белках: Альфа спирали - 35% (5-15 остатков -15
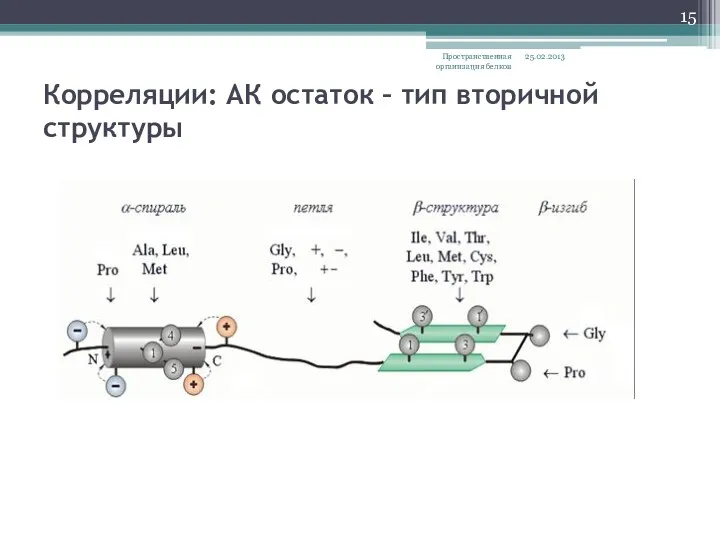
- 15. Корреляции: АК остаток – тип вторичной структуры 25.02.2013 Пространственная организация белков
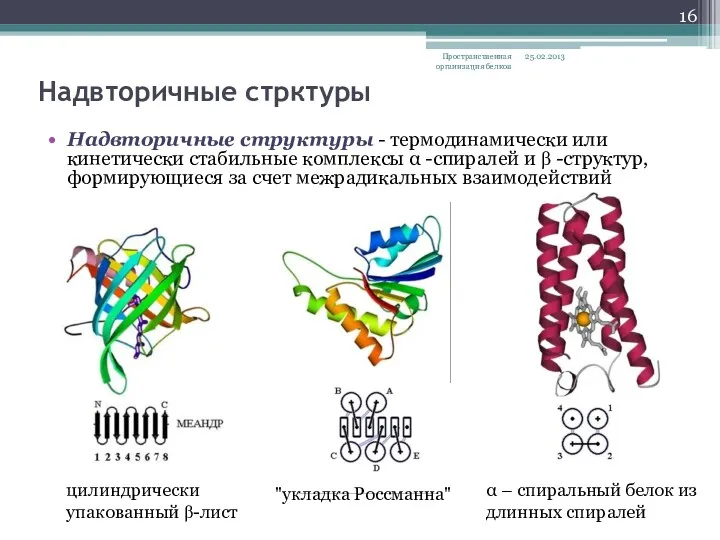
- 16. Надвторичные стрктуры Надвторичные структуры - термодинамически или кинетически стабильные комплексы α -спиралей и β -структур, формирующиеся
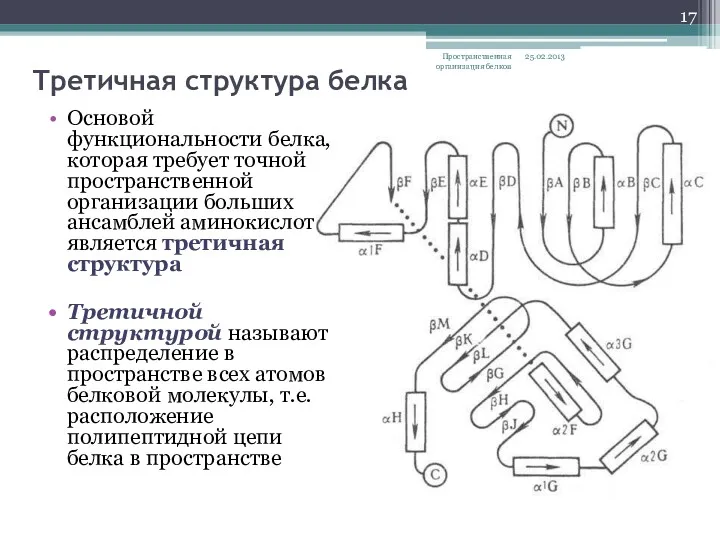
- 17. Третичная структура белка Основой функциональности белка, которая требует точной пространственной организации больших ансамблей аминокислот является третичная
- 18. Белки порины 25.02.2013 Пространственная организация белков
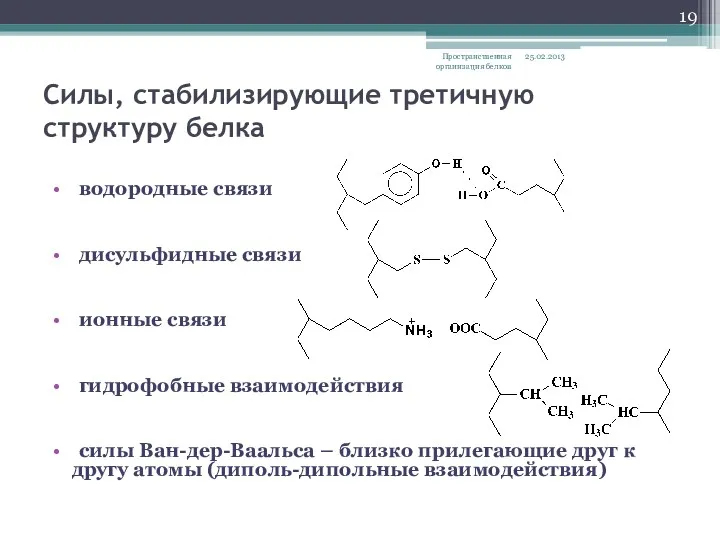
- 19. Силы, стабилизирующие третичную структуру белка водородные связи дисульфидные связи ионные связи гидрофобные взаимодействия силы Ван-дер-Ваальса –
- 20. Четвертичная структура белка Термин "четвертичная структура" относится к макромолекулам, в состав которых входит несколько полипептидных цепей
- 21. 25.02.2013 Пространственная организация белков Объединение нескольких взаимосвязанных функций в единой структуре. Например, протеинкиназа состоит из двух
- 22. 25.02.2013 Пространственная организация белков Регуляторная функция. Главная функциональная особенность четвертичной структуры, по-видимому, смысл ее существования, состоит
- 24. Скачать презентацию













 Культивирование бактерий. Изучение культуральных свойств
Культивирование бактерий. Изучение культуральных свойств Сходство и различия в строении клеток растений, животных и грибов
Сходство и различия в строении клеток растений, животных и грибов Атавистическое, нормальное и патологическое поведение собаки и лекарственная коррекция отклоняющегося поведения
Атавистическое, нормальное и патологическое поведение собаки и лекарственная коррекция отклоняющегося поведения Маски из продуктов питания. Маска для подтяжки кожи лица
Маски из продуктов питания. Маска для подтяжки кожи лица Белки плазмы крови
Белки плазмы крови Презентация Сообщества воды 5 класс
Презентация Сообщества воды 5 класс Зачем животным нужен хвост. 4 класс
Зачем животным нужен хвост. 4 класс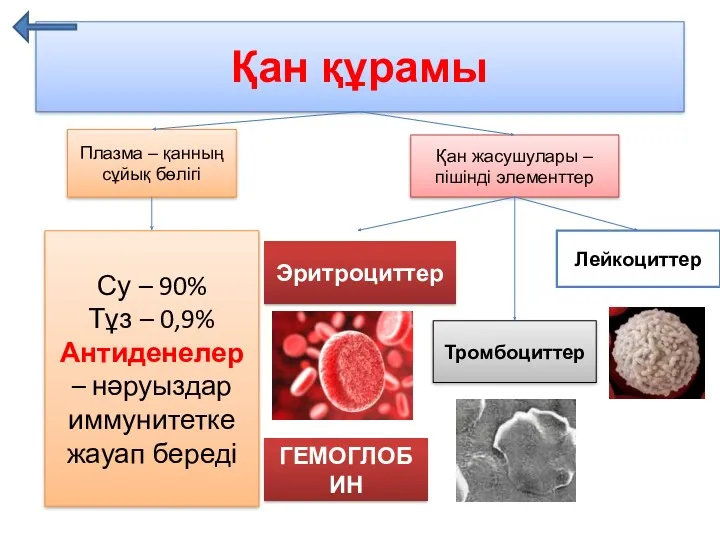 Қан құрамы
Қан құрамы Царство грибов
Царство грибов Жұмыр құрттар
Жұмыр құрттар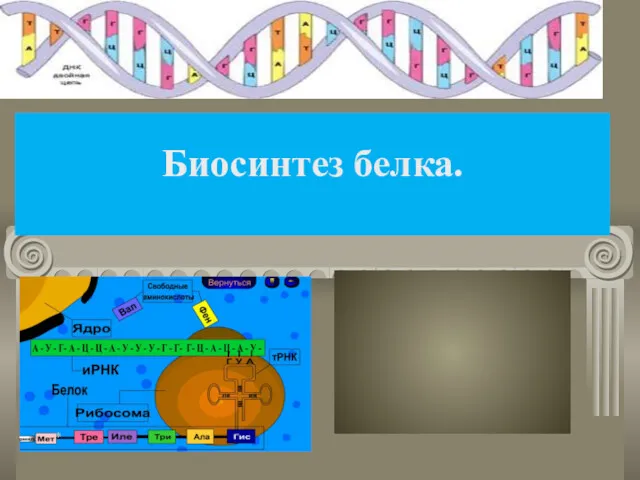 Биосинтез белка
Биосинтез белка Животные живого уголка
Животные живого уголка Обобщающий урок в форме конференции по итогам изучения раздела Нервная система и органы чувств
Обобщающий урок в форме конференции по итогам изучения раздела Нервная система и органы чувств Устойчивость и резистентность вредных организмов к пестицидам и пути ее преодоления. (Лекция 4)
Устойчивость и резистентность вредных организмов к пестицидам и пути ее преодоления. (Лекция 4) Зчётные блоки вопросов
Зчётные блоки вопросов Модифікація радіочутливості клітин. Кисневий ефект
Модифікація радіочутливості клітин. Кисневий ефект Опорно- двигательная системе
Опорно- двигательная системе Организм и его свойства. 5 класс
Организм и его свойства. 5 класс Күздік бидай өсіру технологиясы
Күздік бидай өсіру технологиясы Время посева и глубина заделки семян
Время посева и глубина заделки семян Как прекрасен мир бабочек
Как прекрасен мир бабочек Дыхание растений
Дыхание растений Видообразование. Результаты микроэволюции
Видообразование. Результаты микроэволюции Характерные признаки семейств класса Двудольные. Семейства Крестоцветные, Розоцветные, Мотыльковые
Характерные признаки семейств класса Двудольные. Семейства Крестоцветные, Розоцветные, Мотыльковые ЗООЛОГИЯ – НАУКА О ЖИВОТНЫХ
ЗООЛОГИЯ – НАУКА О ЖИВОТНЫХ Мужская половая система
Мужская половая система Конкурс:Экология. Книга. Мы. Лучший библиотечный цветник
Конкурс:Экология. Книга. Мы. Лучший библиотечный цветник Питание клетки
Питание клетки