Содержание
- 2. План: Строение, классификация, свойства и функции белков. Роль белка в питании. Показатели качества пищевого белка: аминокислотный
- 3. «Гниение» белков в кишечнике. Роль УДФ-глюкуроновой кислоты и ФАФС в процессах обезвреживания и выведения продуктов «гниения»
- 4. Белки - высокомолекулярные органические соединения, состоящие из остатков более 100 аминокислот (20 видов), соединенных пептидной связью.
- 5. Элементарный состав белков: (% от сухой массы) С - 50-55% О - 21-24% N - 15-18%
- 6. Структуры белка Первичная – линейная последовательность аминокислот соединенных пептидными связями Вторичная – пространственная структура белка, стабилизированная
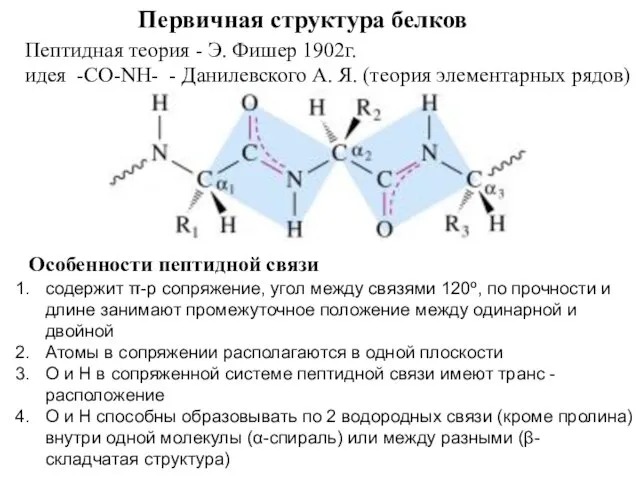
- 7. Первичная структура белков Пептидная теория - Э. Фишер 1902г. идея -CO-NH- - Данилевского А. Я. (теория
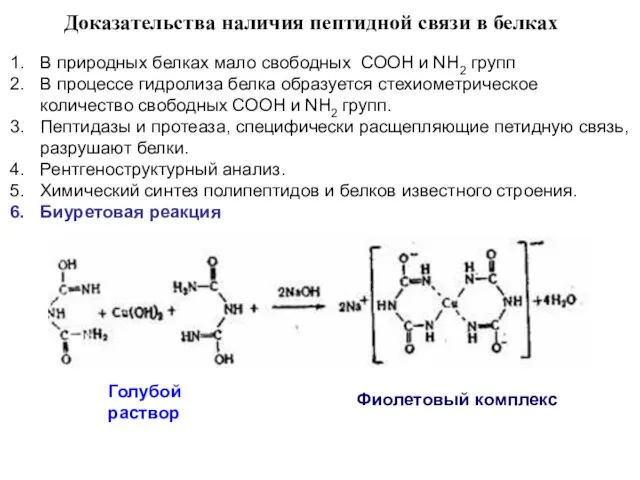
- 8. Доказательства наличия пептидной связи в белках В природных белках мало свободных СООН и NН2 групп В
- 9. Биуретовая реакция
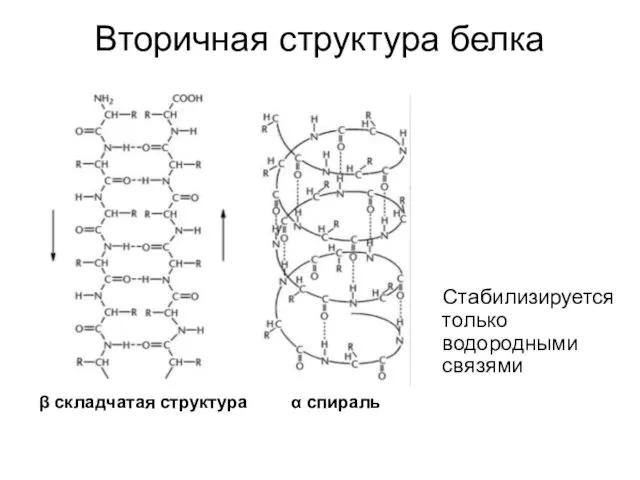
- 10. Вторичная структура белка α спираль β складчатая структура Стабилизируется только водородными связями
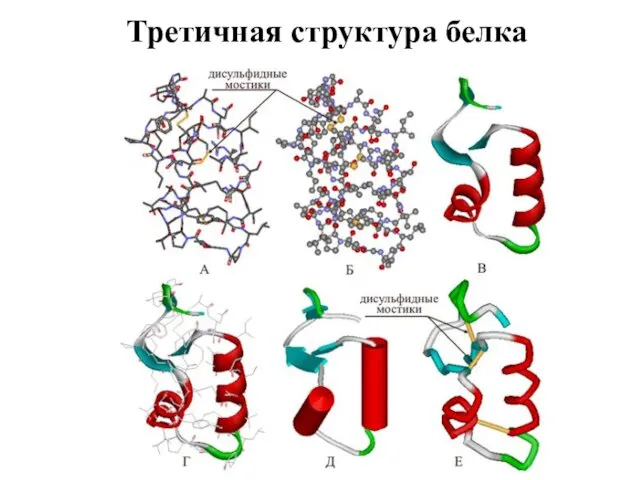
- 11. Третичная структура белка
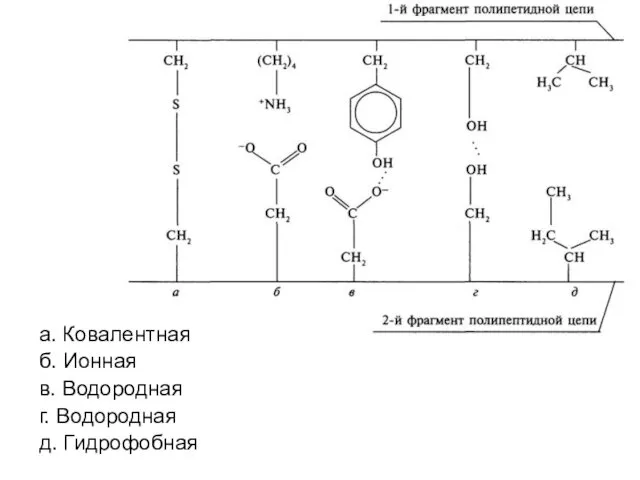
- 12. а. Ковалентная б. Ионная в. Водородная г. Водородная д. Гидрофобная
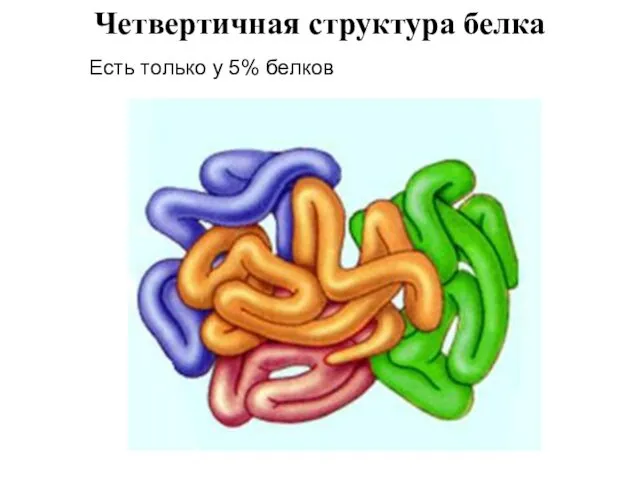
- 13. Четвертичная структура белка Есть только у 5% белков
- 14. Свойства белков
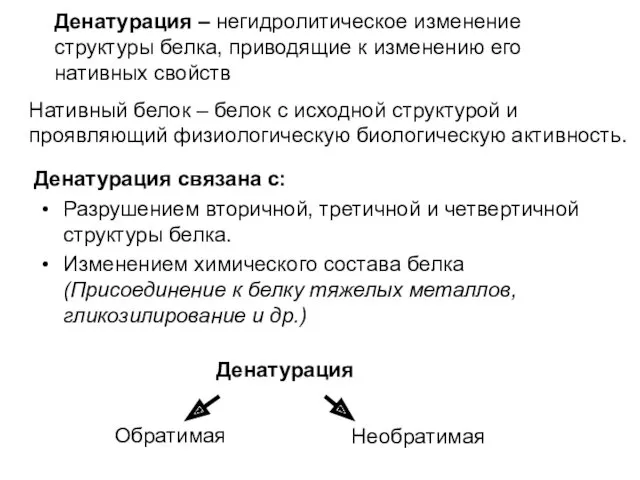
- 15. Разрушением вторичной, третичной и четвертичной структуры белка. Изменением химического состава белка (Присоединение к белку тяжелых металлов,
- 16. Факторы денатурации: Физические (t, давление, УЗ) Химические (кислоты, щелочи, тяжелые металлы) Биологические (протеолитические ферменты) Признаки денатурации:
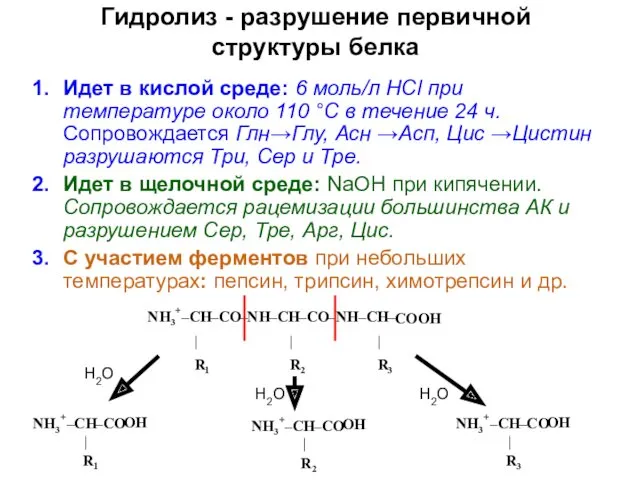
- 17. Гидролиз - разрушение первичной структуры белка Идет в кислой среде: 6 моль/л НСl при температуре около
- 18. Свойства белков в растворе Образуют коллоидный раствор Не проходят через полупроницаемые мембраны Опалесцируют Рассеивают свет Способны
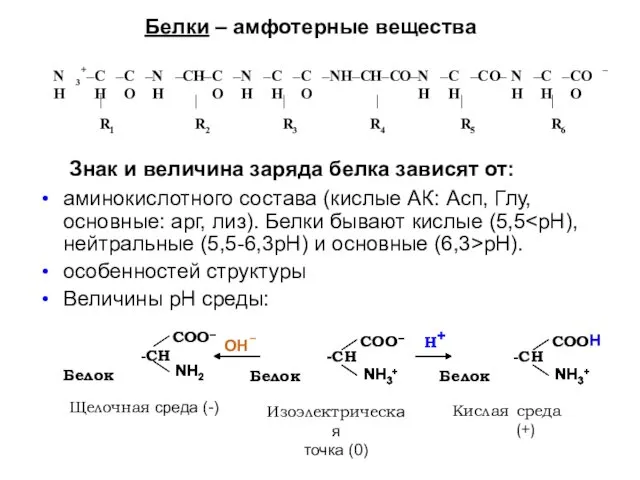
- 19. Белки – амфотерные вещества Знак и величина заряда белка зависят от: аминокислотного состава (кислые АК: Асп,
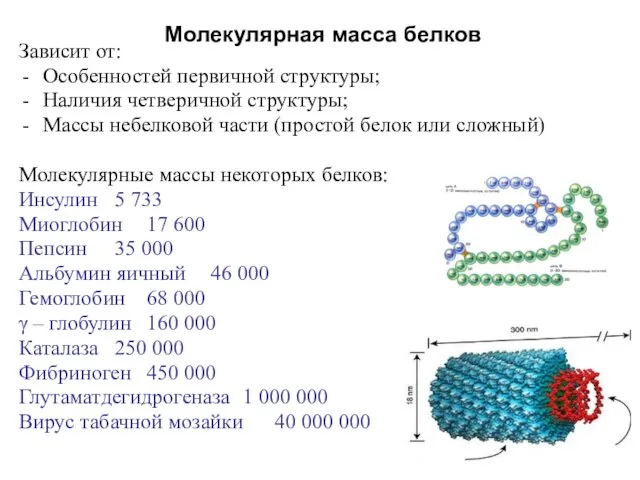
- 20. Молекулярная масса белков Зависит от: Особенностей первичной структуры; Наличия четверичной структуры; Массы небелковой части (простой белок
- 21. Функции белков в организме Неспецифические Энергетическая (при голодании) Онкотическое давление (белки сыворотки крови) Буферная – поддержание
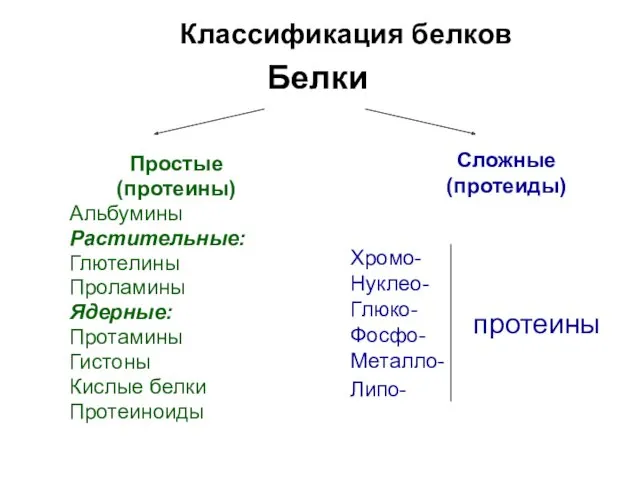
- 22. Белки Простые (протеины) Альбумины Растительные: Глютелины Проламины Ядерные: Протамины Гистоны Кислые белки Протеиноиды Сложные (протеиды) Классификация
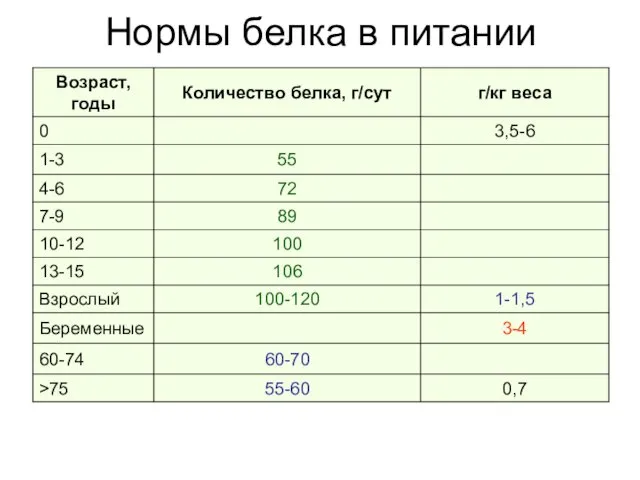
- 23. ПРИНЦИПЫ НОРМИРОВАНИЯ БЕЛКА В ПИТАНИИ Норма поступления количества белка зависит от: - массы тела (прямая зависимость)
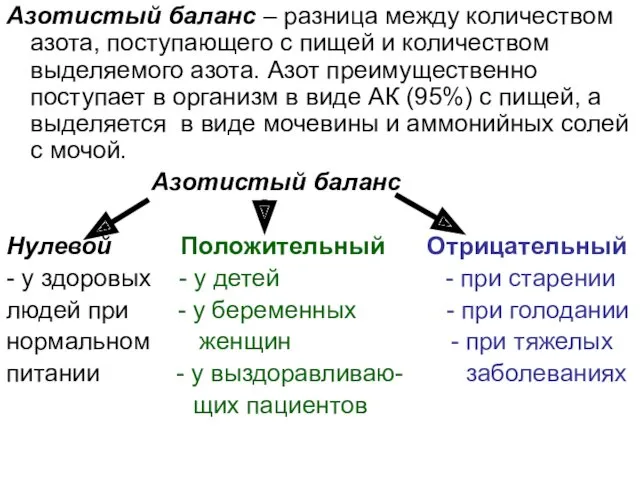
- 24. Азотистый баланс – разница между количеством азота, поступающего с пищей и количеством выделяемого азота. Азот преимущественно
- 25. Нормы белка в питании
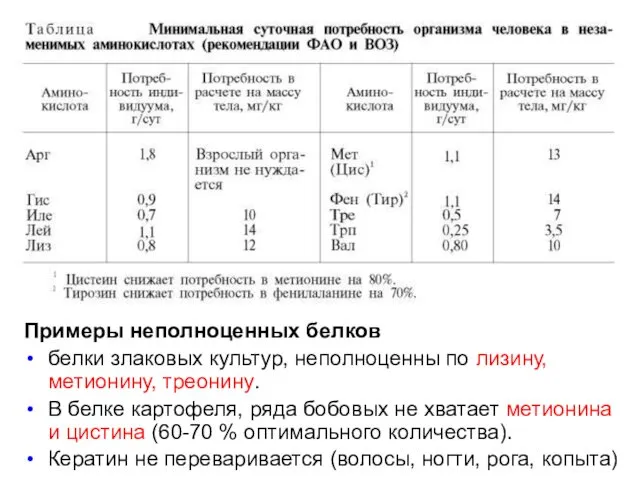
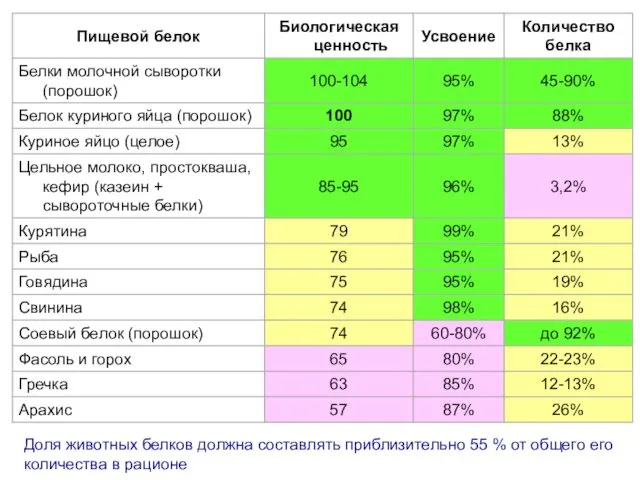
- 26. Питательная ценность белка зависит от: – аминокислотного состава – способности усваиваться организмом Полноценный белок - это
- 27. Примеры неполноценных белков белки злаковых культур, неполноценны по лизину, метионину, треонину. В белке картофеля, ряда бобовых
- 28. Доля животных белков должна составлять приблизительно 55 % от общего его количества в рационе
- 29. Белковая недостаточность Продолжительное безбелковое питание вызывает серьезные нарушения обмена и может привести к гибели организма. Причины:
- 30. Одним из самых ярких примеров является заболевание квашиоркор, что в переводе с Ганского означает «золотой, или
- 31. Ареал – развивающиеся страны (Гана) Этиология и патогенез Белковая недостаточность может быть следствием количественного или качественного
- 32. Поздние симптомы: Задержка роста, гипотония мышц и их дистрофия, снижение тургора тканей. У кожи гиперпигментация и
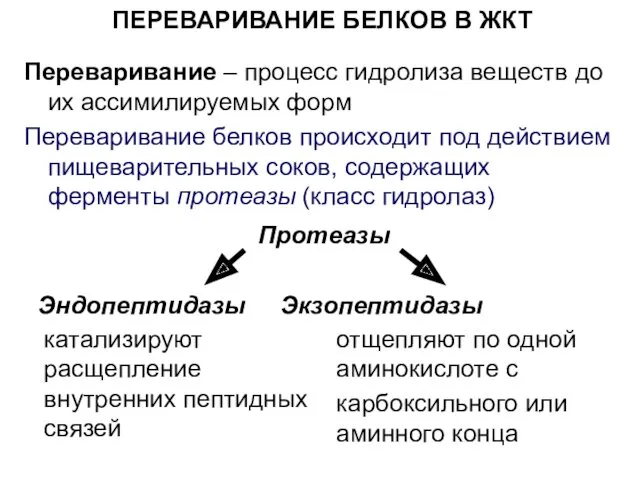
- 33. ПЕРЕВАРИВАНИЕ БЕЛКОВ В ЖКТ Переваривание – процесс гидролиза веществ до их ассимилируемых форм Переваривание белков происходит
- 34. Пепсин реннин гастриксин ЭНДО ЭКЗО Желудочный сок Панкреатический сок Кишечный сок аминопептидаза пептидазы трипсин химотрипсин эластаза
- 35. Специфичность протеиназ ЖКТ Аминопеп-тидаза пепсин Химо-трипсин трипсин эластаза эластаза Карбоксипеп-тидаза Катепсины - внутриклеточные протеиназы, локализуются в
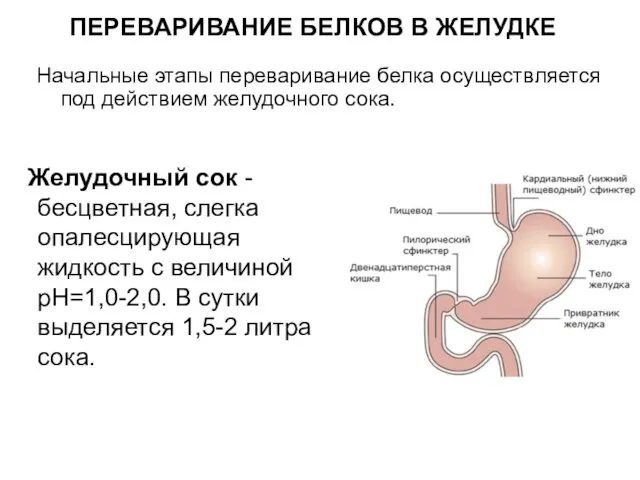
- 36. ПЕРЕВАРИВАНИЕ БЕЛКОВ В ЖЕЛУДКЕ Желудочный сок - бесцветная, слегка опалесцирующая жидкость с величиной рН=1,0-2,0. В сутки
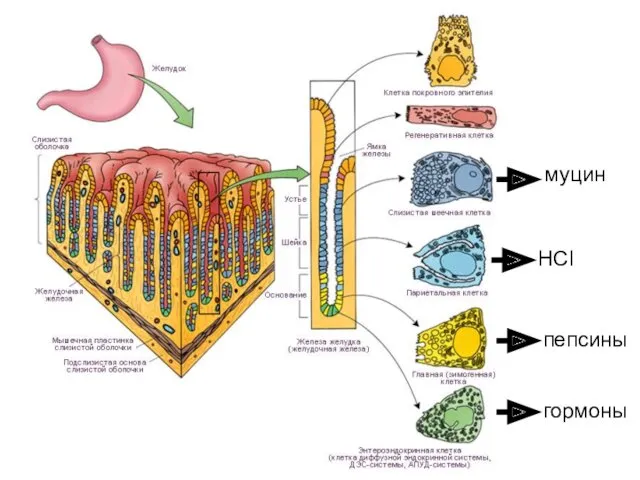
- 37. Состав желудочного сока Вода – 99% Кислоты: НCI свободная, связанная с белками, другие органические кислоты Основания:
- 38. НСl пепсины муцин гормоны
- 39. Белки желудка Пепсин А – эндопептидазы, рН=1,5-2,0. Гидролизуют внутренние пептидные связи в белке до коротких пептидов:
- 40. Реннин (химозин, пепсин Д) – эндопептидаза, с оптимумом рН=3-4, вызывает створаживание молока. Активируется НCl в присутствии
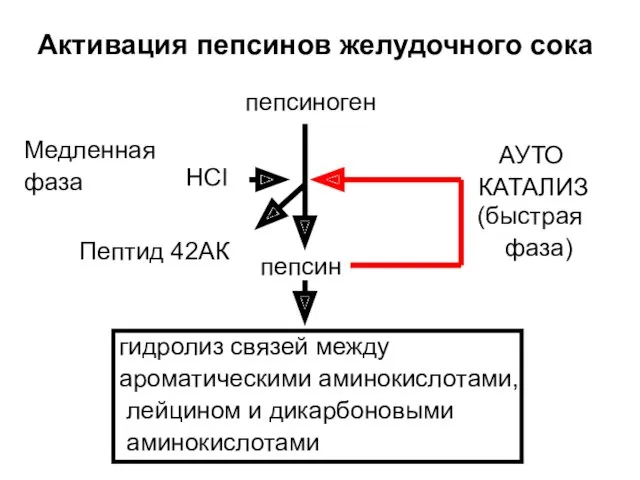
- 41. Активация пепсинов желудочного сока пепсиноген Пептид 42АК HCl пепсин гидролиз связей между ароматическими аминокислотами, лейцином и
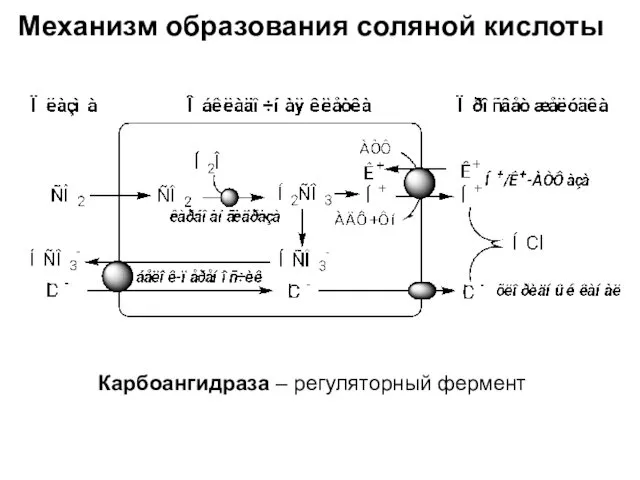
- 42. Механизм образования соляной кислоты Карбоангидраза – регуляторный фермент
- 43. Функции НСl: Вызывает денатурацию и набухание белков пищи, что увеличивает доступность их пептидных связей для действия
- 45. Виды кислотности Общая кислотность желудочного сока (40-60 ТЕ) складывается из: Свободной НСl (20-40 ТЕ) Связанной НСl
- 46. Желудочная ахилия - отсутствие стимулированной (гистамином) секреции НСl и пепсина в желудочном соке. Наблюдается при атрофических
- 47. ПЕРЕВАРИВАНИЕ БЕЛКОВ В КИШЕЧНИКЕ Переваривание белков происходит в кишечнике под действием пищеварительных соков поджелудочной железы и
- 48. Панкреатический сок - опалесцирующая жидкость с величиной рН=7,5-8,8. В сутки выделяется 1,5-2,5 литра сока. В соке
- 49. Трипсин (эндопептидаза) преимущественно гидролизует пептидные связи, образованные карбоксильными группами аргинина и лизина. Химотрипсины – эндопептидазы, наиболее
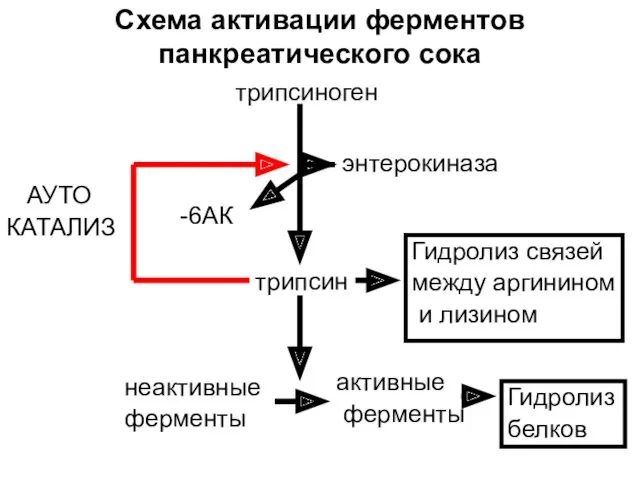
- 50. Схема активации ферментов панкреатического сока трипсиноген энтерокиназа -6АК трипсин неактивные ферменты активные ферменты АУТО КАТАЛИЗ Гидролиз
- 51. Кишечный сок - неоднородная вязкая жидкость, с величиной рН=7,2-8,6 (с усилением секреции - рН повышается). За
- 52. Ферменты кишечного сока Все ферменты образуются в активной форме и локализуются в мембранах энтероцитов, их активные
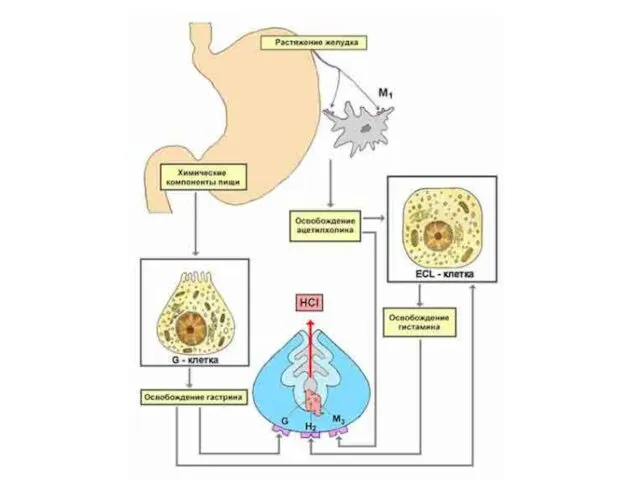
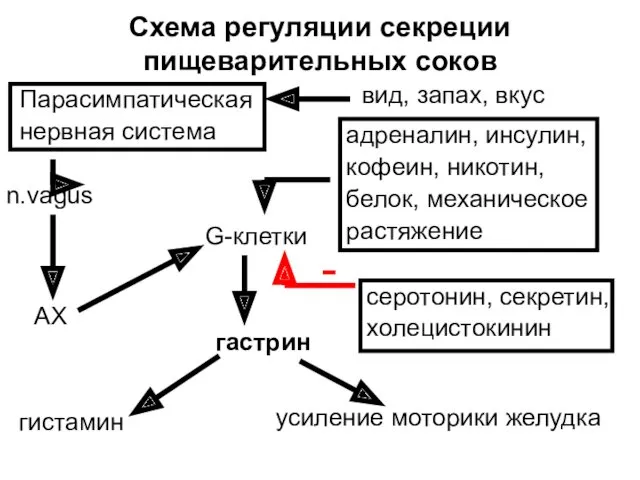
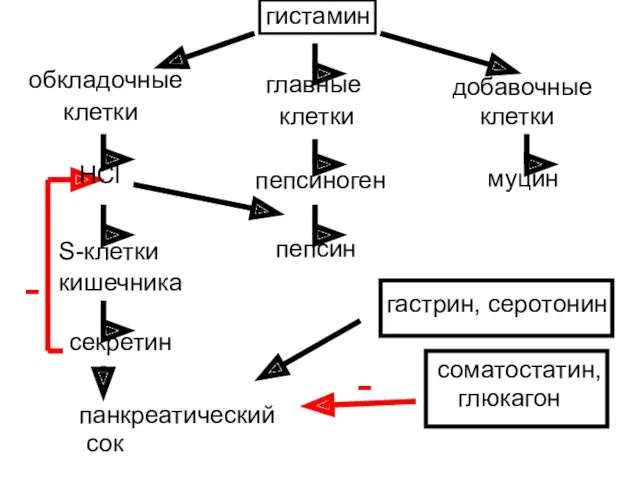
- 53. Схема регуляции секреции пищеварительных соков - вид, запах, вкус n.vagus AX серотонин, секретин, холецистокинин адреналин, инсулин,
- 54. - - обкладочные клетки главные клетки добавочные клетки гистамин HCl пепсиноген пепсин S-клетки кишечника панкреатический сок
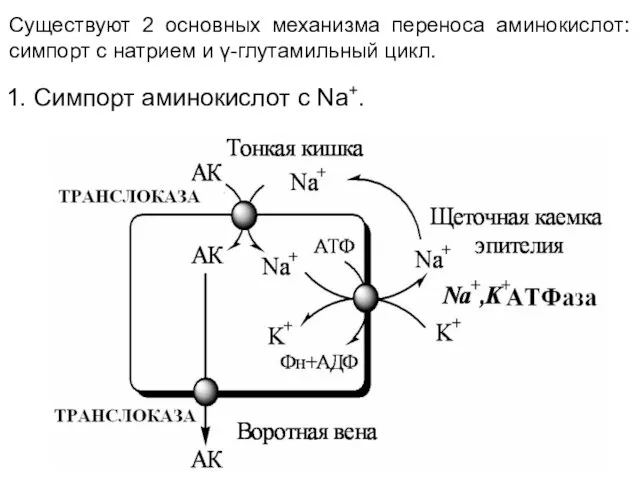
- 56. ВСАСЫВАНИЕ АМИНОКИСЛОТ В КИШЕЧНИКЕ Всасывание L-аминокислот (но не D) — активный процесс, в результате которого аминокислоты
- 57. 1. Симпорт аминокислот с Na+. Существуют 2 основных механизма переноса аминокислот: симпорт с натрием и γ-глутамильный
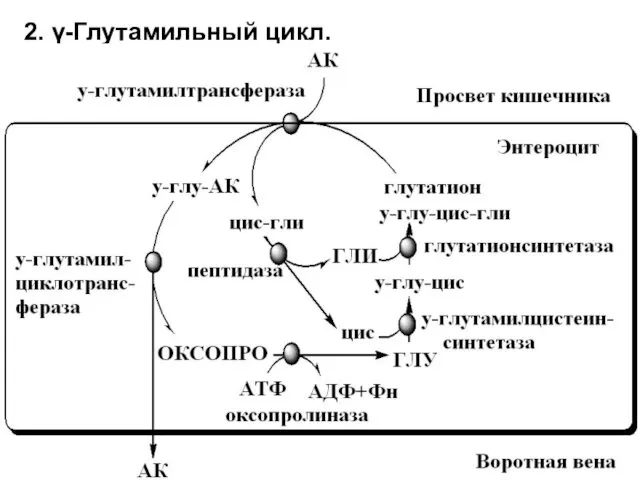
- 58. 2. γ-Глутамильный цикл.
- 59. Пути использования всосавшихся аминокислот Углеводы Липиды Холин Креатин Пептиды (глутатион, ансерин, карнозин) Порфирины (гем, цитохромы) Аминокислоты
- 60. ГНИЕНИЕ Гниение – (putrefacio) процесс расщепления азотсодержащих, главным образом белковых веществ, под действием ферментов аммонифицирующих микроорганизмов
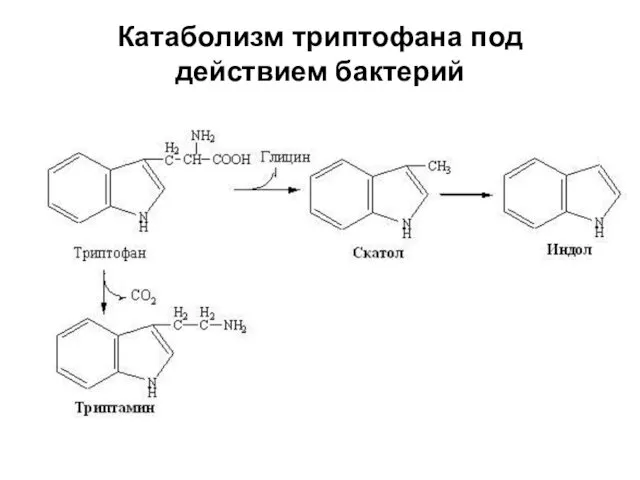
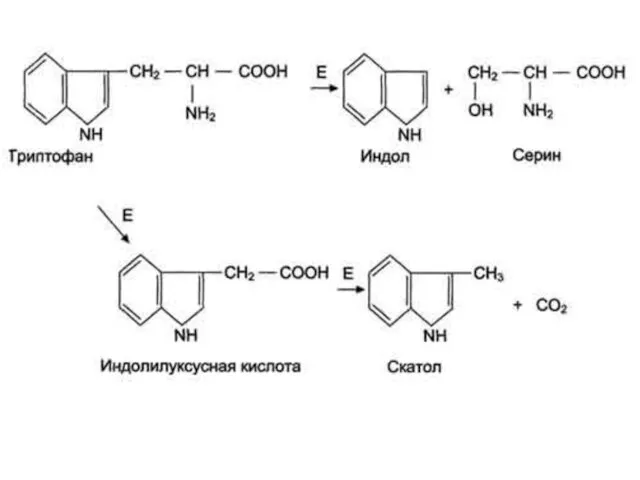
- 61. До индола, скатола, NH3,H2S осуществляют гниение бактерий рода Bacillus, Clostridium и семейства Enterobacteriaceae Теория старения И.
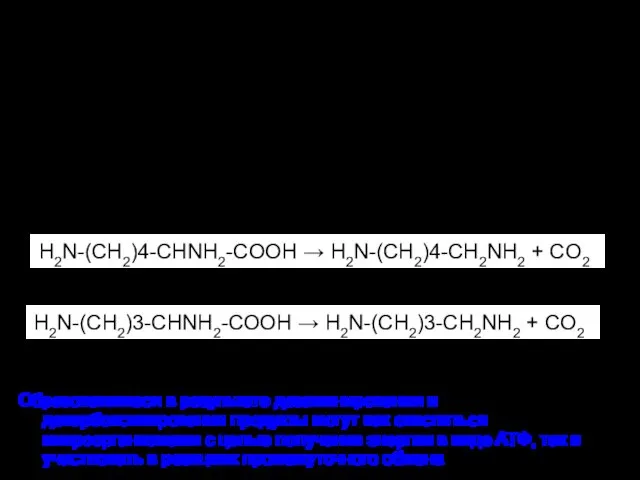
- 62. Этапы гниения Гидролиз белков протеазами микроорганизмов и погибших тканей до АК Дезаминирование АК до Кетокислот и
- 63. Анаэробное разложение белков представителями рода Clostridium Способны сбраживать глутаминовую кислоту, глутамин, гистидин, лизин, аргинин, фенилаланин, серин,
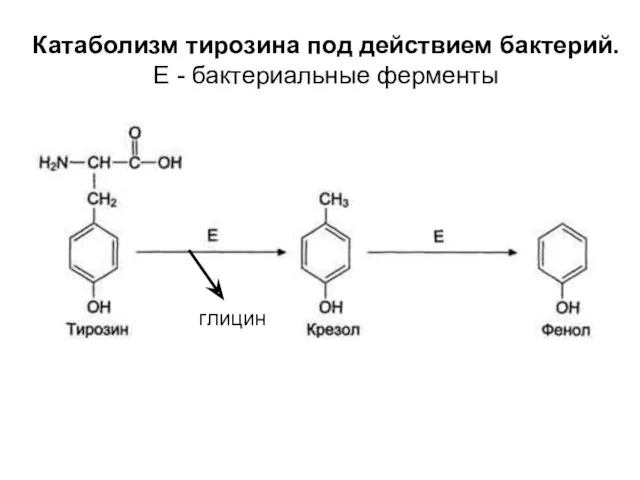
- 64. Катаболизм тирозина под действием бактерий. E - бактериальные ферменты глицин
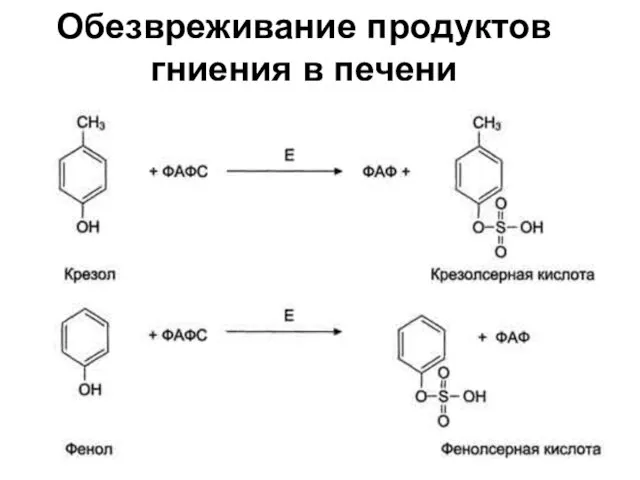
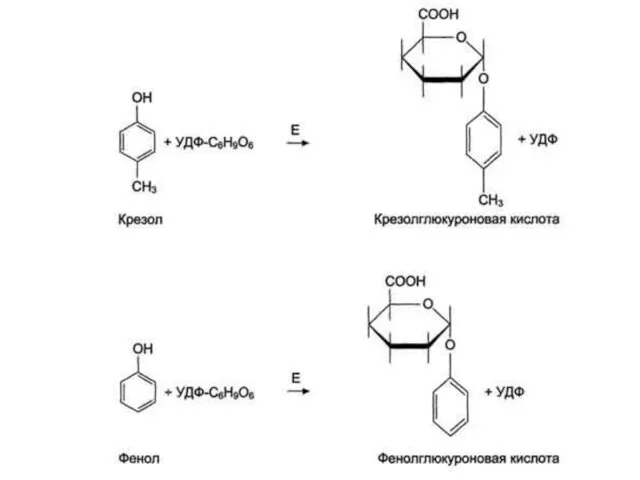
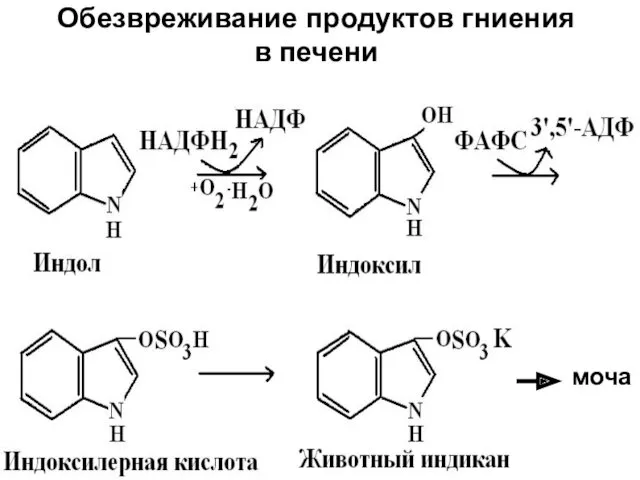
- 65. Обезвреживание продуктов гниения в печени
- 67. Катаболизм триптофана под действием бактерий
- 69. Обезвреживание продуктов гниения в печени моча
- 70. СПАСИБО ЗА ВНИМАНИЕ!
- 72. Скачать презентацию


































 Нуклеїнові кислоти (ДНК та РНК)
Нуклеїнові кислоти (ДНК та РНК) Botanika. Organizace předmětu
Botanika. Organizace předmětu Генетика пола
Генетика пола Биологиялық мембраналардың өткізгіштік механизмі. Иондық каналдардың және тасымалдаушылардың құрылысы мен функциясы
Биологиялық мембраналардың өткізгіштік механизмі. Иондық каналдардың және тасымалдаушылардың құрылысы мен функциясы Клонування організмів
Клонування організмів Урок – практикум. Генеалогический метод исследования живых организмов. Составление родословной А. С. Пушкина
Урок – практикум. Генеалогический метод исследования живых организмов. Составление родословной А. С. Пушкина Молекулярные механизмы образования хромосомных перестроек с учетом структурной организации хромосомных районов
Молекулярные механизмы образования хромосомных перестроек с учетом структурной организации хромосомных районов Поширення плодів та насіння у природі
Поширення плодів та насіння у природі Конспект урока: Экологические типы птиц, их роль в природе, жизни человека
Конспект урока: Экологические типы птиц, их роль в природе, жизни человека Імунна система людини, особливості її функціонування
Імунна система людини, особливості її функціонування Кайнозойская эра. Антропогеновый период
Кайнозойская эра. Антропогеновый период Применение активных дрожжей в кормлений животных
Применение активных дрожжей в кормлений животных Клетка: строение и функции (цитология)
Клетка: строение и функции (цитология) Виды регуляций в организме
Виды регуляций в организме Мочеполовой аппарат
Мочеполовой аппарат Ядовитые растения Курганской области
Ядовитые растения Курганской области Почему лук щиплет глаза?
Почему лук щиплет глаза? Цветок. Строение цветка
Цветок. Строение цветка Плазуни. Зовнішня будова
Плазуни. Зовнішня будова Почему человек потеет
Почему человек потеет презентация к уроку Пищеварение в кишечнике
презентация к уроку Пищеварение в кишечнике Профилактика сердечно-сосудистых заболеваний
Профилактика сердечно-сосудистых заболеваний Обмен веществ и энергии, терморегуляция
Обмен веществ и энергии, терморегуляция Условные и безусловные рефлексы
Условные и безусловные рефлексы Обоняние, осязание, вкус
Обоняние, осязание, вкус Fruits and their classification. Spreading of fruits and seeds
Fruits and their classification. Spreading of fruits and seeds Функциональная анатомия женских половых органов
Функциональная анатомия женских половых органов Эпифиз (пинеальная железа, шишковидное тело, corpus pineale, epiphysis cerebri)
Эпифиз (пинеальная железа, шишковидное тело, corpus pineale, epiphysis cerebri)