Содержание
- 2. Функции белков - ферментативная - структурообразовательная - защитная (иммунная) - опорная - сократительная
- 3. Функции белков - регуляторная (гормоны, рецепторы) - энергетическая - транспортная (белки плазмы крови, белки мембран, белки
- 4. Нормы белка в питании Для взрослых при средней физической нагрузке – 100 -120 г белков в
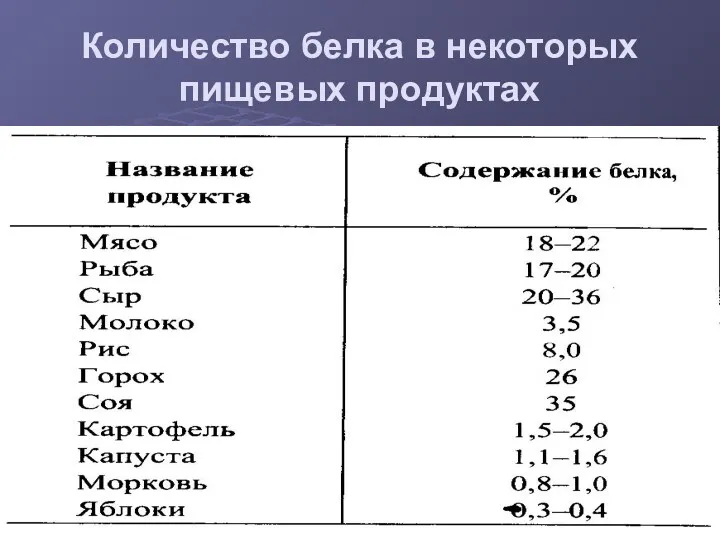
- 5. Количество белка в некоторых пищевых продуктах
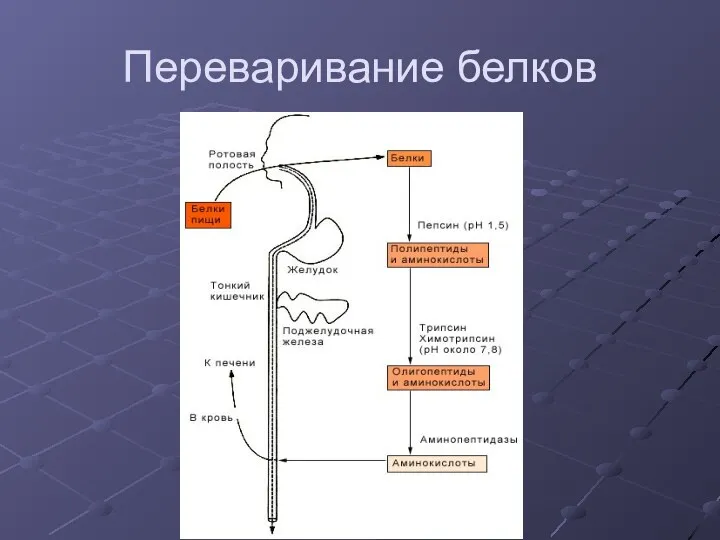
- 6. Переваривание белков
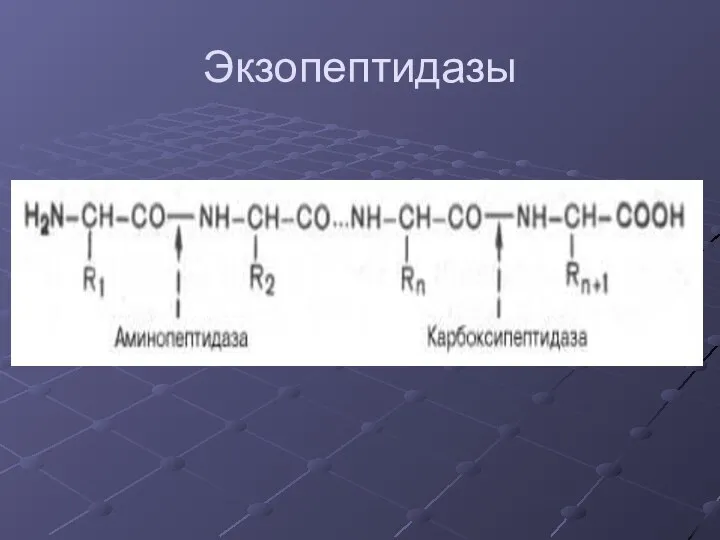
- 7. Экзопептидазы
- 8. Характеристика пептидаз желудка Пепсин: - расщепляет связи, образованные карбоксильными группами ароматических аминокислот (фен, тир и трп);
- 9. Характеристика пептидаз поджелудочной железы Трипсин: - расщепляет связи, образованные СООН группами арг или лиз; - активирует
- 10. Характеристика пептидаз кишечного сока Аминопептидаза: - отщепляет аминокислоты с N-конца. Дипептидазы и трипептидазы: - расщепляют дипептиды
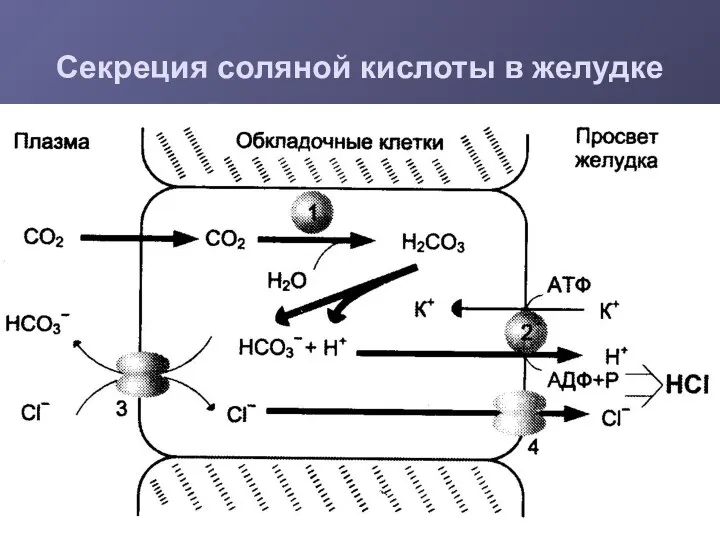
- 11. Секреция соляной кислоты в желудке
- 12. Роль НСl Превращение препепсина в пепсин Оптимум рН для работы пепсина Денатурация и набухание пищевых белков
- 13. Источники аминокислот Переваривание пищевых белков в ЖКТ Расщепление клеточных белков лизосомальными пептидазами (катепсинами) Синтез из других
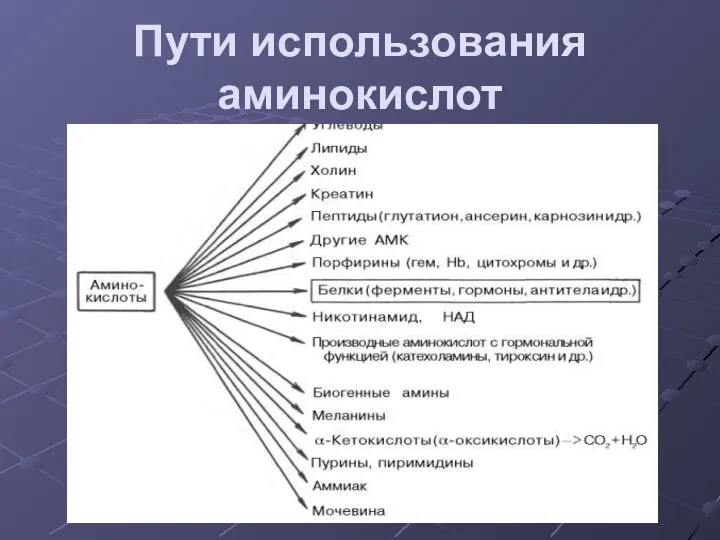
- 14. Пути использования аминокислот Синтез белков Синтез биологически важных соединений (пуринов, пиримидинов, гормонов, порфиринов и др.) Дезаминирование
- 15. Пути использования аминокислот
- 16. Декарбоксилирование аминокислот R CH NH2 COOH CO2 R CH2 NH2 B6 декарбоксилаза Аминокислота Амин
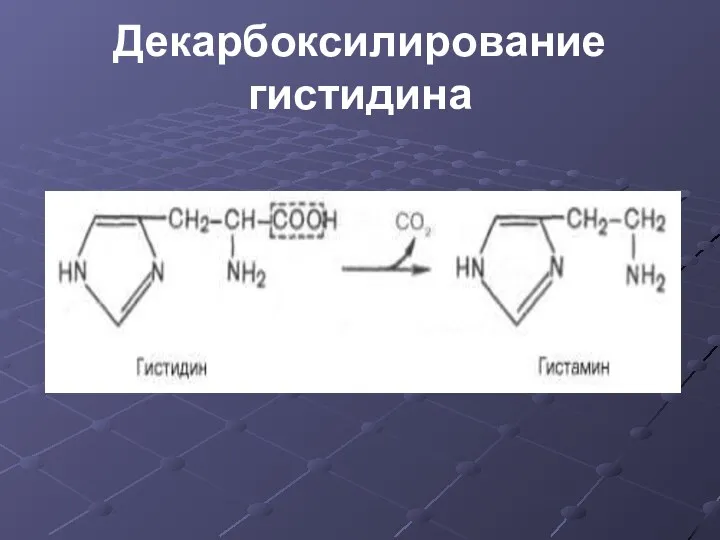
- 17. Декарбоксилирование гистидина
- 18. Функции гистамина - через Н2-рецепторы стимулирует секрецию желудочного сока, слюны - через Н1-рецепторы повышает проницаемость капилляров,
- 19. Функции гистамина - сокращает гладкую мускулатуру легких, вызывает удушье - участвует в формировании воспалительной реакции -
- 20. Декарбоксилирование орнитина и лизина При декарбоксилировании орнитина образуется путресцин, лизина - кадаверин, которые относятся к диаминам.
- 21. Декарбоксилирование глутамата B6 Декарбоксилаза COOH CH2 CH2 CHNH2 COOH Глутамат COOH CH2 CH2 CH2 NH2 γ-
- 22. Декарбоксилирование глутамата γ- аминомасляная кислота (ГАМК): служит основным тормозным модулятором высших отделов мозга повышает дыхательную активность
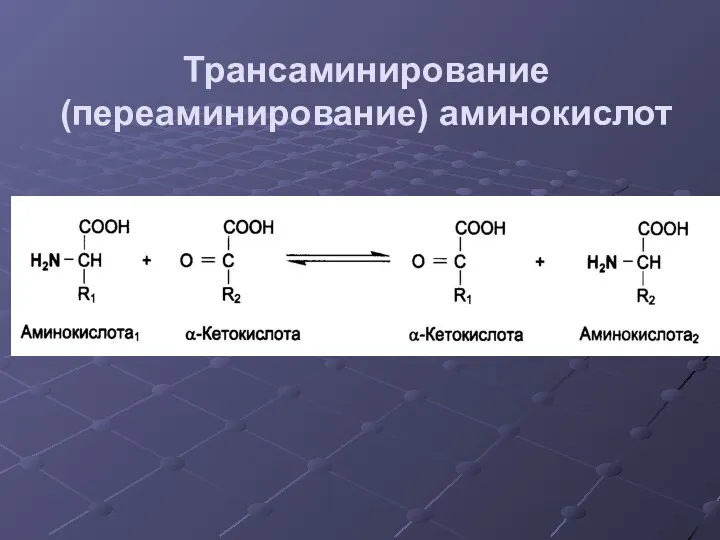
- 23. Трансаминирование (переаминирование) аминокислот
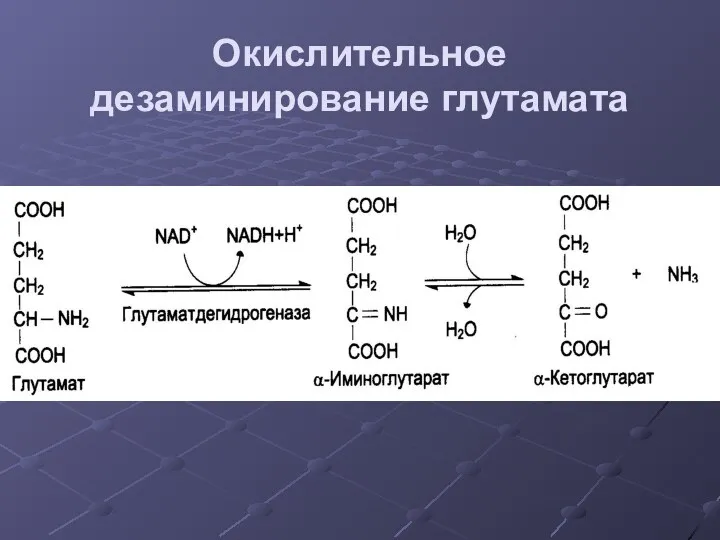
- 24. Окислительное дезаминирование глутамата .
- 25. Регуляция ГДГ Активируют: АДФ Ингибируют: АТФ, НАДН
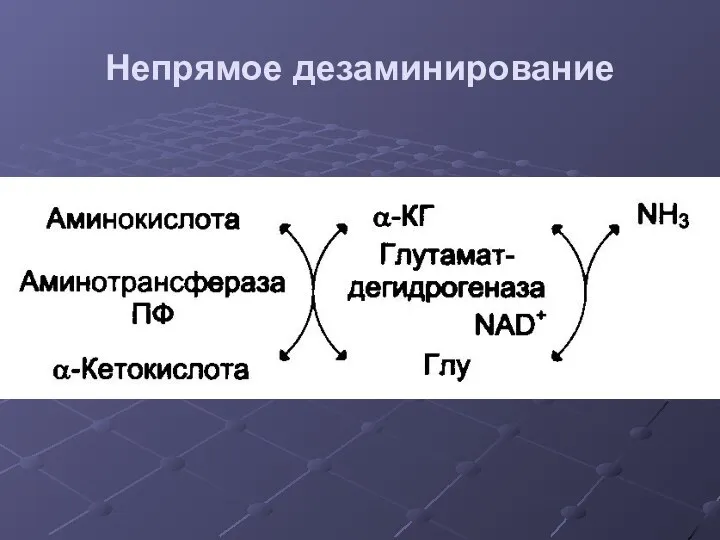
- 26. Непрямое дезаминирование
- 27. Непрямое дезаминирование Продукты непрямого дезаминирования: α-кетокислота НАДН NН3
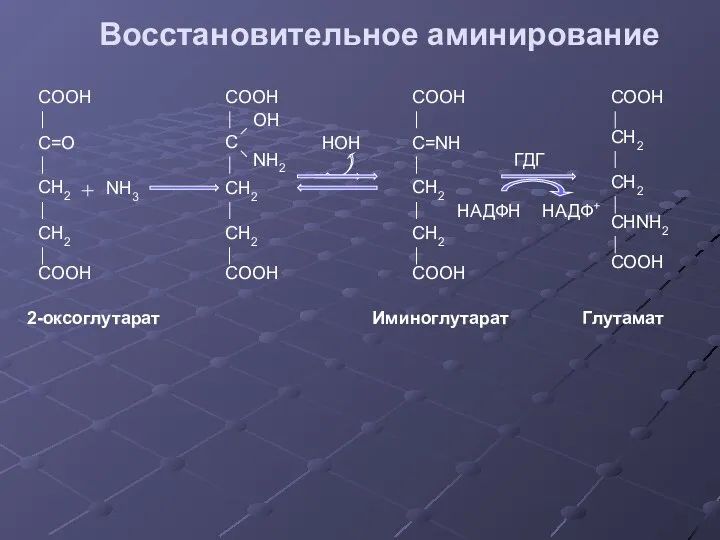
- 28. Восстановительное аминирование COOH C=O CH2 CH2 COOH NH3 COOH C OH NH2 CH2 CH2 COOH COOH
- 29. Значение восстановительного аминирования: глутамат является источником аминогрупп для синтеза заменимых аминокислот служит одним из способов связывания
- 30. Источники аммиака : Реакции дезаминирования Образование в кишечнике в результате деятельности микрофлоры (гниение белков) Содержание аммиака
- 31. Причины токсичности аммиака 1) Легко проникает через клеточные мембраны 2) Связывается с 2-оксоглутаратом, что вызывает угнетение
- 32. Причины токсичности аммиака 4) образует ион NH4+, накопление которого нарушает проведение нервного импульса 5) сдвигает рН
- 33. Обезвреживание аммиака COOH CH2 CH2 CHNH2 COOH Глутамат CO NH2 CH2 CH2 CHNH2 COOH NH3 АТФ
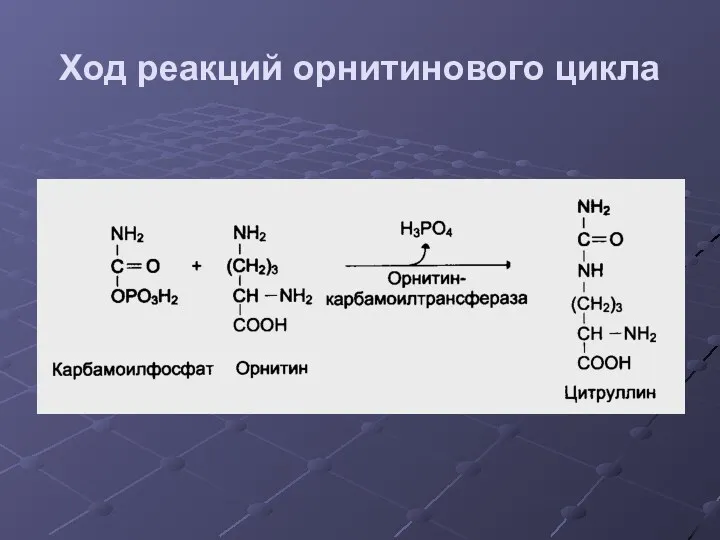
- 34. Ход реакций орнитинового цикла
- 35. Ход реакций орнитинового цикла
- 36. Ход реакций орнитинового цикла
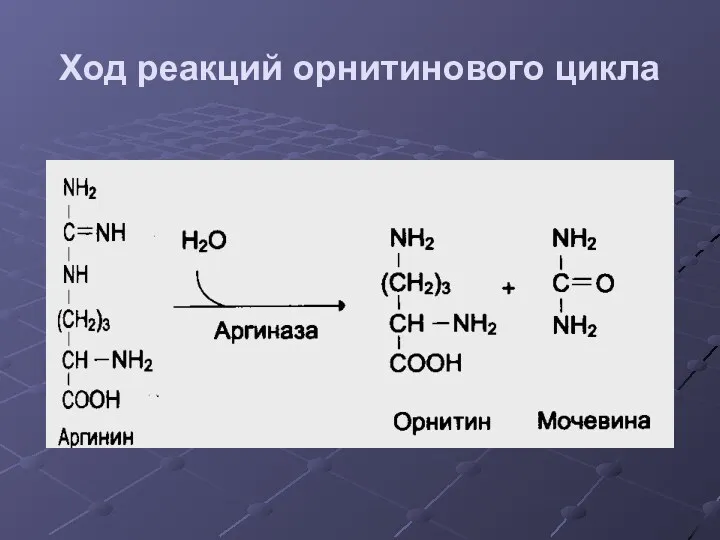
- 37. Ход реакций орнитинового цикла
- 38. Ход реакций орнитинового цикла
- 39. Суммарное уравнение синтеза мочевины: CO2 + NH3 + Аспартат + 3 АТФ + 2H2O = Мочевина
- 40. Классификация аминокислот по судьбе безазотистого остатка
- 41. Обмен ароматических аминокислот Йодтиронины гидроксилаза фенилаланин тирозин ДОФА меланин фенилпируват гидроксифенил- катехоламины пируват (А, НА, ДА)
- 42. Синтез креатина В почках: Аргинин + Глицин Орнитин + Гликоциамин Глицинамидино- трансфераза
- 43. Синтез креатина В печени: Гликоциамин Креатин Метилтрансфераза S-AM S-АГ
- 44. Синтез креатина В мышцах: в покое Креатин + АТФ креатинкиназа при сокращении Креатинфосфат + АДФ
- 45. Метаболизм креатинфосфата Креатинфосфат Креатинин - H3PO4
- 46. Диагностическое значение: 1. Определение содержания креатина и креатинина в крови и моче используется для характеристики: а)
- 48. Скачать презентацию

































 Класс Двустворчатые моллюски
Класс Двустворчатые моллюски Строение и функции головного мозга
Строение и функции головного мозга Методы изучения природы
Методы изучения природы Курс общей биологии (размножение организмов)
Курс общей биологии (размножение организмов) Селекция
Селекция Розмноження на клітинному рівні. (Лекція 3)
Розмноження на клітинному рівні. (Лекція 3) Животные красной книги. Манул
Животные красной книги. Манул Биогенные элементы. Классификация. Топография биогенных элементов в организме человека
Биогенные элементы. Классификация. Топография биогенных элементов в организме человека Investigate DNA Extraction
Investigate DNA Extraction Молекулярно-генетические методы. Основы ПЦР
Молекулярно-генетические методы. Основы ПЦР Өсімдіктерден экономикалық маңызды заттарды өндірудің клеткалық технологиялары
Өсімдіктерден экономикалық маңызды заттарды өндірудің клеткалық технологиялары Презентация Костные рыбы (содержит видеофайл)
Презентация Костные рыбы (содержит видеофайл) Вирусология и открытие вирусов
Вирусология и открытие вирусов Зерновые в культуре стран: от Древности до наших дней
Зерновые в культуре стран: от Древности до наших дней Социальное партнёрство в профориентационном воспитании при изучении биологии
Социальное партнёрство в профориентационном воспитании при изучении биологии Гориллы
Гориллы Популяционная организация и динамика численности
Популяционная организация и динамика численности Эмбриология человека
Эмбриология человека Основы разведения животных
Основы разведения животных Помидор – полезный овощ. 2 класс
Помидор – полезный овощ. 2 класс Рослинний і тваринний світ України
Рослинний і тваринний світ України Синтез белка
Синтез белка Викторина Неделя леса - Сахаинский лес
Викторина Неделя леса - Сахаинский лес Отряды насекомых
Отряды насекомых Как растут фрукты
Как растут фрукты Чому мігруюють тварини
Чому мігруюють тварини Защитные функции крови
Защитные функции крови Среда обитания
Среда обитания