Содержание
- 2. Биофизические исследования начинаются с физической постановки задачи, относящейся к живой природе, и должны формулироваться исходя из
- 3. Основные признаки живой материи Питание Дыхание Раздражимость Подвижность Выделение Размножение Рост. Объекты неживой природы растут за
- 4. Задачи биофизики: Раскрытие общих закономерностей поведения открытых неравновесных систем. Теоретическое обоснование термодинамических основ жизни. Научное объяснение
- 5. Разделы биофизики: Молекулярная биофизика изучает строение и физико-химические свойства, биофизику молекул. Биофизика клетки изучает особенности строения
- 6. Молекулярная биофизика – часть биологической физики, основными объектами изучения которой являются биологические полимеры – белки, нуклеиновые
- 7. Изучение взаимодействия биополимеров друг с другом, с малыми молекулами и ионами: хранение и передача наследственной информации,
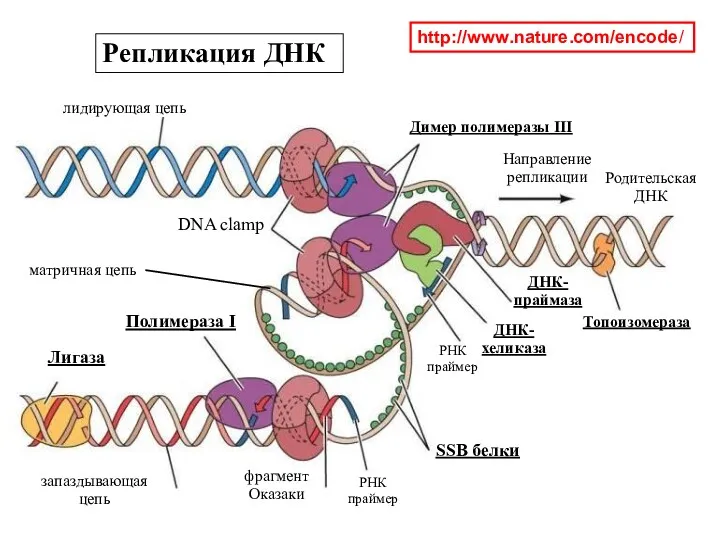
- 8. http://www.nature.com/encode/
- 9. Для осуществления всех перечисленных процессов необходимо создание определенных, биологически функциональных или нативных структур биополимеров, устойчивость нативных
- 10. Эрвин Шредингер «Что такое жизнь? Физический аспект живой клетки» «Мы вынуждены принять, что собственно биологические закономерности
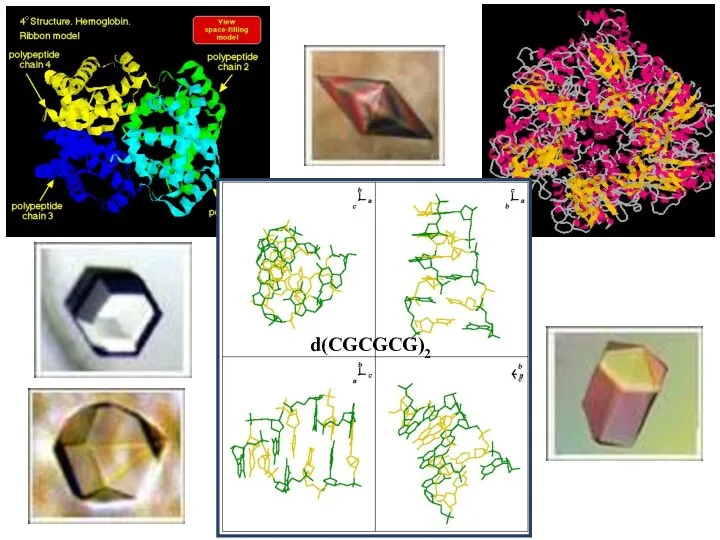
- 11. d(CGCGCG)2
- 12. Молекулярная физика Основные задачи: Определение строения вещества на атомном и молекулярном уровнях 2. Исследование равновесных систем
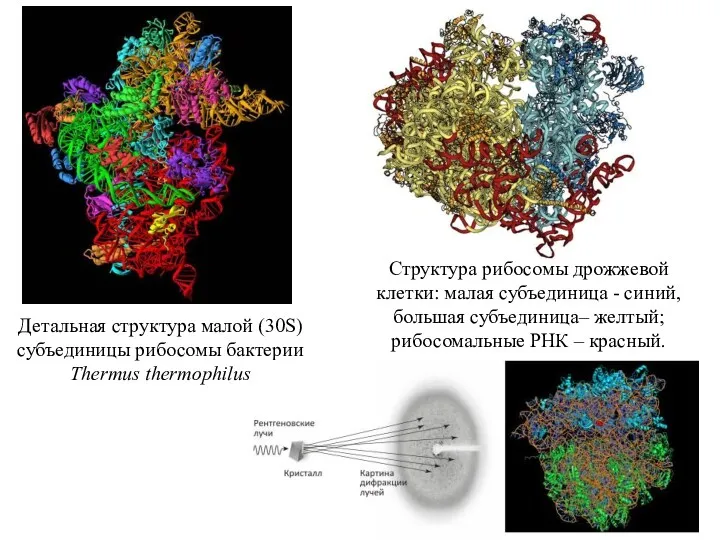
- 13. Детальная структура малой (30S) субъединицы рибосомы бактерии Thermus thermophilus Структура рибосомы дрожжевой клетки: малая субъединица -
- 14. Система - это совокупность материальных объектов, ограниченных каким-либо образом от окружающей среды. Изолированные системы. Закрытые системы.
- 15. Энергия (U, E, F, G, ΔU, dU, ΔE, dE, ΔF, dF, ΔG, dG) – количественная мера
- 16. Работа (A, ΔA, dA) – мера превращения энергии из одной формы в другую. Численно работа равна
- 17. Тепловая энергия – сумма кинетической энергии теплового, хаотического движения атомов и молекул вещества. Показатель теплового движения
- 18. Механическая энергия – форма энергии, характеризующая движения макротел и способность совершать механическую работу по перемещению макротел.
- 19. Первый закон термодинамики Общая сумма энергии материальной системы остается постоянной величиной независимо от изменений, происходящих в
- 20. Внутренняя энергия (U, ΔU, dU) – это общая сумма всех видов энергии в данной системе (тепловой,
- 21. Первый закон термодинамики: Изменение внутренней энергии системы ΔU равно алгебраической сумме тепла, переданного в процессе ΔQ,
- 22. Полное теплосодержание системы – энтальпия (H, ΔH, dH) – мера изменения теплоты системы, соответствует теплообмену при
- 23. Все виды работы, совершаемые в живом организме, совершаются за счет энергии АТФ. АТФ – это универсальный
- 24. Прямая калориметрия - непосредственное измерение количества тепла, выделенного организмом Непрямая калориметрия - непрямое определение тепло-образования в
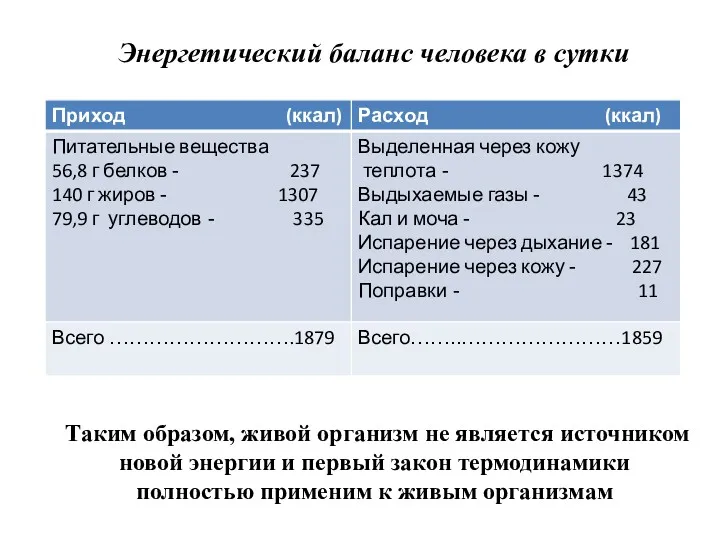
- 25. Энергетический баланс человека в сутки Таким образом, живой организм не является источником новой энергии и первый
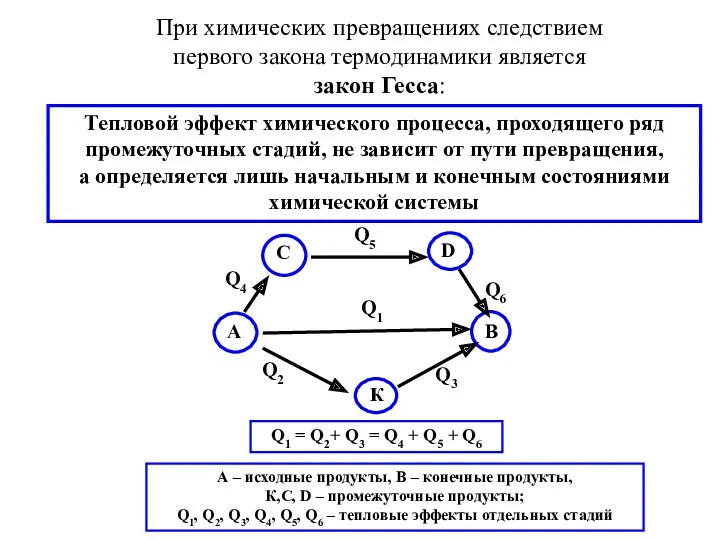
- 26. При химических превращениях следствием первого закона термодинамики является закон Гесса: Тепловой эффект химического процесса, проходящего ряд
- 27. Первый закон термодинамики Общая сумма энергии материальной системы остается постоянной величиной независимо от изменений, происходящих в
- 28. Первый закон термодинамики: определяет количественные соотношения между различными формами энергии, которые принимают участие в определенном процессе;
- 29. Свободная энергия, энтропия
- 30. Термодинамическое равновесие Обратимый процесс Необратимый процесс
- 31. Свободная энергия G – это способность системы совершать работу Свободная энергия определяется как G = U
- 32. Градиент Г какого-либо параметра представляет собой отношение разности его значений в двух точках ΔI к расстоянию
- 33. Второй закон термодинамики устанавливает критерий, отражающий одностороннюю направленность необратимых (неравновесных) процессов независимо от их конкретной природы.
- 34. Изменение энтропии ΔS определяется как отношение суммарного значения поглощенных системой теплоты к температуре системы Q/T: ΔS
- 35. Формулировка второго закона термодинамики: Любой самопроизвольный процесс в изолированной системе приводит к уменьшению свободной энергии, если
- 36. 3. Энтропия - мера упорядоченности системы S=klnW - уравнение Планка-Больцмана где S - энтропия, k -
- 38. Термодинамическая вероятность W – это количество микросостояний, возможных в пределах данного макросостояния. Величина W непосредственно связана
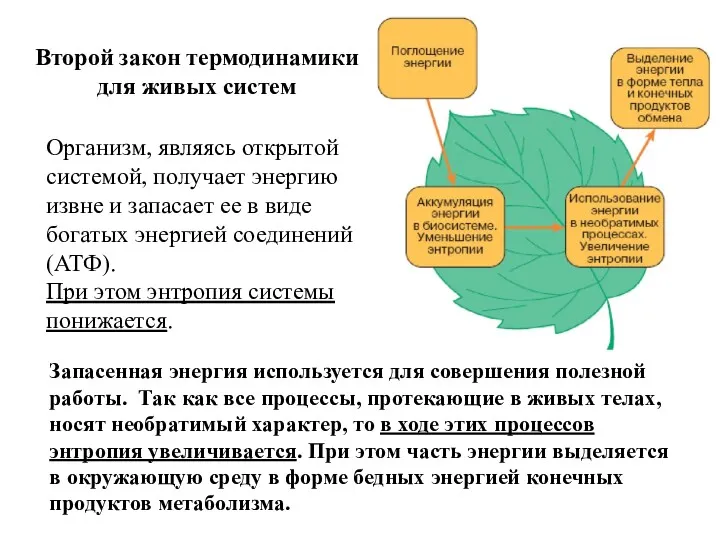
- 39. Организм, являясь открытой системой, получает энергию извне и запасает ее в виде богатых энергией соединений (АТФ).
- 40. Общее изменение энтропии dS открытой системы может происходить независимо либо за счет процессов обмена с внешней
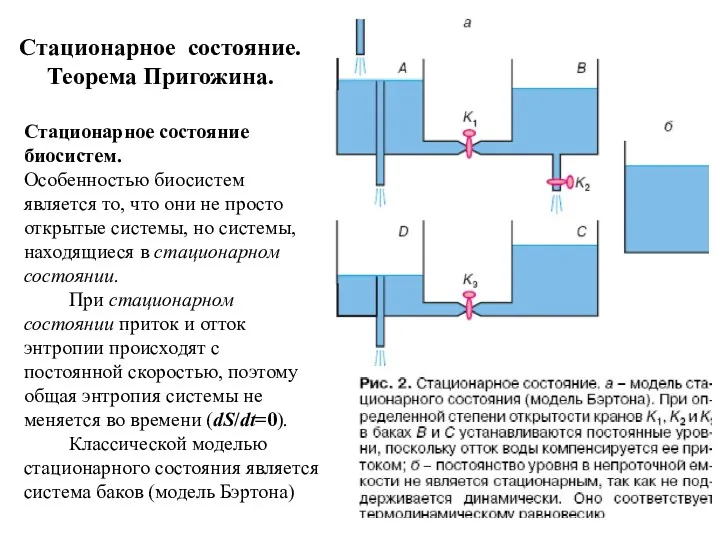
- 41. Стационарное состояние. Теорема Пригожина. Стационарное состояние биосистем. Особенностью биосистем является то, что они не просто открытые
- 42. В стационарном состоянии скорость возрастания энтропии, обусловленного протеканием необратимых процессов, имеет положительное и минимальное из возможных
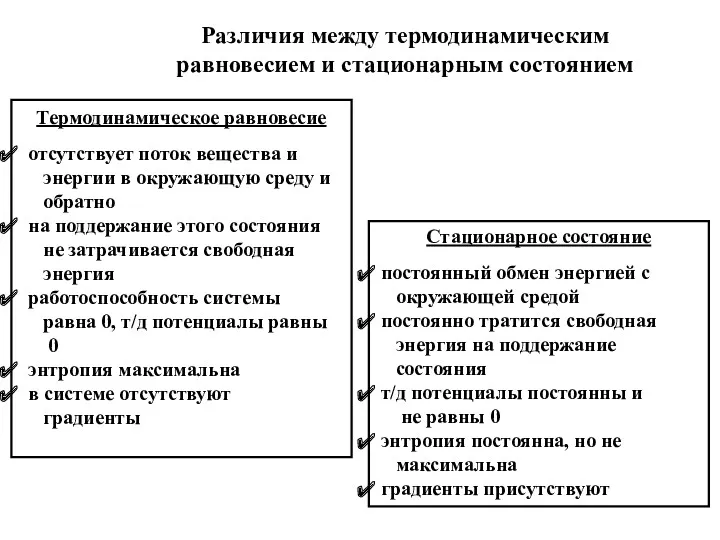
- 43. Термодинамическое равновесие отсутствует поток вещества и энергии в окружающую среду и обратно на поддержание этого состояния
- 45. Скачать презентацию

































 Виділення, його значення для організму. Органи виділення тварин
Виділення, його значення для організму. Органи виділення тварин Место животных в системе живого мира
Место животных в системе живого мира Генотип, как целостная система. Взаимодействие генов
Генотип, как целостная система. Взаимодействие генов Нервная регуляция функций
Нервная регуляция функций Исчезающие виды животных
Исчезающие виды животных Животные Азии
Животные Азии Что растёт на подоконнике
Что растёт на подоконнике Тип хордовые. Подтип черепные. Классы рыб
Тип хордовые. Подтип черепные. Классы рыб Презентация Опорно-двигательная система
Презентация Опорно-двигательная система Дополнительная презентация Что такое фитодизайн?к элективному курсу Основы фитодизайна, 9 класс
Дополнительная презентация Что такое фитодизайн?к элективному курсу Основы фитодизайна, 9 класс Молекулярный уровень организации живой материи
Молекулярный уровень организации живой материи Миазы. Классификация
Миазы. Классификация Строение и значение кожи
Строение и значение кожи Среды обитания организмов
Среды обитания организмов Классификация и многообразие представителей надкласса Шестиногие
Классификация и многообразие представителей надкласса Шестиногие Жизненный цикл клетки
Жизненный цикл клетки Доказательства эволюции
Доказательства эволюции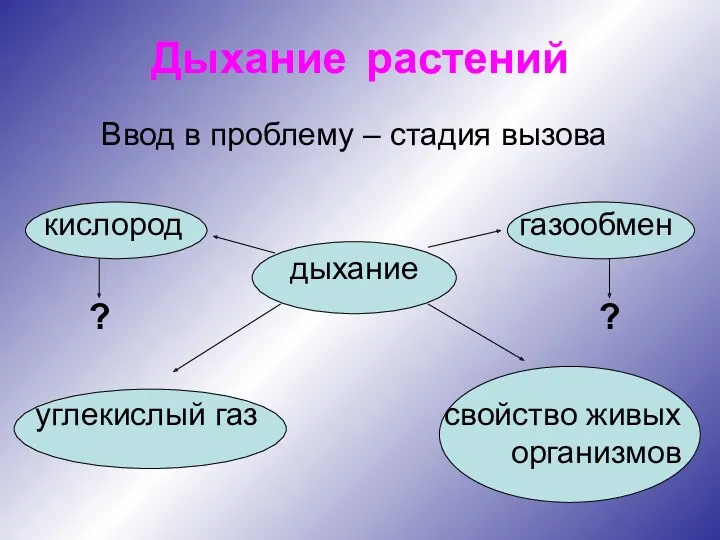 Дыхание растений
Дыхание растений Конспект урока и презентация Внешнее строение листа
Конспект урока и презентация Внешнее строение листа Тема 1.1. Предмет і методи біомеханіки
Тема 1.1. Предмет і методи біомеханіки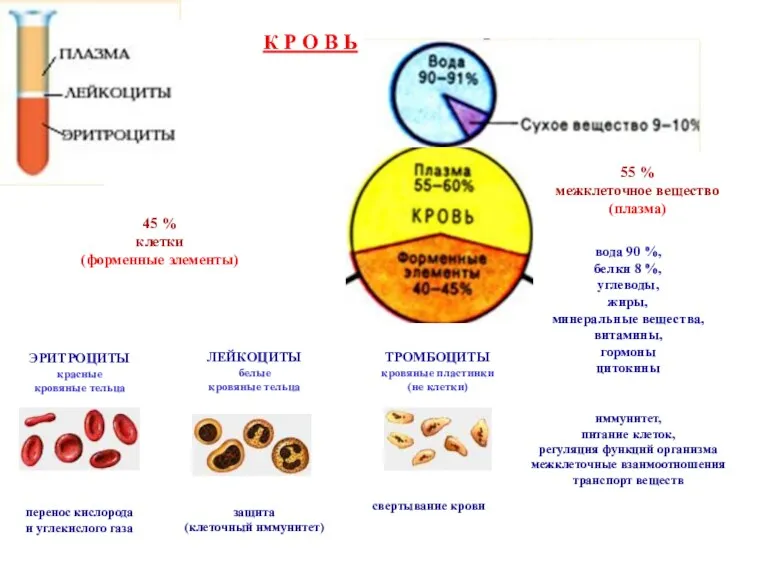 Кровь
Кровь Видоизменения побегов
Видоизменения побегов Нуклеиновые кислоты и белки
Нуклеиновые кислоты и белки Строение тела человека и его функциональные системы
Строение тела человека и его функциональные системы Класс двудольные.Семейство пасленовые
Класс двудольные.Семейство пасленовые Водоросли. Зеленые водоросли
Водоросли. Зеленые водоросли Грибы - двойники. Как отличить ложные грибы двойники от съедобных?
Грибы - двойники. Как отличить ложные грибы двойники от съедобных? Витамины и их влияние на организм человека
Витамины и их влияние на организм человека