Содержание
- 2. План лекции 1. Определение понятия КОС. Биологическое значение. Основные принципы регуляции КОС: изоосмолярность, электронейтральность, постоянство рН.
- 3. Определение понятия Современное название КОС (кислотно-основное состояние) - относительное постоянство реакции внутренней среды организма, количественно характеризующееся
- 4. Концентрацию Н+ выражают с помощью величины рН - отрицательного десятичного логарифма концентрации ионов Н+. Кислоты Основания
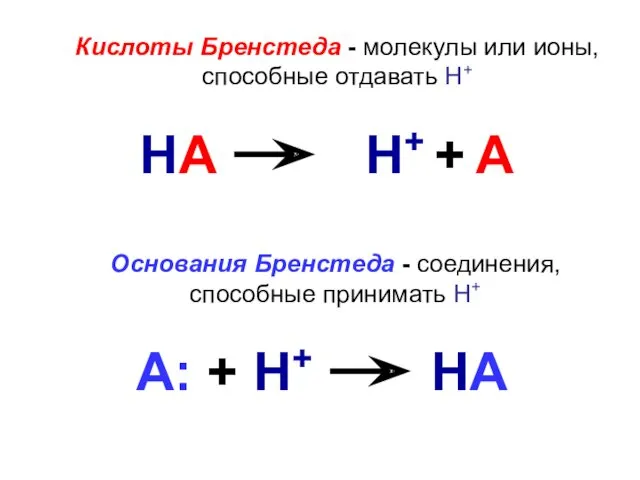
- 5. Кислоты Бренстеда - молекулы или ионы, способные отдавать Н+ Основания Бренстеда - соединения, способные принимать Н+
- 6. Биологическое значение регуляции КОС Н+ Н Н Н Н - - - - + 1. Н+,
- 7. Источники кислот и оснований в организме Кислоты > Основания Экзогенное происхождение (пища) Эндогенное происхождение (метаболизм) Уксус,
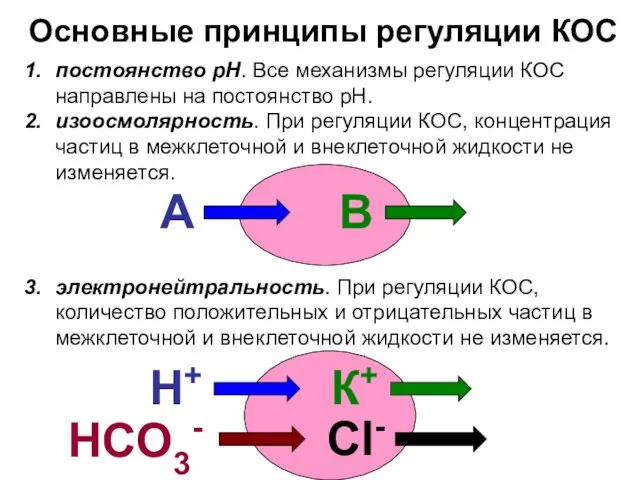
- 8. Основные принципы регуляции КОС постоянство рН. Все механизмы регуляции КОС направлены на постоянство рН. изоосмолярность. При
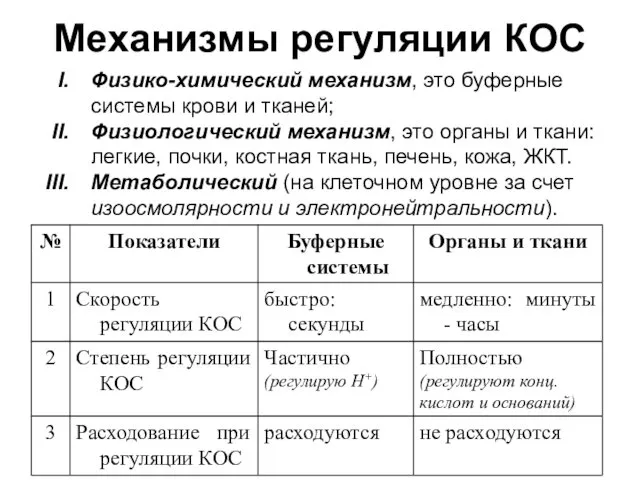
- 9. Механизмы регуляции КОС Физико-химический механизм, это буферные системы крови и тканей; Физиологический механизм, это органы и
- 10. I. Физико-химические механизмы регуляции КОС При работе буферной системы один из ее компонентов расходуется и требует
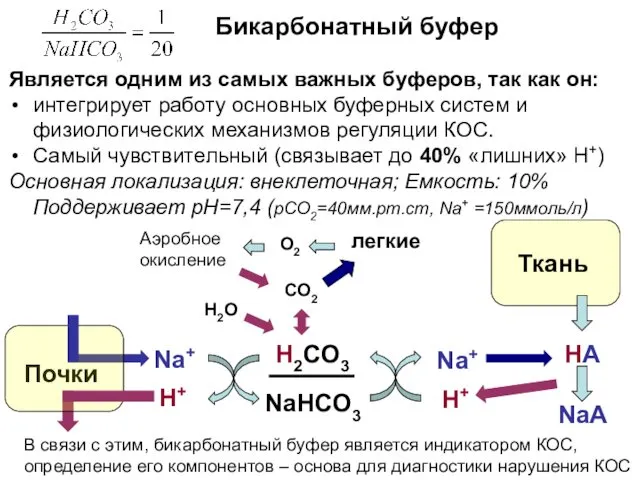
- 11. Бикарбонатный буфер Является одним из самых важных буферов, так как он: интегрирует работу основных буферных систем
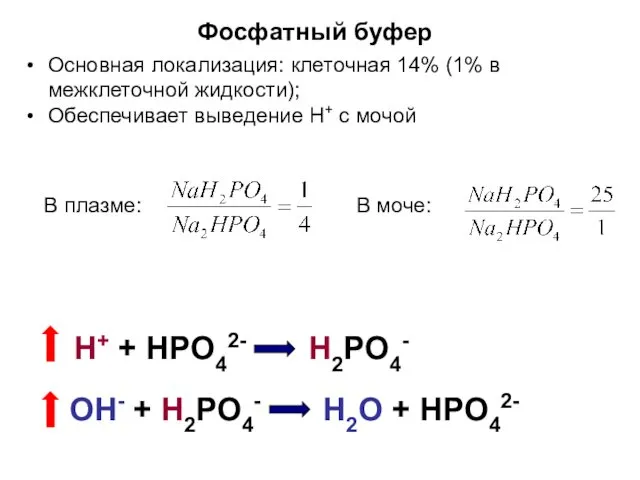
- 12. Фосфатный буфер Основная локализация: клеточная 14% (1% в межклеточной жидкости); Обеспечивает выведение Н+ с мочой Н+
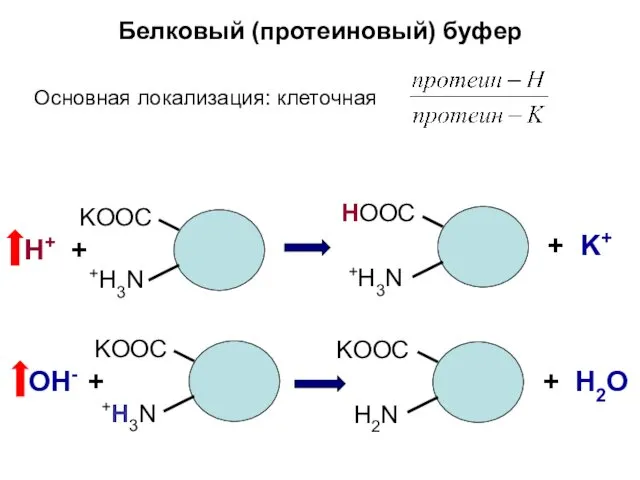
- 13. Белковый (протеиновый) буфер Основная локализация: клеточная KООС +H3N Н+ + HООС +H3N KООС +H3N OН- +
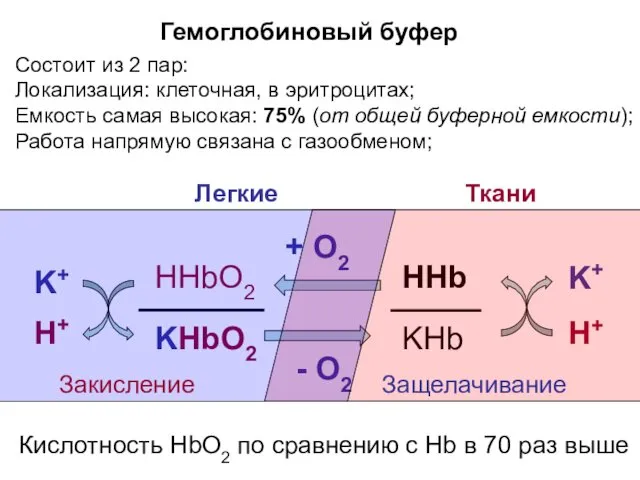
- 14. Гемоглобиновый буфер Состоит из 2 пар: Локализация: клеточная, в эритроцитах; Емкость самая высокая: 75% (от общей
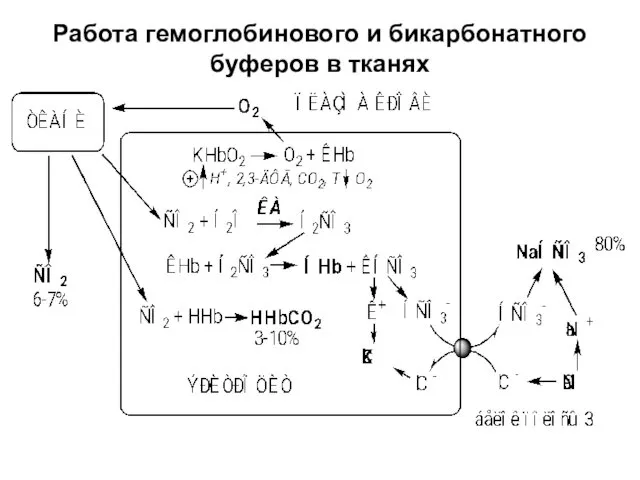
- 15. Работа гемоглобинового и бикарбонатного буферов в тканях
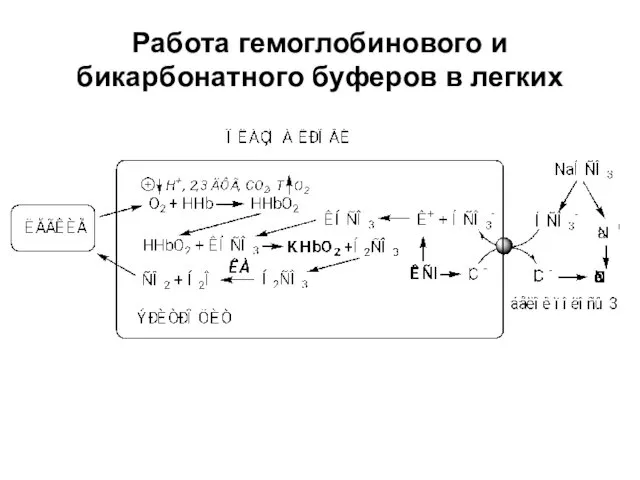
- 16. Работа гемоглобинового и бикарбонатного буферов в легких
- 17. II. Физиологические механизмы регуляции КОС В ходе метаболизма в организме образуются: летучие кислоты (Н2СО3) и основания
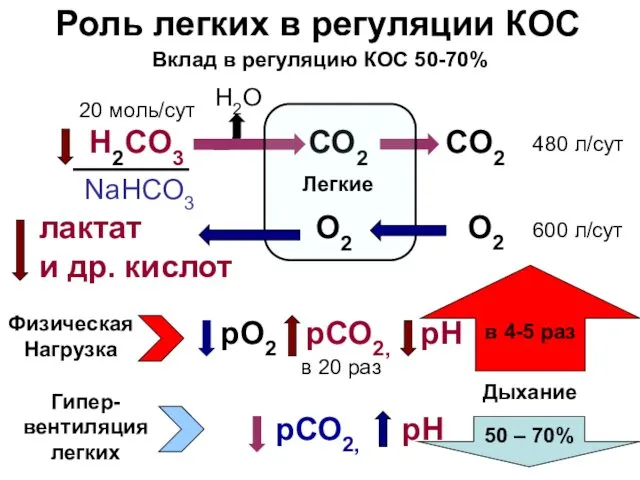
- 18. Роль легких в регуляции КОС H2CO3 CO2 CO2 480 л/сут 20 моль/сут NaHСO3 в 4-5 раз
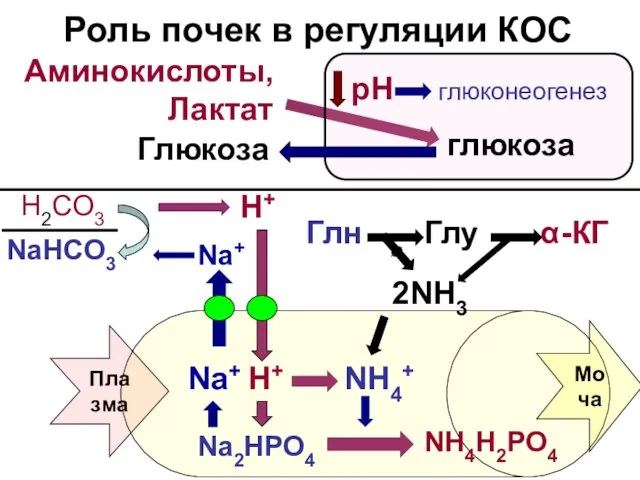
- 19. $ Роль почек в регуляции КОС Аминокислоты, Лактат глюкоза рН глюконеогенез Глюкоза H+ Na+ Плазма 2NH3
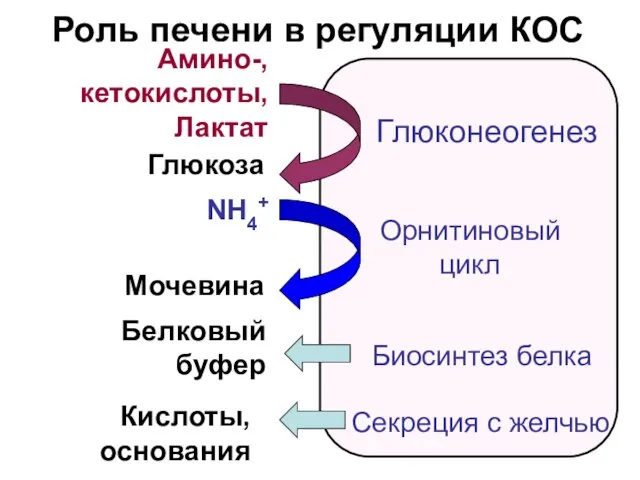
- 20. Роль печени в регуляции КОС Амино-, кетокислоты, Лактат Глюкоза NH4+ Мочевина Глюконеогенез Орнитиновый цикл Биосинтез белка
- 21. Роль ЖКТ в КОС H+ Пища HCl Кал Cl- HСO3- H2CO3 Желудок Кишечник Защелачивание Cl- Cl-
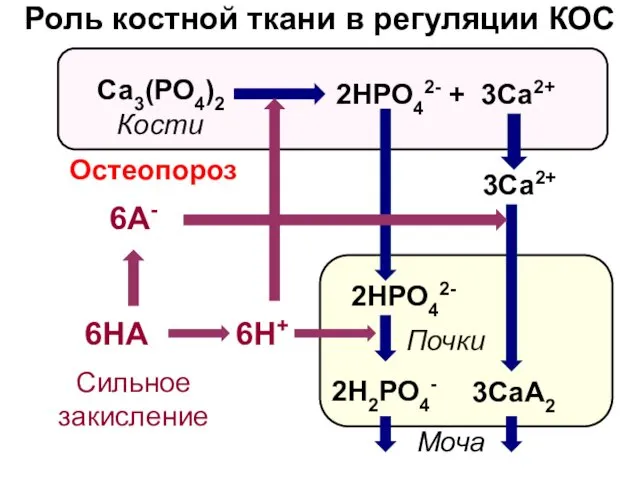
- 22. Роль костной ткани в регуляции КОС Почки Са3(РО4)2 2HРО42- + 3Са2+ 6H+ 2HРО42- 2H2РО4- 3Са2+ 3СаA2
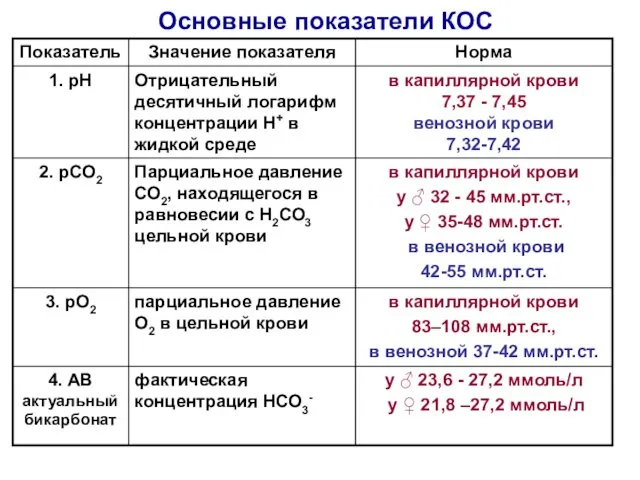
- 23. Основные показатели КОС
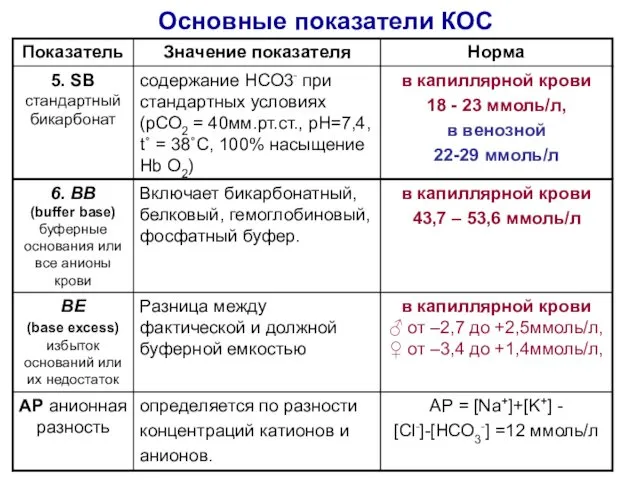
- 24. Основные показатели КОС
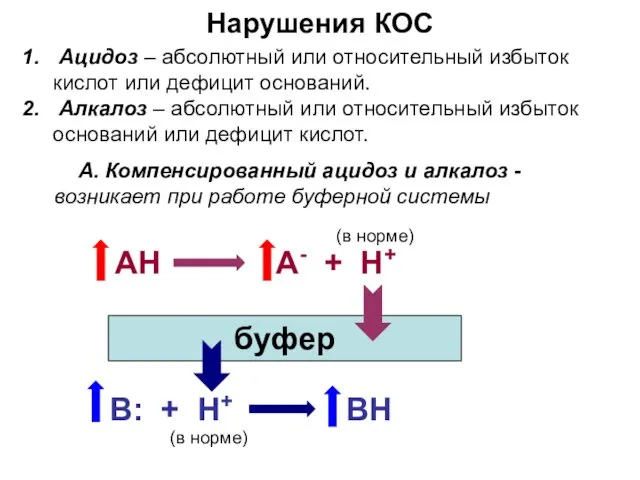
- 25. Нарушения КОС Ацидоз – абсолютный или относительный избыток кислот или дефицит оснований. Алкалоз – абсолютный или
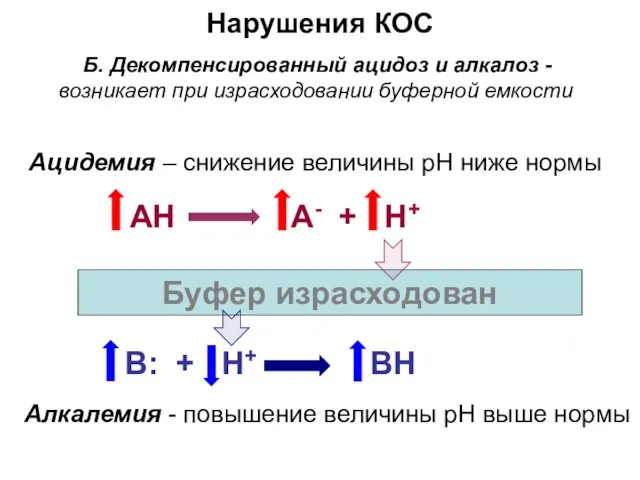
- 26. Нарушения КОС Б. Декомпенсированный ацидоз и алкалоз -возникает при израсходовании буферной емкости АH А- + H+
- 27. Усиление дыхания до резкой отдышки, нарушение дыхания в результате бронхоспазма; Нарушение работы сердечно-сосудистой системы. Слабая ацидемия
- 28. При алкалемии возникает: подавление дыхания. повышение нервно-мышечной возбудимости, тетания (снижение в плазме крови Са2+). нарушение работы
- 29. Нарушения КОС По изменению концентраций в крови СО2 и НСО3- Газовые Негазовые По происхождению кислот и
- 30. Газовый (дыхательный) ацидоз затруднение выделения СО2 при нарушениях внешнего дыхания высокая концентрация СО2 в окружающей среде
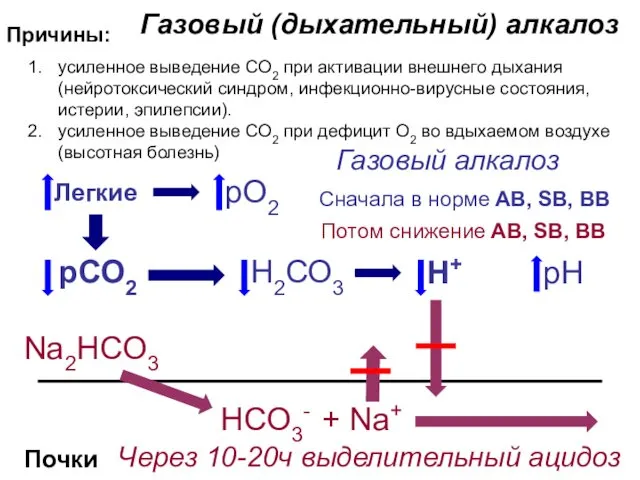
- 31. Газовый (дыхательный) алкалоз Причины: рСО2 Н2СО3 рН Почки Сначала в норме AB, SB, BB Потом снижение
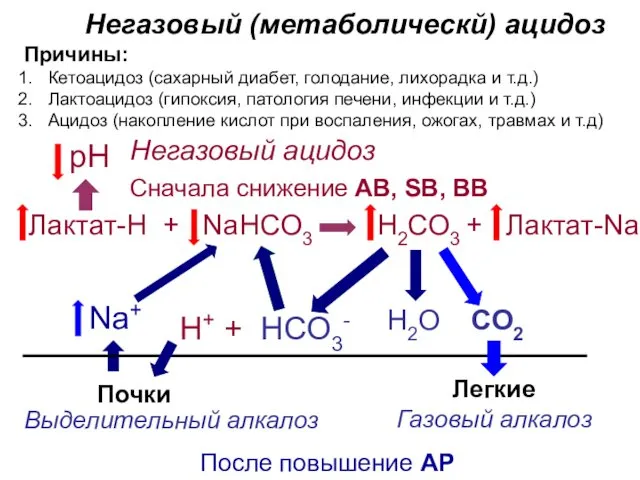
- 32. Негазовый (метаболическй) ацидоз Причины: Н2О СО2 Н2СО3 + Лактат-Na рН Почки Na+ Сначала снижение AB, SB,
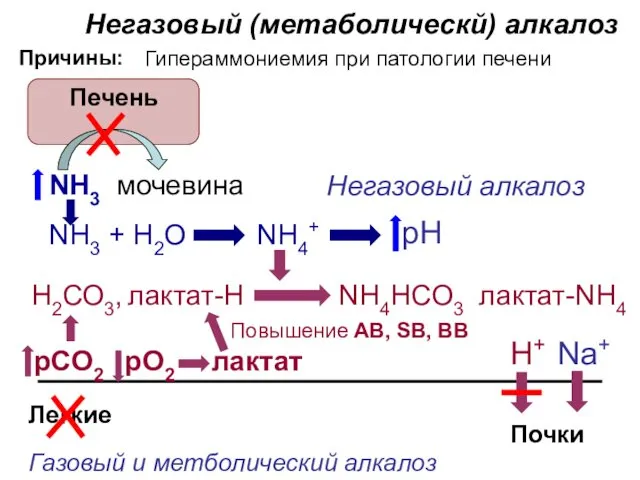
- 33. Негазовый (метаболическй) алкалоз Причины: Печень Повышение AB, SB, BB Газовый и метболический алкалоз Негазовый алкалоз Гипераммониемия
- 35. Скачать презентацию












 Тип Членистоногие. Класс Паукообразные
Тип Членистоногие. Класс Паукообразные Черепные нервы
Черепные нервы Плесневые грибы
Плесневые грибы Чарльз Дарвин. Эволюция
Чарльз Дарвин. Эволюция Тип плоские черви
Тип плоские черви Строение эукариотической клетки
Строение эукариотической клетки Класс насекомые
Класс насекомые Основные классические фундаментальные разделы физиологии растений
Основные классические фундаментальные разделы физиологии растений Animal’s world
Animal’s world Лікарська сировина тваринного походження
Лікарська сировина тваринного походження Мы из Красной книги. Викторина
Мы из Красной книги. Викторина Основы медицинской паразитологии
Основы медицинской паразитологии Кожно-двигательный, зрительный, слуховой,вестибулярный, обонятельный и вкусовой анализаторы
Кожно-двигательный, зрительный, слуховой,вестибулярный, обонятельный и вкусовой анализаторы Половая система
Половая система Кивсяк гигантский
Кивсяк гигантский Savannah - animals
Savannah - animals Эндокринная система
Эндокринная система Гаметогенез, оплодотворение
Гаметогенез, оплодотворение Использование интеллект-карт в проектной деятельности
Использование интеллект-карт в проектной деятельности Расширенный материал по лекциям углеводы биоэнергетика
Расширенный материал по лекциям углеводы биоэнергетика Эмоции. Сон. Интегративные механизмы мозга
Эмоции. Сон. Интегративные механизмы мозга Основные понятия генетики
Основные понятия генетики Генетична рівновага в популяціях і її порушення
Генетична рівновага в популяціях і її порушення Огород на подоконнике
Огород на подоконнике Ягоды. Кроссворд
Ягоды. Кроссворд Подготовка к ЕГЭ по биологии
Подготовка к ЕГЭ по биологии Эмбриональное развитие организмов
Эмбриональное развитие организмов Науково-технічні засоби в експертній практиці: актуальні питання та концептуальні засади
Науково-технічні засоби в експертній практиці: актуальні питання та концептуальні засади