Содержание
- 2. Актуальность темы: Механизмы взаимодействия клеток друг с другом и с окружающей средой (гормоны, лекарственные препараты) невозможно
- 3. Цели лекции Знать: 1. Строение биологических мембран и их роль в обмене веществ и энергии. 2.
- 4. План лекции 1. Общая характеристика мембран. Строение и состав мембран. 2. Транспорт веществ через мембраны. 3.
- 5. Функции мембран: • отделяют клетки от окружающей среды и делят ее на компартменты (отсеки); • регулируют
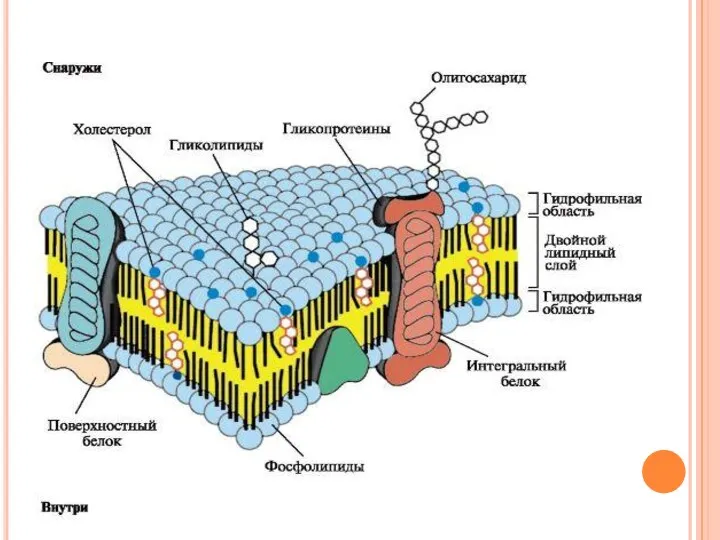
- 6. Строение мембран Биологические мембраны построены из липидов и белков, связанных друг с другом с помощью нековалентных
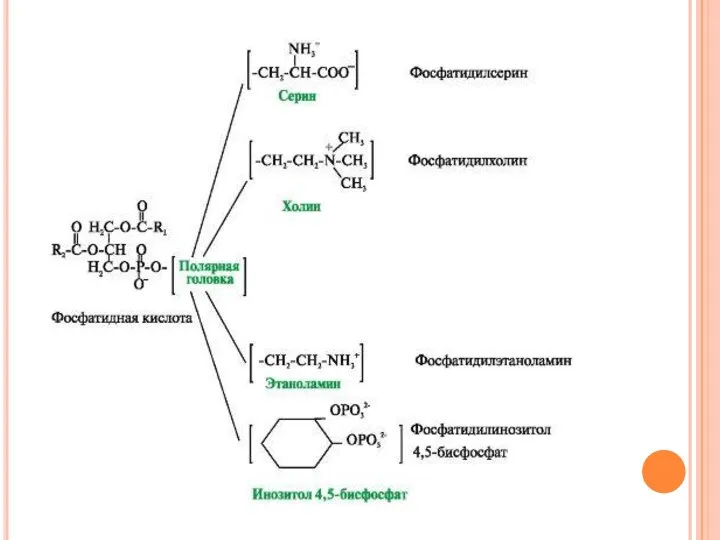
- 8. Липиды мембран. В мембранах присутствуют липиды трех главных типов - фосфолипиды, гликолипиды и холестерол. Чаще всего
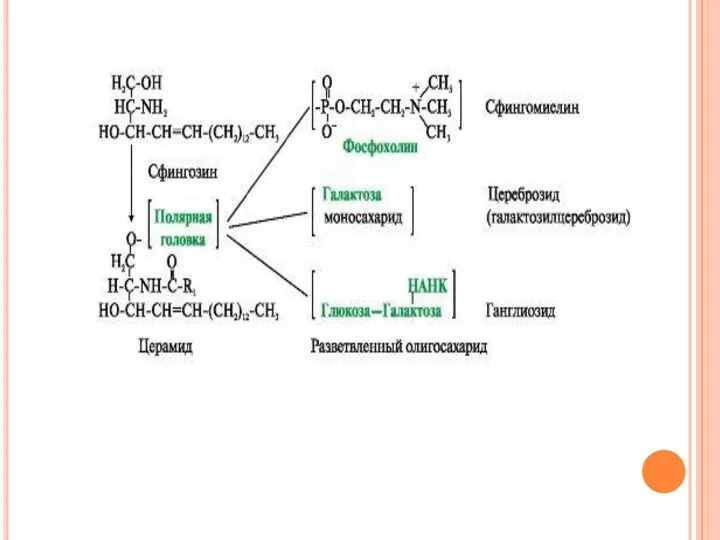
- 10. Существуют также липиды - производные аминоспирта сфингозина. В зависимости от строения полярной «головки» эти производные разделены
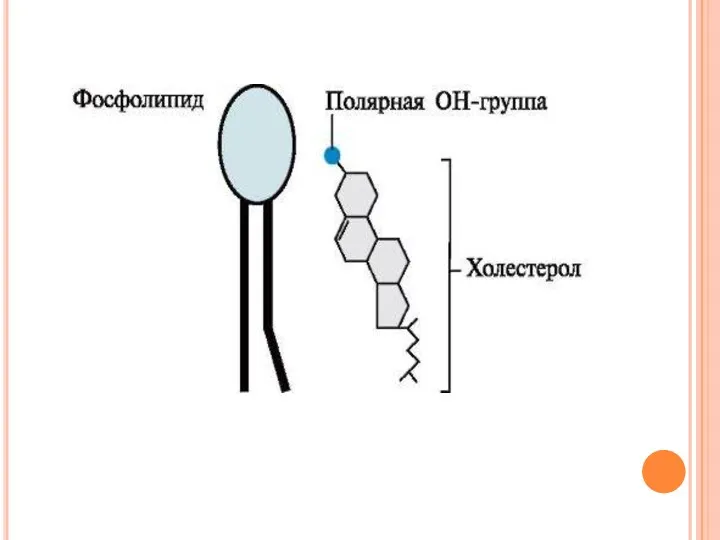
- 12. Холестерол содержится в мембранах всех животных клеток, он придает мембранам жесткость и снижает их жидкостность (текучесть).
- 14. Роль холестерола в мембранах Молярное соотношение холестерола и других липидов в мембранах равно 0,3-0,9. Самое высокое
- 15. функции липидов мембран • формируют липидный бислой - структурную основу мембран; • обеспечивают необходимую для функционирования
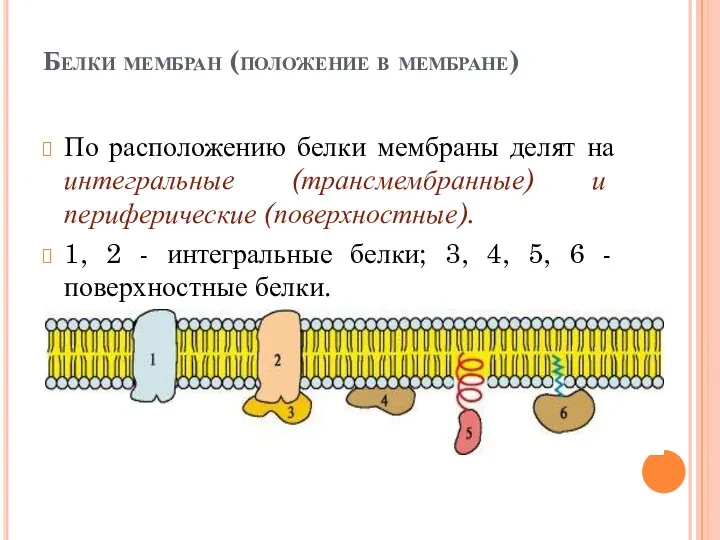
- 16. Белки мембран (положение в мембране) По расположению белки мембраны делят на интегральные (трансмембранные) и периферические (поверхностные).
- 17. Поверхностные белки разными способами прикрепляются к мембране: 3 - связанные с интегральными белками; 4 - присоединенные
- 18. Белки мембран (функции) • избирательный транспорт веществ в клетку и из клетки; • передача гормональных сигналов;
- 19. ТРАНСПОРТ ВЕЩЕСТВ ЧЕРЕЗ МЕМБРАНЫ Транспорт ионов или органических молекул через каналы или белки-переносчики может проходить по
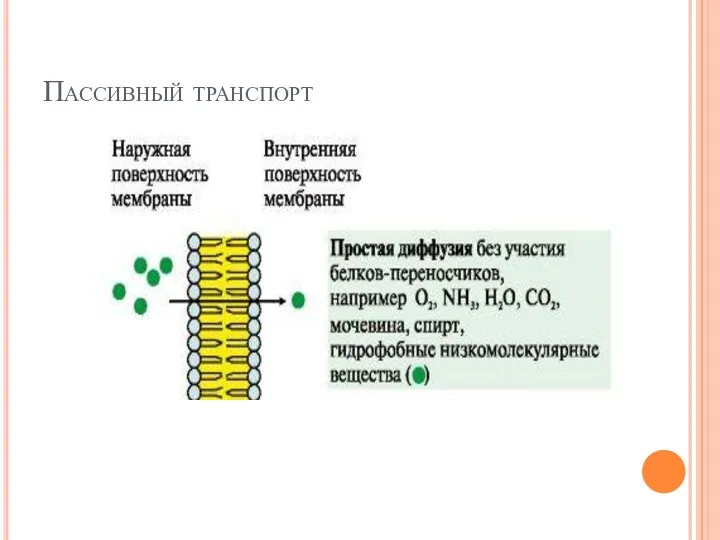
- 20. Пассивный транспорт
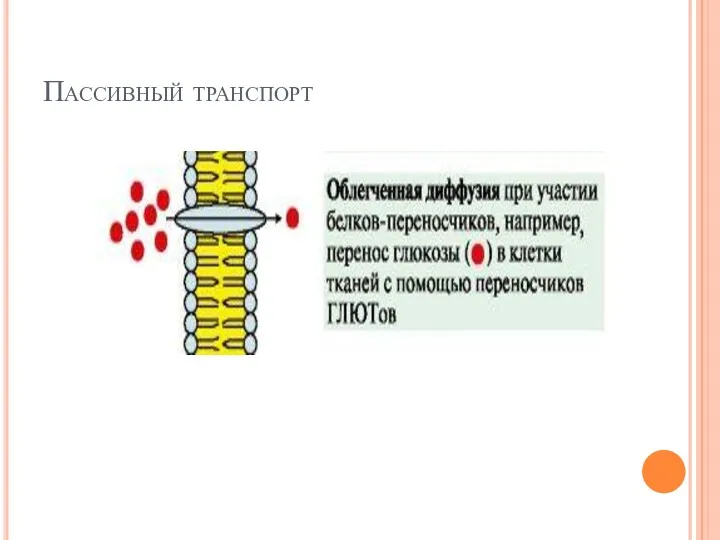
- 21. Пассивный транспорт
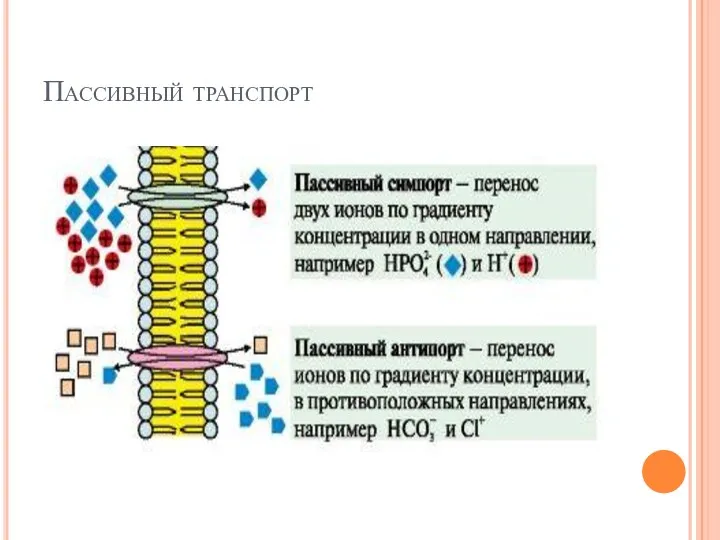
- 22. Пассивный транспорт
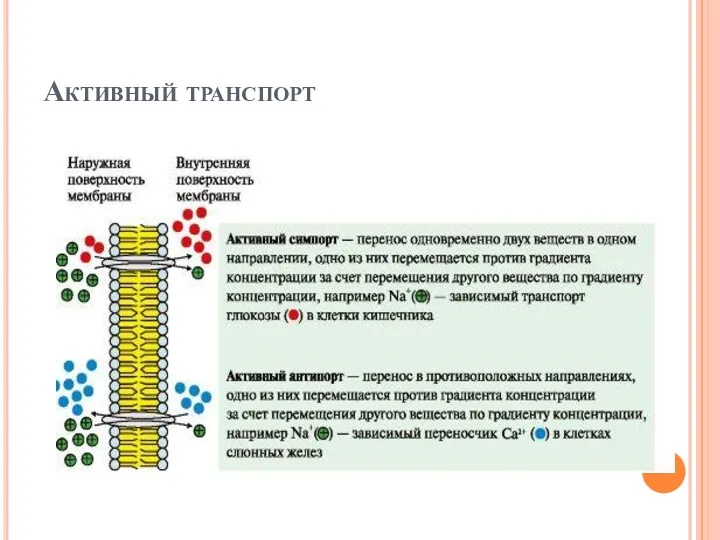
- 23. Активный транспорт Первично-активный транспорт происходит против градиента концентрации с затратой энергии АТФ при участии транспортных АТФаз,
- 24. Активный транспорт Вторично-активный транспорт происходит за счет градиента концентрации одного из переносимых веществ который создается чаще
- 25. Активный транспорт
- 26. Активный транспорт (эндо- и экзоцитоз) Перенос из внеклеточной среды в клетку макромолекул, например белков, нуклеиновых кислот,
- 27. Активный транспорт (эндо- и экзоцитоз) Макромолекулы, например пептидные гормоны, пищеварительные ферменты, белки внеклеточного матрикса, липопротеиновые комплексы,
- 28. ТРАНСМЕМБРАННАЯ ПЕРЕДАЧА СИГНАЛОВ Важное свойство мембран - способность воспринимать и передавать внутрь клетки сигналы из окружающей
- 29. Первичные мессенджеры Сигнальная молекула, специфически взаимодействующая с мембранным рецептором, называется первичным мессенджером. В качестве первичных мессенджеров
- 30. Рецепторы клеточной мембраны, активированные первичными мессенджерами, передают полученную информацию системе белков и ферментов, которые образуют каскад
- 31. Виды мембранных рецепторов
- 32. Мембранные рецепторы можно разделить на три группы: 1 - содержащие субъединицу, связывающую сигнальную молекулу и ионный
- 33. Вторичные мессенджеры Вторичные мессенджеры имеют небольшую молекулярную массу, быстро изменяют активность соответствующих белков, быстро расщепляются или
- 34. Альтернативные пути Существуют гормоны (стероидные и тиреоидные), которые, проходя липидный бислой, проникают в клетку и взаимодействуют
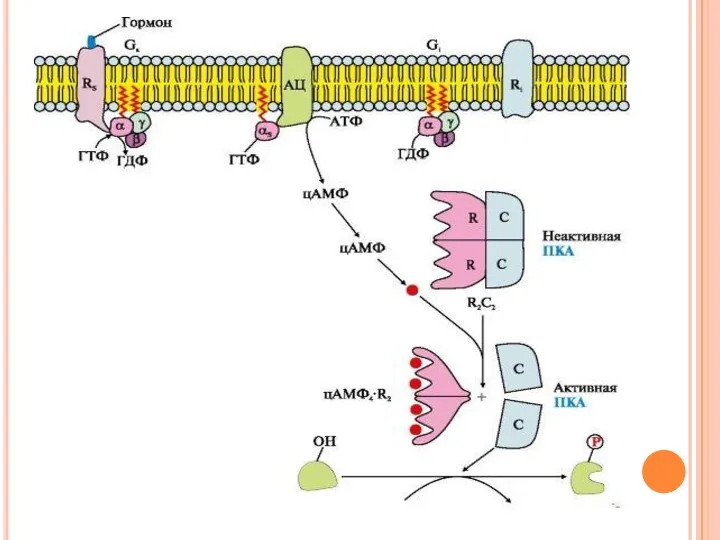
- 35. Последовательность событий передачи сигнала первичных мессенджеров с помощью аденилатциклазной системы Взаимодействие активатора аденилатциклазной системы, например гормона
- 36. Последовательность событий передачи сигнала первичных мессенджеров с помощью аденилатциклазной системы Взаимодействие α-субъединицы с регуляторным центром аденилатциклазы
- 37. Последовательность событий передачи сигнала первичных мессенджеров с помощью аденилатциклазной системы Молекулы цАМФ могут обратимо соединяться с
- 38. Последовательность событий передачи сигнала первичных мессенджеров с помощью аденилатциклазной системы Активная протеинкиназа А с помощью АТФ
- 40. Инактивация аденилатциклазы и протеинкиназы А α-субъединица в комплексе с ГТФ при взаимодействии с аденилатциклазой начинает проявлять
- 41. Инактивация аденилатциклазы и протеинкиназы А Фосфодиэстераза - «заякоренный» фермент цитоплазматической мембраны гидролизует образовавшиеся ранее молекулы цАМФ
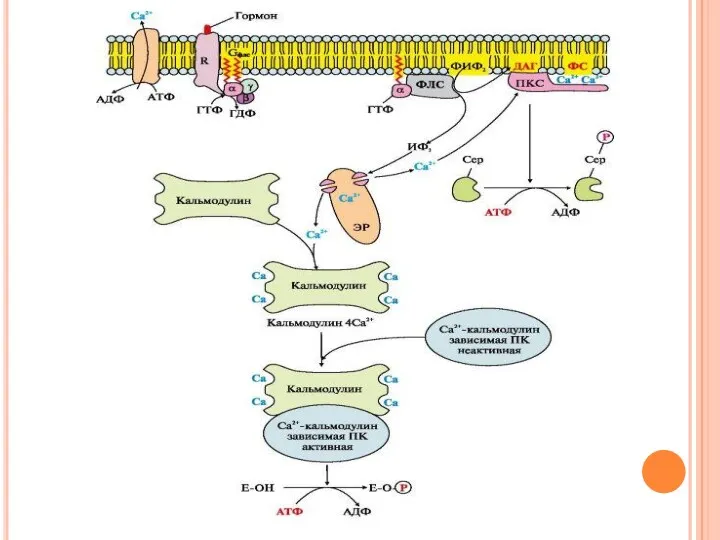
- 42. Инозитолфосфатная система Связывание активатора инозитолфосфатной системы с рецептором (R) приводит к изменению его конформации. Повышается сродство
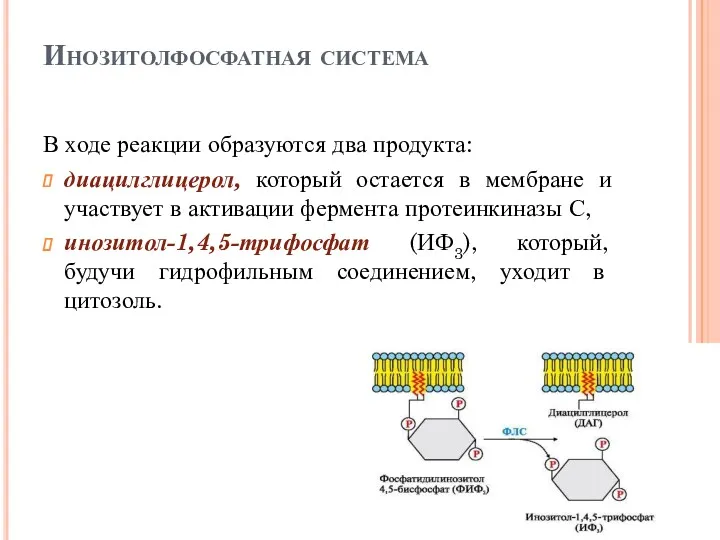
- 43. Инозитолфосфатная система В ходе реакции образуются два продукта: диацилглицерол, который остается в мембране и участвует в
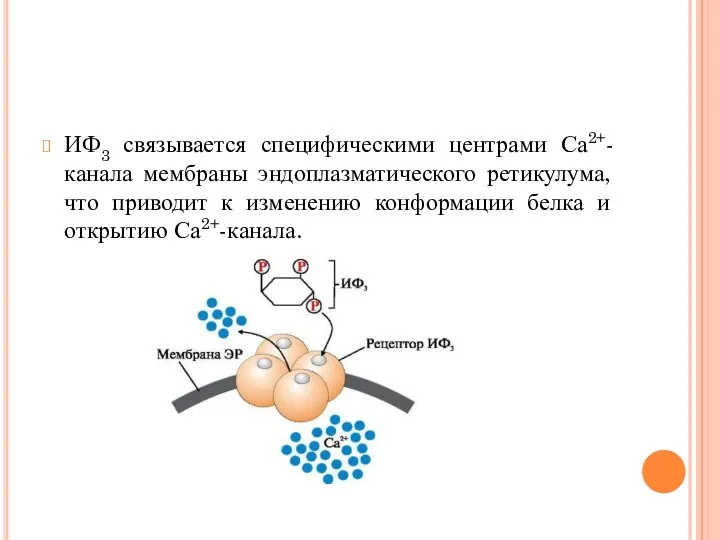
- 44. ИФ3 связывается специфическими центрами Са2+- канала мембраны эндоплазматического ретикулума, что приводит к изменению конформации белка и
- 45. Са2+ по градиенту концентрации поступает в цитозоль. В отсутствие ИФ3 в цитозоле канал закрыт. При повышении
- 46. Повышение концентрации Са2+ в цитозоле клетки увеличивает скорость взаимодействия Са2+ с неактивным цитозольным ферментом протеинкиназой С
- 47. Диацилглицерол, занимая специфические центры в протеинкиназе С, в еще большей степени увеличивает ее сродство к ионам
- 49. Каталитические рецепторы. Каталитические рецепторы являются ферментами. Активаторами этих ферментов могут быть гормоны, ростовые факторы, цитокины. В
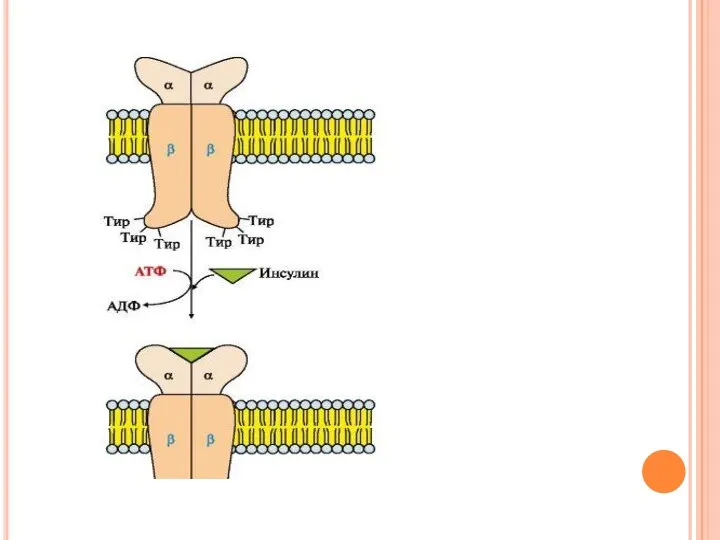
- 51. Строение рецептора инсулина в состав рецептора входят две α- и две β-субъединицы. α -Субъединицы расположены на
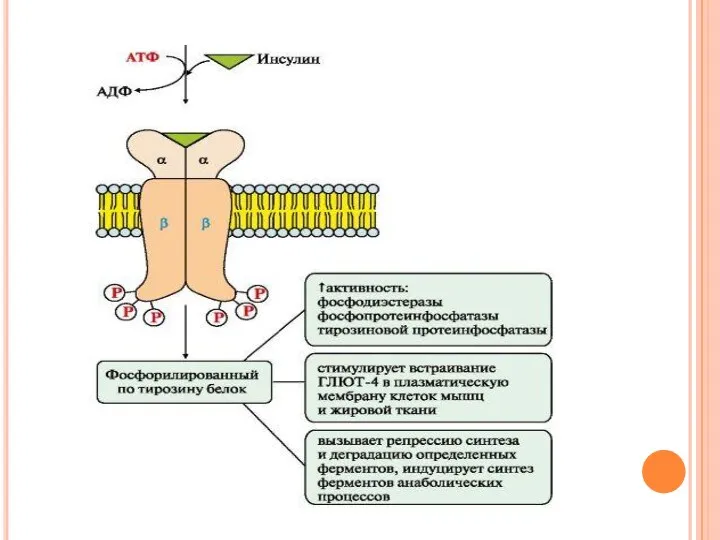
- 53. Механизм работы инсулинового рецептора Присоединение инсулина в центр связывания, образованный а-субъединицами, вызывает кооперативные конформационные изменения рецептора.
- 54. Происходит активация • фосфопротеинфосфатазы (ФПФ), которая дефосфорилирует специфические фосфопротеины; • фосфодиэстеразы, которая превращает цАМФ в АМФ
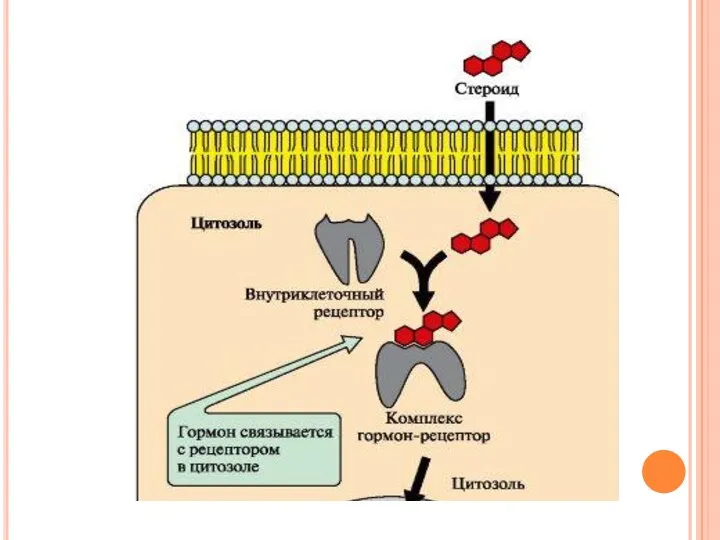
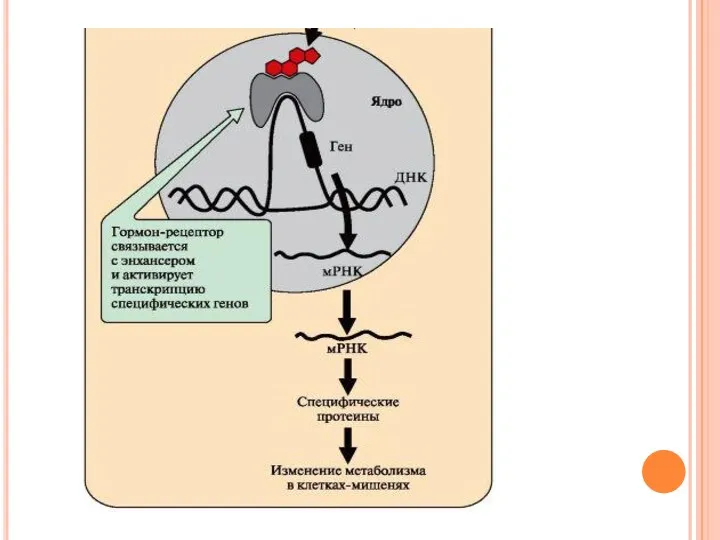
- 55. Передача сигнала с помощью внутриклеточных рецепторов Гидрофобные по химической природе гормоны (стероидные гормоны и тироксин) могут
- 57. Комплекс гормон-рецептор проходит в ядро и присоединяется к регуляторной нуклеотидной последовательности ДНК – энхансеру или сайленсеру.
- 58. Зрелые мРНК выходят из ядра. Увеличивается или уменьшается скорость трансляции определенных белков. Изменяется количество белков, которые
- 60. Самостоятельная работа Зарисуйте и опишите в рабочих тетрадях механизм работы гуанилатциклазной системы
- 61. Вывод: Согласованное функционирование мембранных систем, включающих рецепторы, ферменты, транспортные системы, помогает поддерживать гомеостаз клетки и быстро
- 63. Скачать презентацию











































 Лимбическая система мозга
Лимбическая система мозга Магистры Тема 4б
Магистры Тема 4б Онтоногенез — это индивидуальное развитие организма
Онтоногенез — это индивидуальное развитие организма Загальна характеристика харчування і травлення
Загальна характеристика харчування і травлення Презентация Человеческие расы
Презентация Человеческие расы Тайга. Флора и фауна
Тайга. Флора и фауна Микробиологические методы определения активности антибиотиков
Микробиологические методы определения активности антибиотиков Пищеварение в ротовой полости
Пищеварение в ротовой полости Мир пернатых. Урок-соревнование
Мир пернатых. Урок-соревнование Сущность жизни и свойства живого
Сущность жизни и свойства живого Клиническая лабораторная микробиология. (Лекция 1)
Клиническая лабораторная микробиология. (Лекция 1) Общественные насекомые муравьи
Общественные насекомые муравьи Откуда берутся шоколад, изюм и мед
Откуда берутся шоколад, изюм и мед Рыбий калейдоскоп. Познавательная игра
Рыбий калейдоскоп. Познавательная игра Скалярия обыкновенная
Скалярия обыкновенная Окружающий мир. Мир растений. (3 класс)
Окружающий мир. Мир растений. (3 класс) Кровообращение. Сердечнососудистая система
Кровообращение. Сердечнососудистая система Особливості живлення тварин
Особливості живлення тварин Физиология пищеварительной системы
Физиология пищеварительной системы Способы размножения животных. Оплодотворение
Способы размножения животных. Оплодотворение Основні групи організмів: бактерії, археї
Основні групи організмів: бактерії, археї Ресурсы Мирового океана
Ресурсы Мирового океана Система и живой организм
Система и живой организм Биохимическая эволюция
Биохимическая эволюция Половая и физиологическая зрелость организма животных
Половая и физиологическая зрелость организма животных Многообразие живых организмов
Многообразие живых организмов Influence of growth regulators and physical factors on camelina sativa seedlings
Influence of growth regulators and physical factors on camelina sativa seedlings Железо друг или враг?
Железо друг или враг?