Содержание
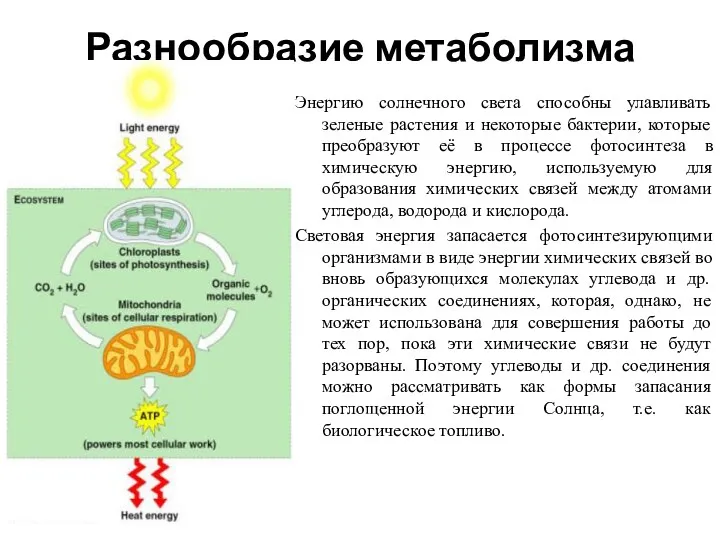
- 2. Разнообразие метаболизма Энергию солнечного света способны улавливать зеленые растения и некоторые бактерии, которые преобразуют её в
- 3. 2-ой закон Термодинамики при необратимых процессах энтропия системы и окружающей среды увеличивается системы стремятся к неупорядоченности
- 4. Энтропия Энтропия растет! мера беспорядка (случайности) в системе (S)
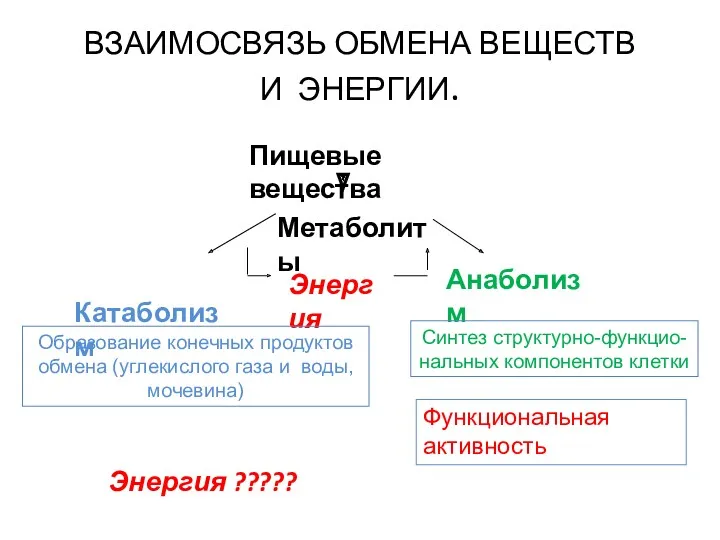
- 5. ВЗАИМОСВЯЗЬ ОБМЕНА ВЕЩЕСТВ И ЭНЕРГИИ. Пищевые вещества Метаболиты Катаболизм Анаболизм Энергия Образование конечных продуктов обмена (углекислого
- 6. АТФ Fritz Albert Lipmann (1899-1986) “ATP is energy-transfering molecule in the cell” (1941) Karl Lohmann (1898-1978)
- 7. В организме АТФ синтезируется путём фосфорилирования АДФ: АДФ + H3PO4 + энергия → АТФ + H2O.
- 8. АТФ у человека образуется в клетке двумя путями: - окислительное фосфорилирование: синтез АТФ с использованием энергии
- 9. Три способа анаэробного синтеза АТФ Субстратное фосфорилирование- в процессе гликолиза в ходе фосфоглицераткиназной реакции и пируваткиназной
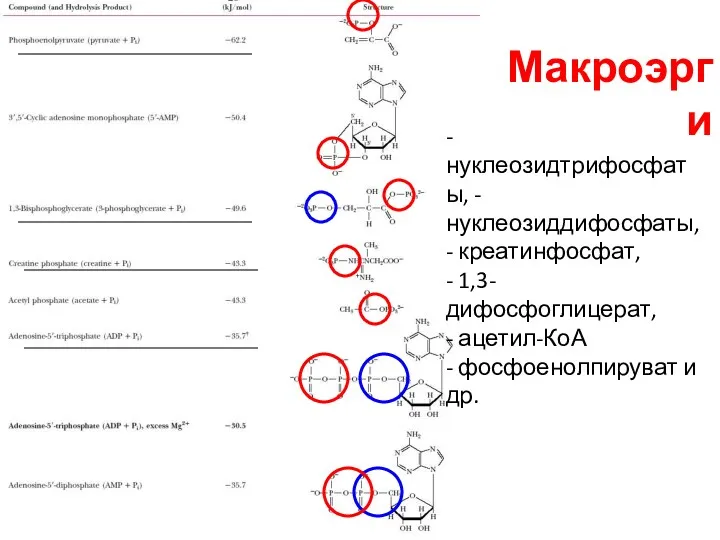
- 10. Макроэрги - нуклеозидтрифосфаты, - нуклеозиддифосфаты, - креатинфосфат, - 1,3-дифосфоглицерат, - ацетил-КоА - фосфоенолпируват и др.
- 11. Тканевое дыхание- это последовательность окислительно-восстановительных реакций Они катализируются оксидоредуктазами и протекают при участии внутренней мембраны митохондрий.
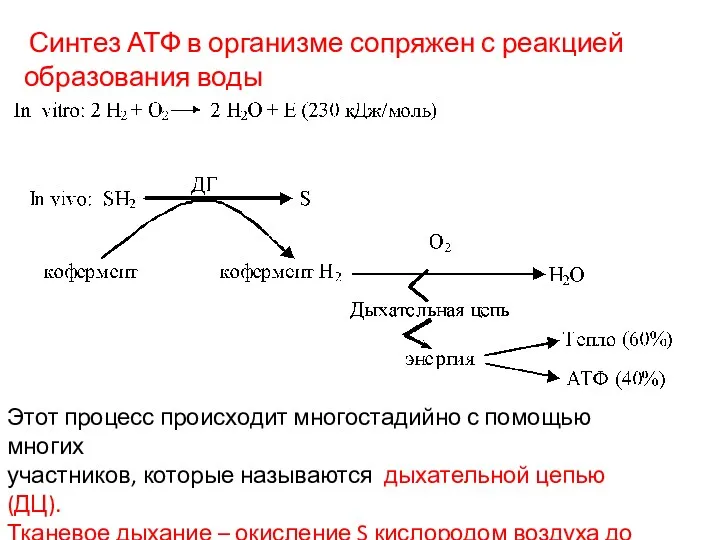
- 12. Синтез АТФ в организме сопряжен с реакцией образования воды Этот процесс происходит многостадийно с помощью многих
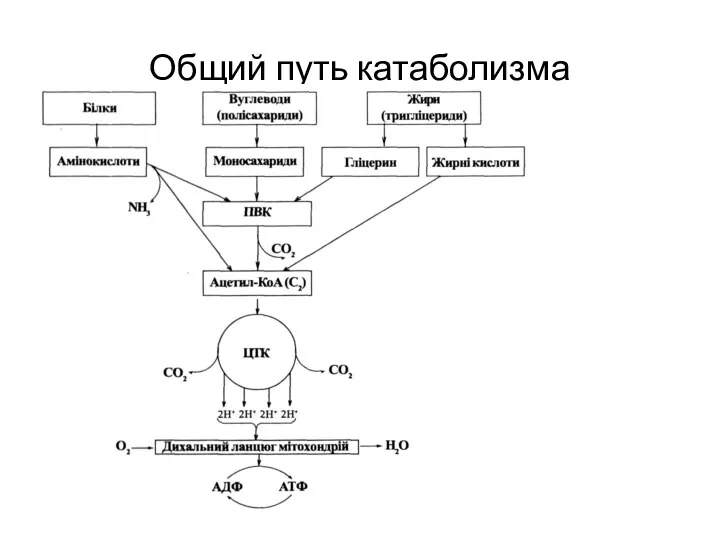
- 13. Общий путь катаболизма
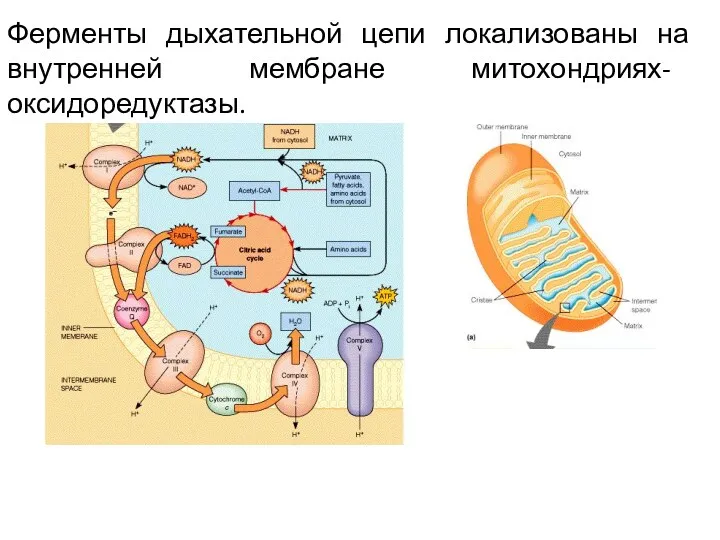
- 15. Ферменты дыхательной цепи локализованы на внутренней мембране митохондриях- оксидоредуктазы.
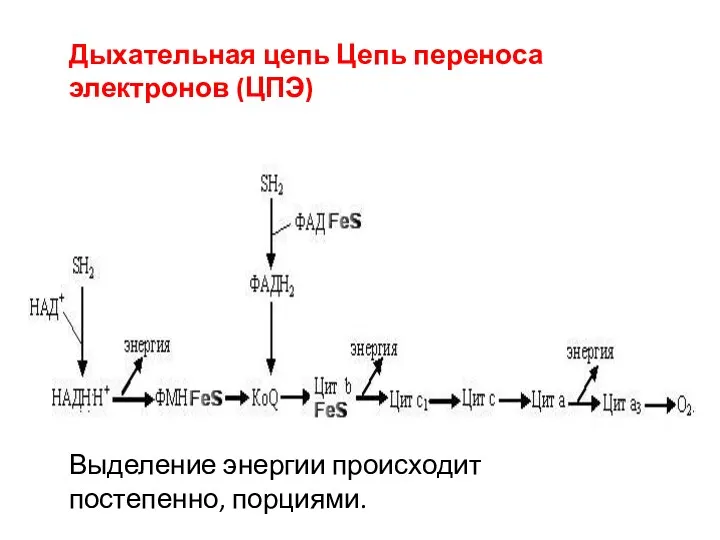
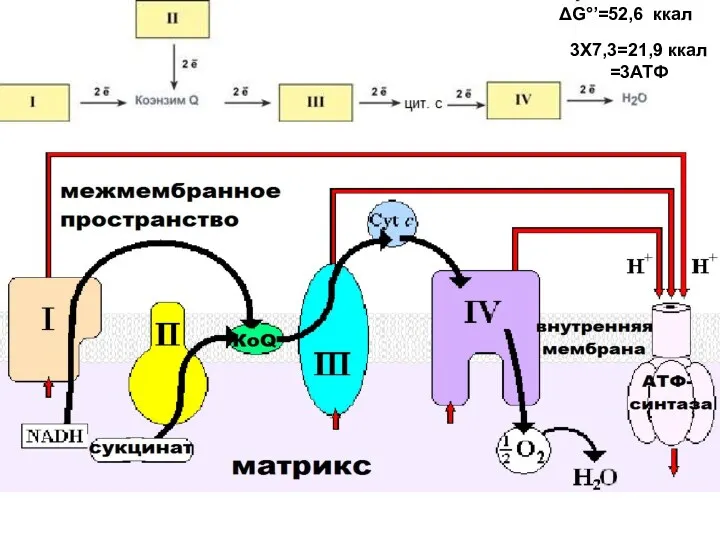
- 16. Выделение энергии происходит постепенно, порциями. Дыхательная цепь Цепь переноса электронов (ЦПЭ)
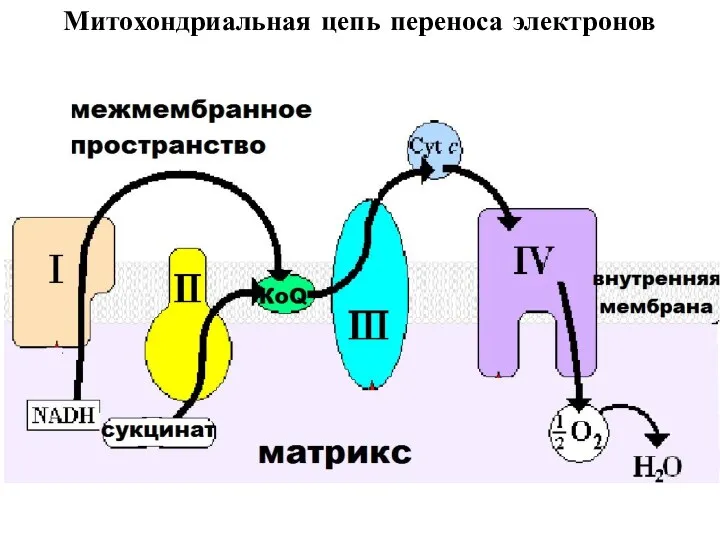
- 17. Митохондриальная цепь переноса электронов
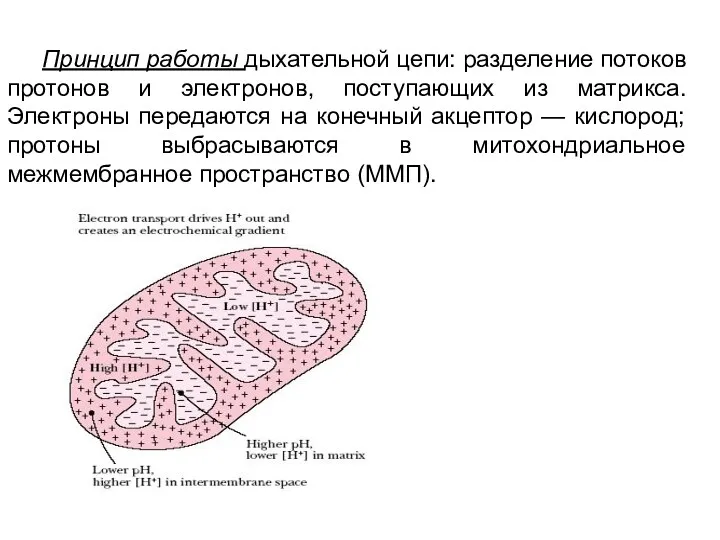
- 18. Принцип работы дыхательной цепи: разделение потоков протонов и электронов, поступающих из матрикса. Электроны передаются на конечный
- 19. Дыхательные ферменты расположены в порядке ↑ величины редокс - потенциала Место того или иного переносчика в
- 20. Редокс-потенциал (Ео′) численно равен электрондвижущей силе в Вольтах, возникающей между растворами окислителя и восстановителя (концентрации 1М,
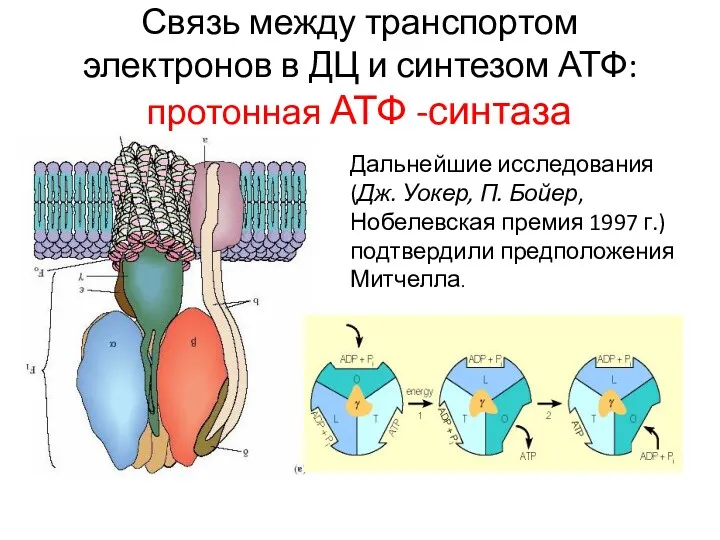
- 21. Связь между транспортом электронов в ДЦ и синтезом АТФ: протонная АТФ -синтаза Дальнейшие исследования (Дж. Уокер,
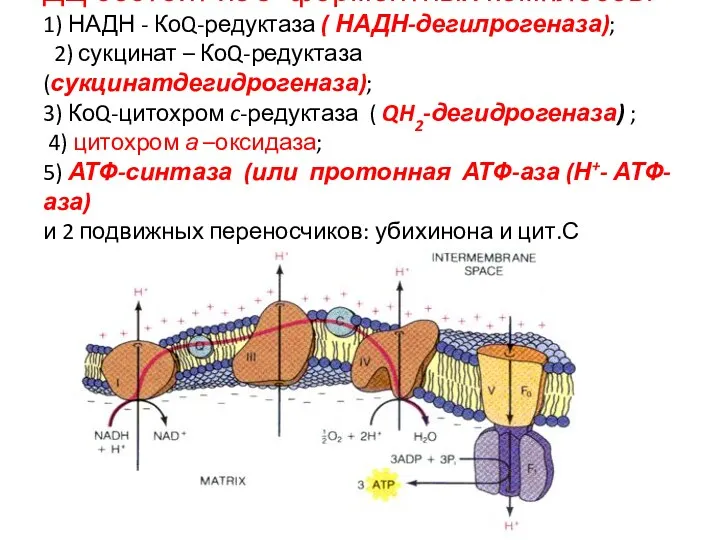
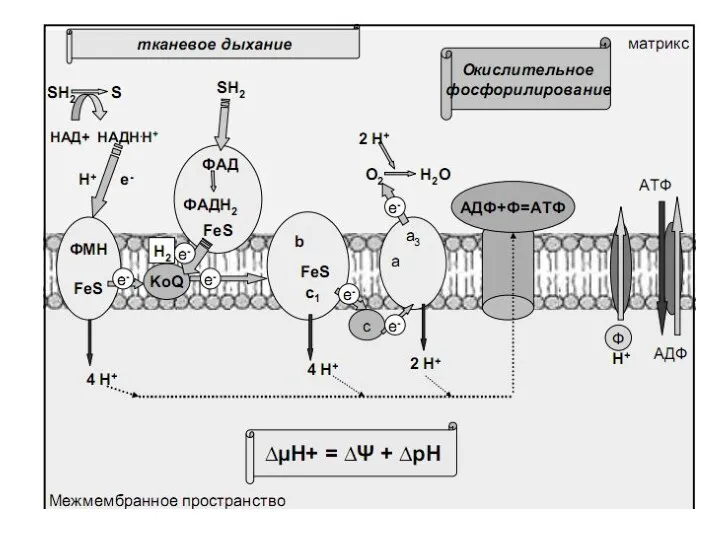
- 22. ДЦ состоит из 5 ферментных комплесов: 1) НАДН - КоQ-редуктаза ( НАДН-дегилрогеназа); 2) сукцинат – КоQ-редуктаза
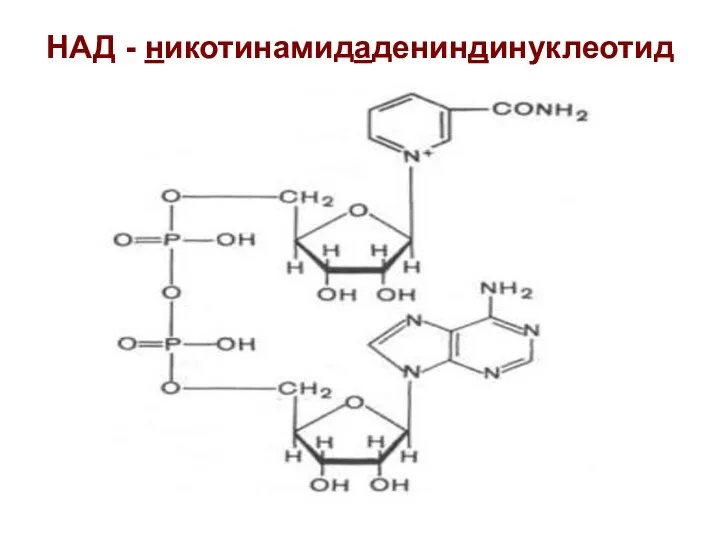
- 23. НАД - никотинамидадениндинуклеотид
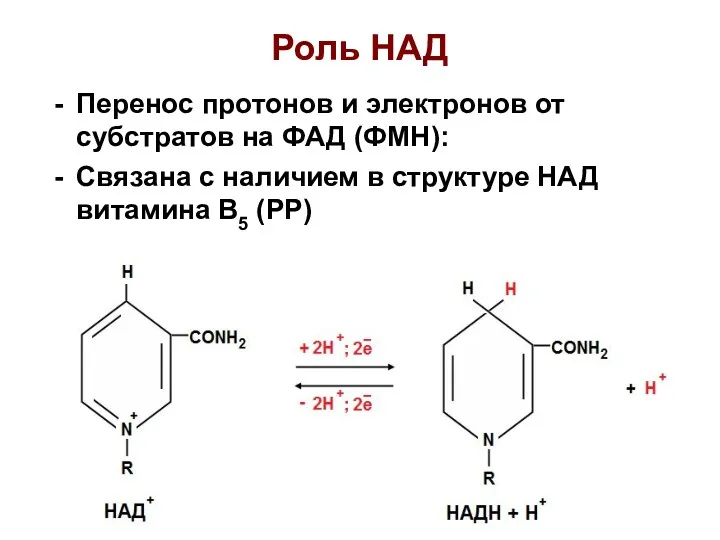
- 24. Роль НАД Перенос протонов и электронов от субстратов на ФАД (ФМН): Связана с наличием в структуре
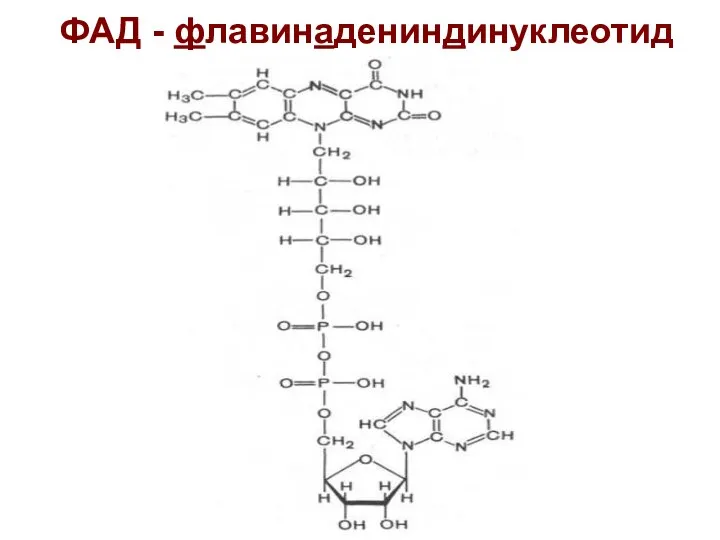
- 25. ФАД - флавинадениндинуклеотид
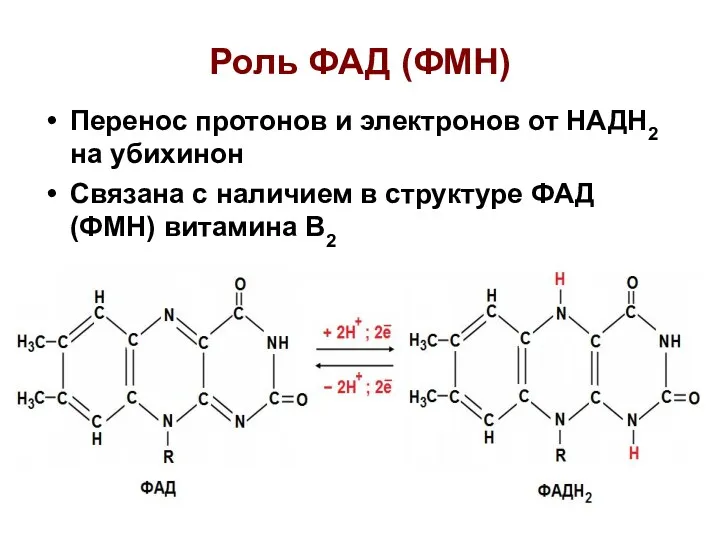
- 26. Роль ФАД (ФМН) Перенос протонов и электронов от НАДН2 на убихинон Связана с наличием в структуре
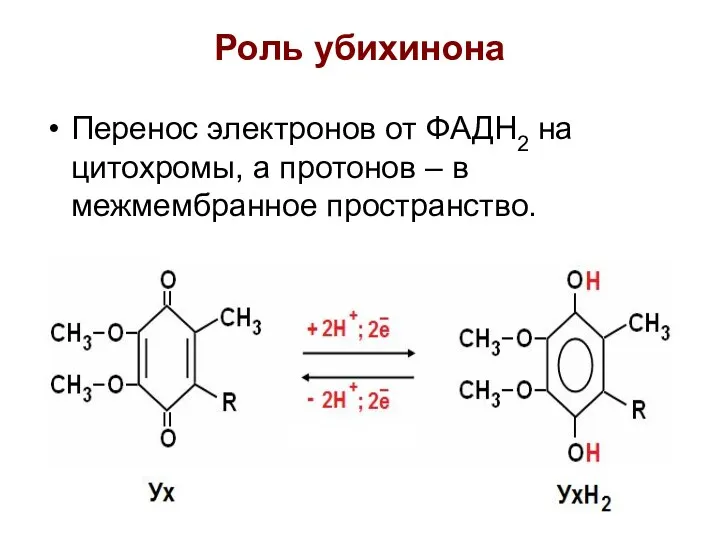
- 27. Роль убихинона Перенос электронов от ФАДН2 на цитохромы, а протонов – в межмембранное пространство.
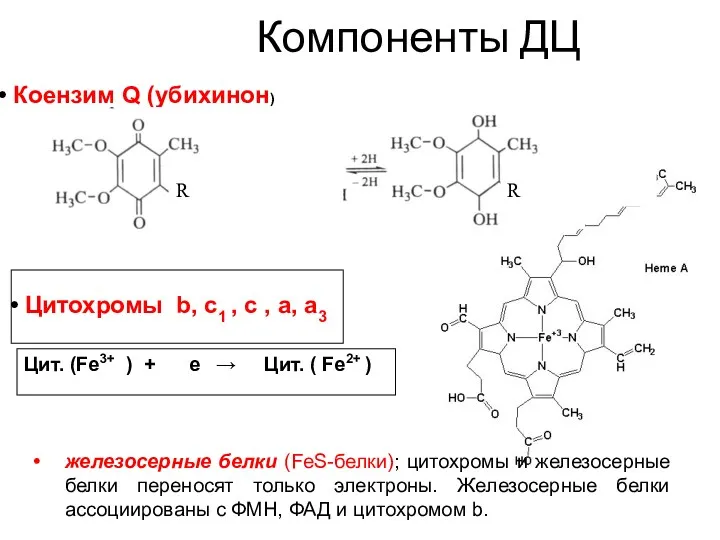
- 28. Цитохромы b, c1 , c , a, a3 Цит. (Fe3+ ) + е → Цит. (
- 29. Цитохромы (Цх) - гемсодержащие ферменты, осуществляют перенос электронов за счет изменения степени окисления атома железа в
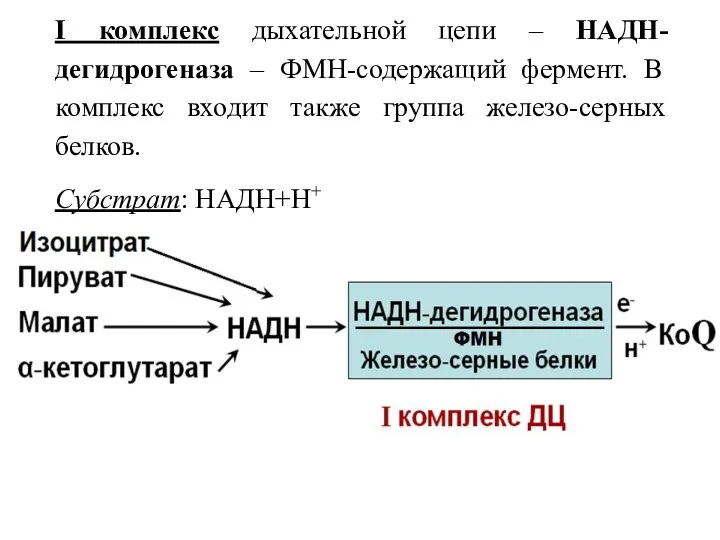
- 30. I комплекс дыхательной цепи – НАДН-дегидрогеназа – ФМН-содержащий фермент. В комплекс входит также группа железо-серных белков.
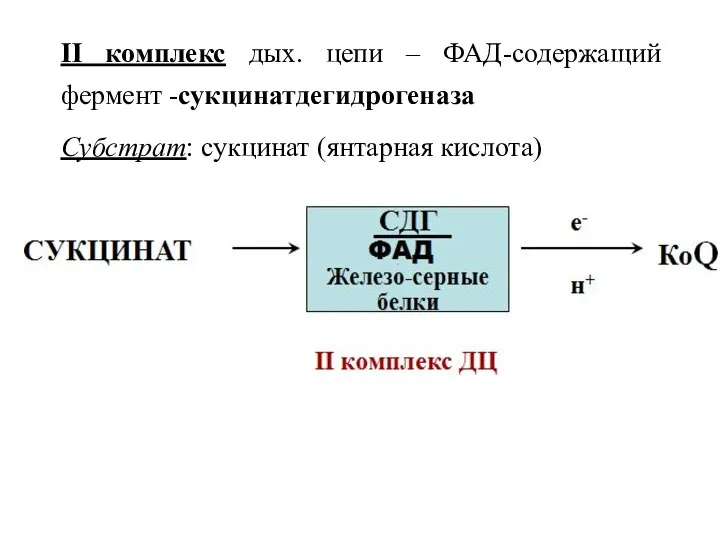
- 31. II комплекс дых. цепи – ФАД-содержащий фермент -сукцинатдегидрогеназа Субстрат: сукцинат (янтарная кислота)
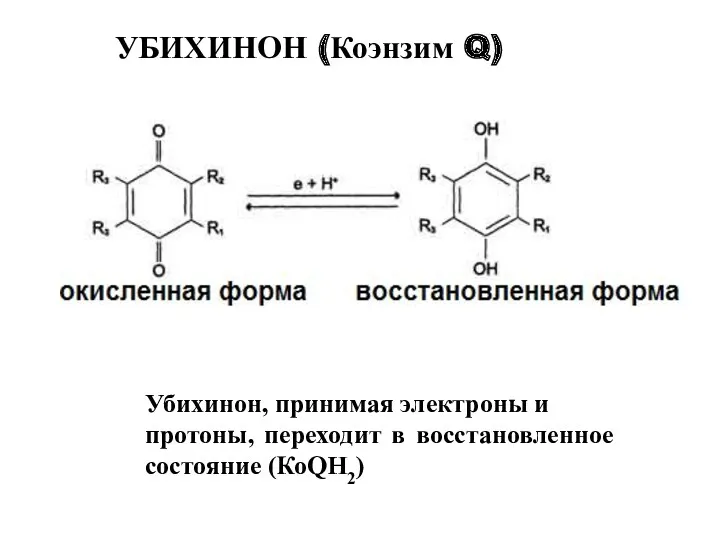
- 32. Убихинон, принимая электроны и протоны, переходит в восстановленное состояние (КоQН2) УБИХИНОН (Коэнзим Q)
- 33. После КоQ в дыхательной цепи расположена группа цитохромов – гем-содержащих ферментов, обеспечивающих транспорт электронов. Различают несколько
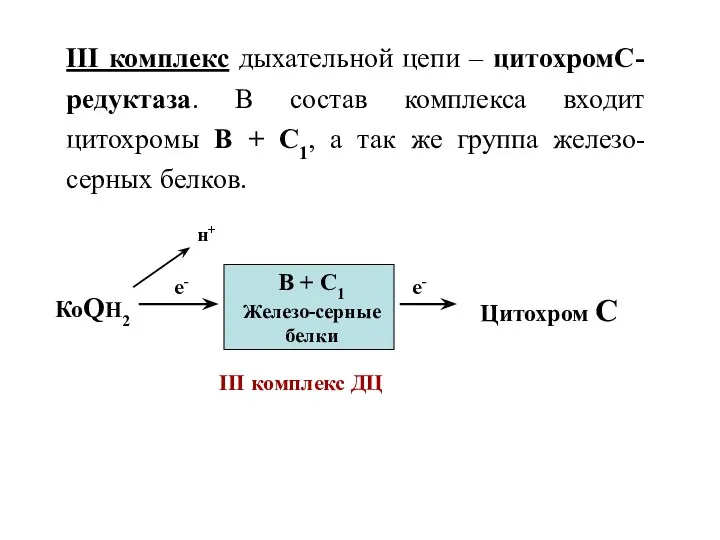
- 34. III комплекс дыхательной цепи – цитохромС-редуктаза. В состав комплекса входит цитохромы В + С1, а так
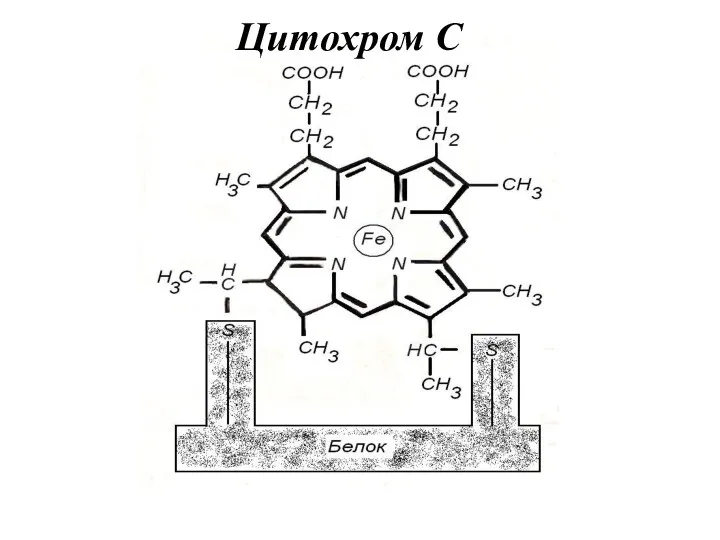
- 35. Цитохром С
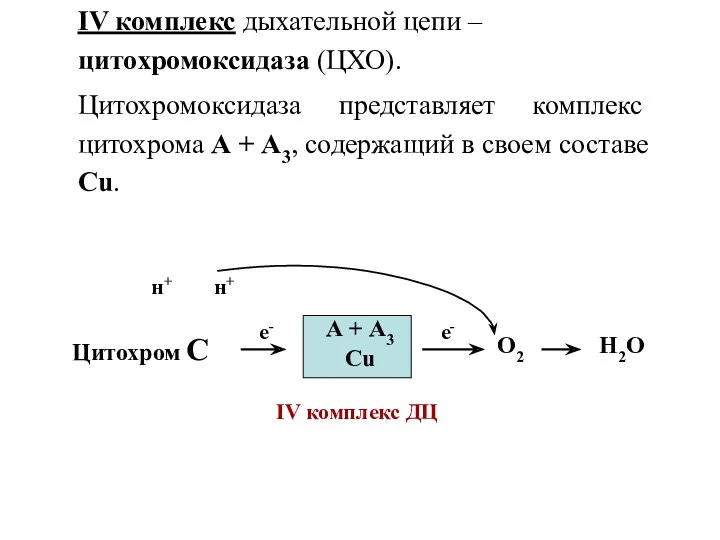
- 36. IV комплекс дыхательной цепи – цитохромоксидаза (ЦХО). Цитохромоксидаза представляет комплекс цитохрома А + А3, содержащий в
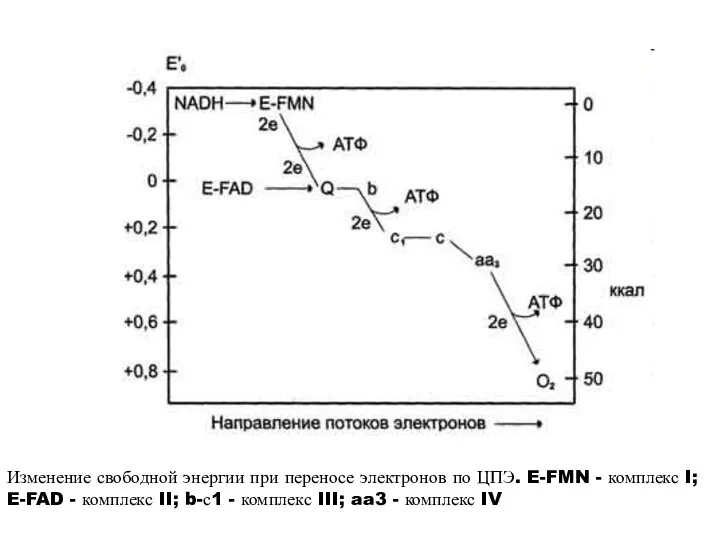
- 37. Изменение свободной энергии при переносе электронов по ЦПЭ. E-FMN - комплекс I; E-FAD - комплекс II;
- 38. 3Х7,3=21,9 ккал =3АТФ ΔG°’=52,6 ккал
- 40. Хемиоосмотическая теория окислительного фосфорилирования (Нобелевская премия 1978 г.).
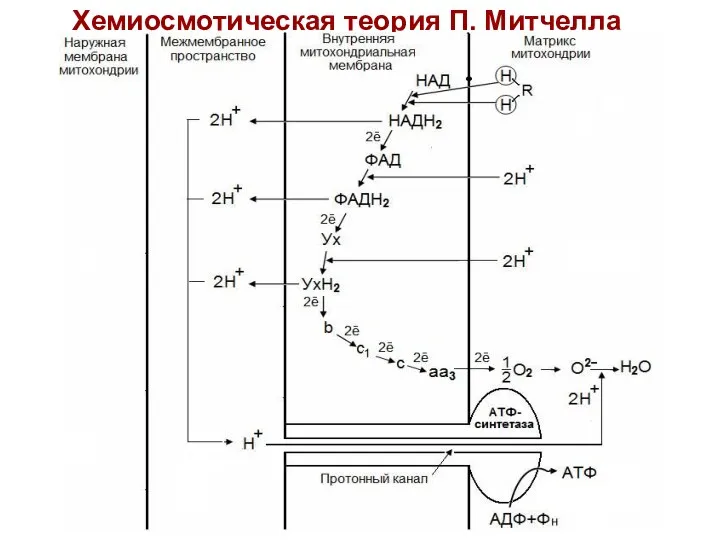
- 41. Хемиосмотическая теория П. Митчелла
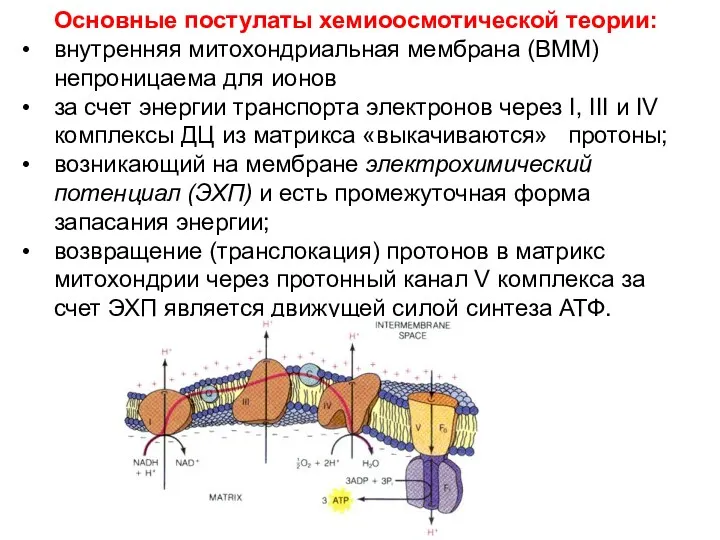
- 42. Основные постулаты хемиоосмотической теории: внутренняя митохондриальная мембрана (ВММ) непроницаема для ионов за счет энергии транспорта электронов
- 43. Хемиосмотическая теория П. Митчелла (1961-1966 гг) Дыхание и фосфорилирование связаны между собой через электрохимический потенциал Н+
- 44. ДГГ НАДН2 отдает пару ē на ДГГ ФАД, что позволяет ФАД принять пару протонов (Н+) из
- 45. Разница потенциалов и разница рН обеспечивает движение протонов через протонный канал в матрикс. Протонный канал открывается,
- 46. Таким образом, тканевое дыхание заряжает митохондриальную мембрану, а окислительное фосфорилирование разряжает ее, используя энергию мембранного потенциала
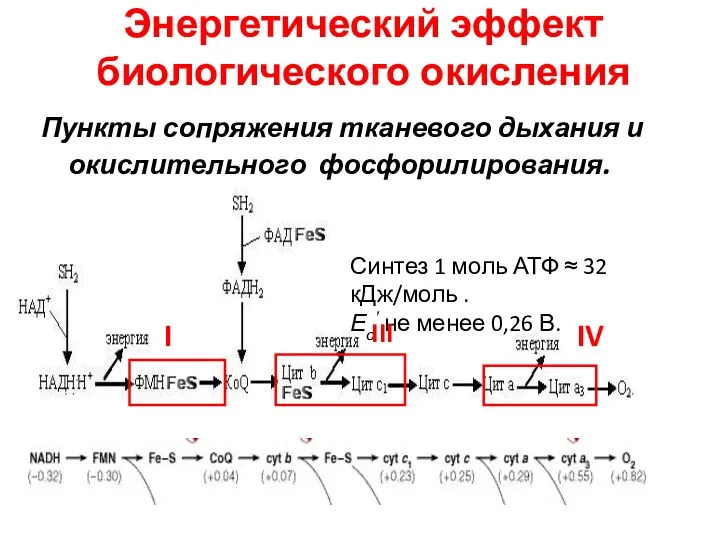
- 47. Энергетический эффект биологического окисления Пункты сопряжения тканевого дыхания и окислительного фосфорилирования. Синтез 1 моль АТФ ≈
- 48. Дыхательный контроль Регулируется скорость работы дыхательной цепи энергетическим зарядом клетки, т. е. соотношением АТФ/АДФ. Эффективность окислительного
- 49. Синтез АТФ – окислительное фосфорилирование - представляет процесс одновременного потребления О2, АДФ и Фн. В пределах
- 50. Функции дыхательной цепи: ●Транспорт электронов на О2 – тканевое дыхание. ●Преобразование энергии транспорта электронов в энергию
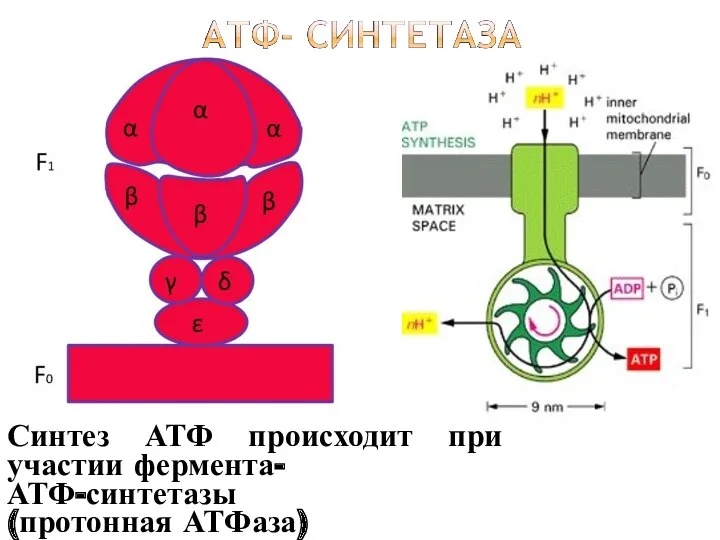
- 51. Синтез АТФ происходит при участии фермента- АТФ-синтетазы (протонная АТФаза)
- 52. Коэффициент фосфорилирования (Р/О)- количество молекул неорганического фосфата, которое включается в АТФ в расчете на 1 атом
- 53. Регуляция тканевого дыхания (транспорта электронов): ● Регуляция за счет концентрации О2 ●Дыхательный контроль (зависимость митохондриального окисления
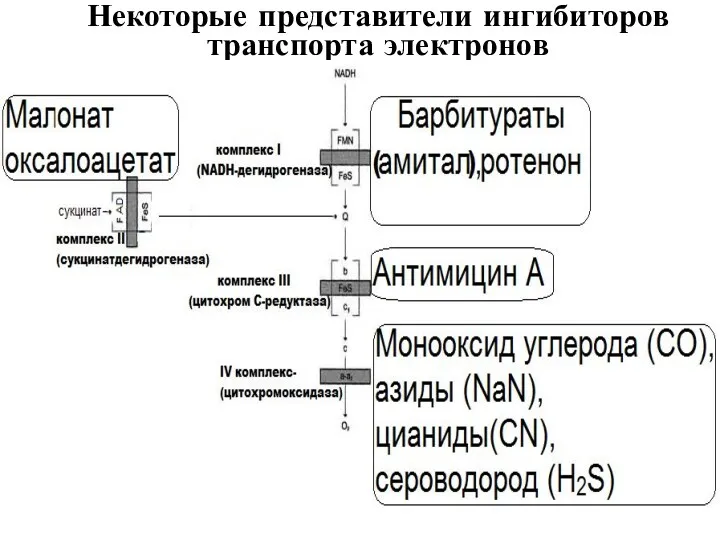
- 54. Некоторые представители ингибиторов транспорта электронов
- 55. Регуляция синтеза АТФ: ● Регуляция протонного потока за счет разобщителей: - Протонофоры (динитрофенол, жирные кислоты, тироксин,
- 56. -субстраты цикла Кребса, -отношение [ATP]/[ADP] (обратимость АТФ-синтетазной реакции), -кислород (гипоксия), -физиологические разобщители (жирные кислоты, лизофосфолипиды, гормоны,
- 57. Особенности энергетического обмена у ребенка обусловлены его интенсивным ростом, биосинтетической деятельностью, функциональной незрелостью ряда регуляторных систем
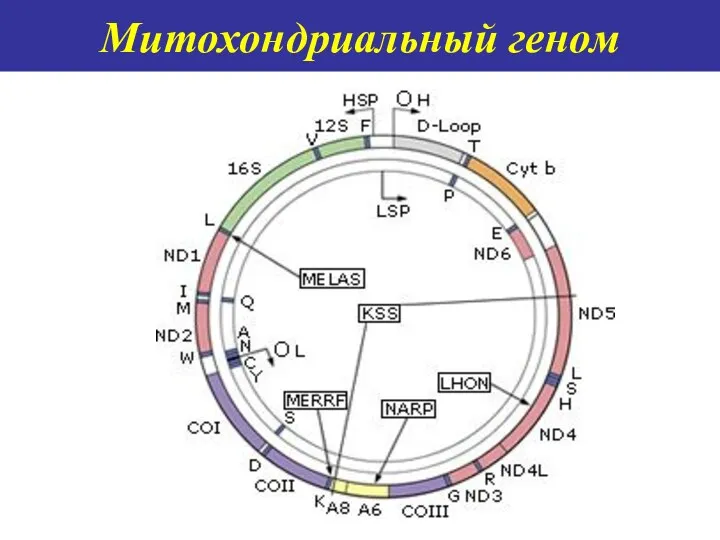
- 58. Митохондриальный геном
- 59. Общая характеристика митохондриальных болезней Митохондриальные болезни – это мультисистемные заболевания, причиной или главным элементом патогенеза которых
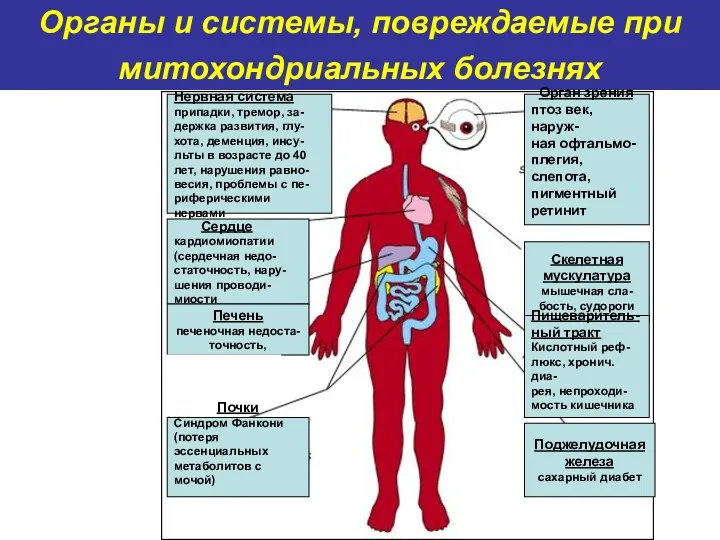
- 60. Органы и системы, повреждаемые при митохондриальных болезнях Нервная система припадки, тремор, за- держка развития, глу- хота,
- 61. Первичные (врожденные) митохондриальные болезни могут быть обусловлены мутациями либо в ядерном, либо в митохондриальном геноме. Ядерные
- 63. Вторичные (приобретенные) митохондриопатии 1. Специфический дефицит метаболических интермедиатов или кофакторов (тиаминпирофосфата, липоамида, флавиновых и пиридиновых нуклеотидов,
- 64. Разобщение тканевого дыхания и окислительного фосфорилирования - состояние, при котором потребление кислорода и окисление субстратов продолжаются,
- 65. Виды разобщения 1) физиологическое (холод, тироксин, кортикостероиды, женские половые гормоны) 2) медикаментозное (дикумарин) 3) токсическое (динитрофенол)
- 66. Ингибиторы ТД и ОФ а) ингибиторы электронного транспорта – это вещества, которые взаимодействуют с ферментами дыхательной
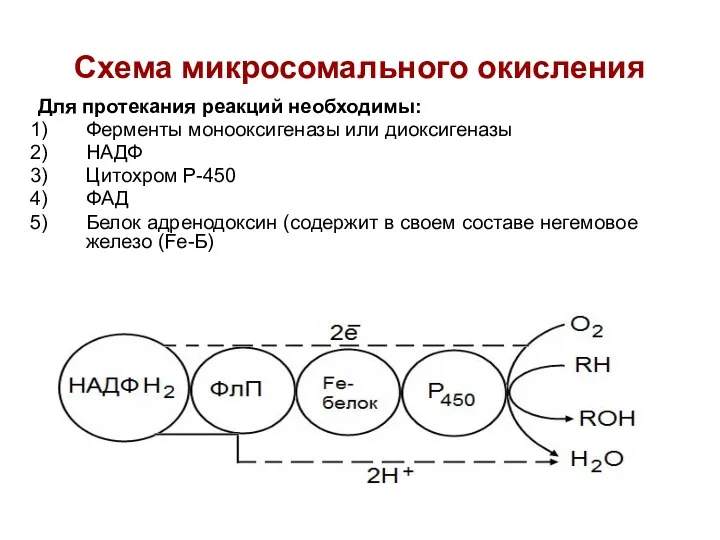
- 67. Микросомальное окисление Протекает в мембранах ЭПР (микросомах) клеток печени и коры надпочечников. Не дает клетке энергии
- 68. Схема микросомального окисления Для протекания реакций необходимы: Ферменты монооксигеназы или диоксигеназы НАДФ Цитохром Р-450 ФАД Белок
- 69. Активные формы кислорода (АФК) Это продукты неполного восстановления кислорода, содержащие неспаренные электроны. АФК являются свободными радикалами.
- 70. Вспомогательные ферменты тканевого дыхания 1) Супероксиддисмутаза (превращает супероксидные радикалы в менее токсичную перекись водорода); 2О2- +
- 72. Скачать презентацию























![-субстраты цикла Кребса, -отношение [ATP]/[ADP] (обратимость АТФ-синтетазной реакции), -кислород (гипоксия),](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/382982/slide-55.jpg)











 Разведение по линиям
Разведение по линиям Такая неизвестная известная гидра
Такая неизвестная известная гидра Рыбы. Систематика рыб
Рыбы. Систематика рыб Черенкование комнатных растений
Черенкование комнатных растений Органические вещества клетки
Органические вещества клетки Оплодотворение. Этапы
Оплодотворение. Этапы Учитель года 2021. Открытый урок к конкурсу
Учитель года 2021. Открытый урок к конкурсу Семейство Зонтичные
Семейство Зонтичные Механизмы действия сигнальных молекул
Механизмы действия сигнальных молекул Физиология скелетных мышц
Физиология скелетных мышц Camouflage
Camouflage С какой целью в биологии используется моделирование?
С какой целью в биологии используется моделирование? Организация предпрофильной подготовки учащихся в рамках внеурочной деятельности
Организация предпрофильной подготовки учащихся в рамках внеурочной деятельности История развития зоологии. Современная зоология
История развития зоологии. Современная зоология Кровь. Клеточный состав, функции, физико-химические константы и свойства. (Лекция 21)
Кровь. Клеточный состав, функции, физико-химические константы и свойства. (Лекция 21) Методы лесовосстановления и лесоразведения
Методы лесовосстановления и лесоразведения Голонасінні рослини
Голонасінні рослини Сердце. Анатомия сердца
Сердце. Анатомия сердца Везикулярлық тасымалдау
Везикулярлық тасымалдау Инсектициды
Инсектициды Формы естественного отбора
Формы естественного отбора Разнообразие растений. Особенности внешнего строения растений. 6 (7) класс
Разнообразие растений. Особенности внешнего строения растений. 6 (7) класс Мои дельфиниумы
Мои дельфиниумы Скелет. Строение, состав и соединение костей скелета человека
Скелет. Строение, состав и соединение костей скелета человека Цитологические основы наследственности
Цитологические основы наследственности Цитоплазма. Химический состав
Цитоплазма. Химический состав Жгутики - поверхностные структуры бактерий
Жгутики - поверхностные структуры бактерий Семейство растений сельдерейные
Семейство растений сельдерейные