Содержание
- 2. План лекции: Общие закономерности метаболизма. Этапы катаболизма. Цепь переноса электронов (ЦПЭ), состав, строение компонентов дыхательной цепи.
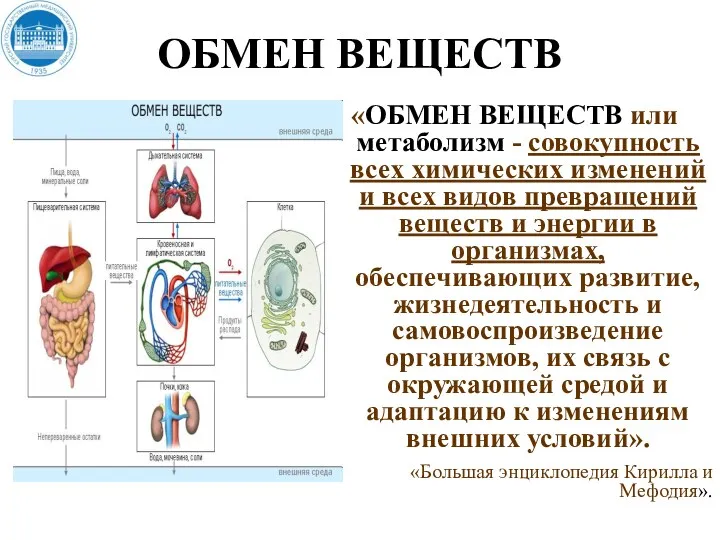
- 3. ОБМЕН ВЕЩЕСТВ «ОБМЕН ВЕЩЕСТВ или метаболизм - совокупность всех химических изменений и всех видов превращений веществ
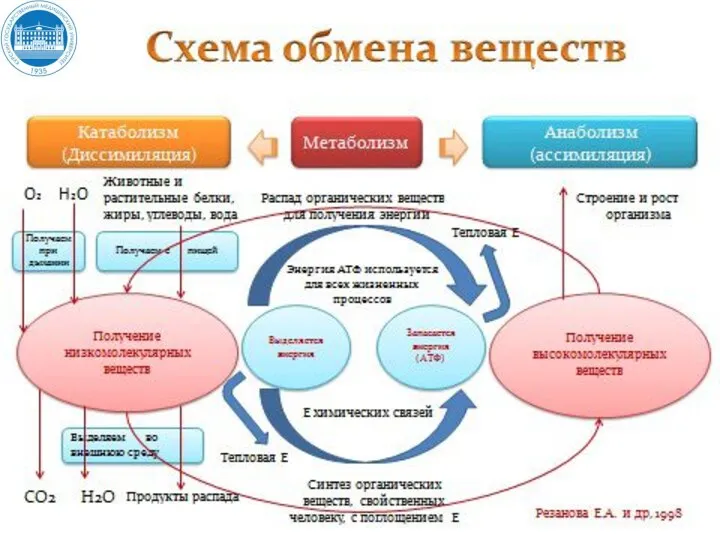
- 4. Промежуточный обмен (внутриклеточный метаболизм) включает два типа реакций: Катаболизм – биосинтетические процессы расщепления органических молекул до
- 5. Промежуточный обмен (внутриклеточный метаболизм) включает два типа реакций: Анаболизм - биосинтетические процессы, в которых простые строительные
- 7. Процессы окисления протекают в организме и вне организма. Эти процессы имеют сходства и различия. Биологическое окисление
- 8. Сходство между окислением в организме и вне организма. В результате окисления образуются одинаковые конечные продукты СО2
- 9. Различия между окислением в организме и вне организма. Вне организма энергия выделяется за счет окисления атомов
- 10. Различия между окислением в организме и вне организма. Вне организма энергия выделяется одномоментно и не аккумулируется,
- 11. Различия между окислением в организме и вне организма. Основной реакцией окисления в организме является реакция дегидрирования,
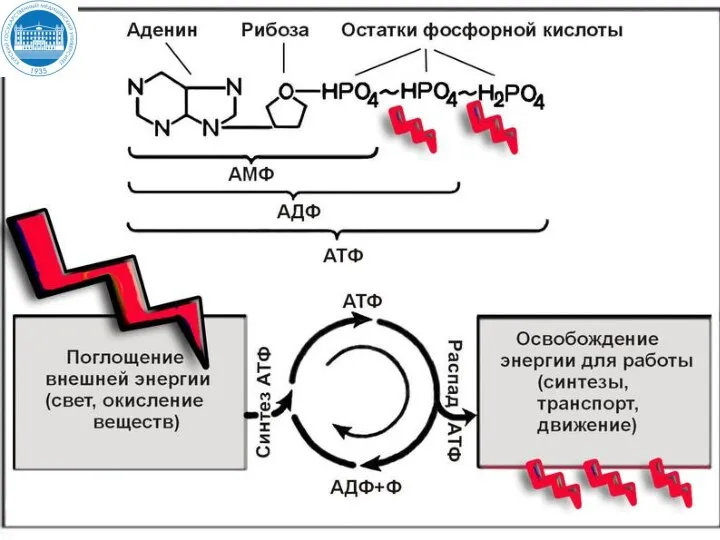
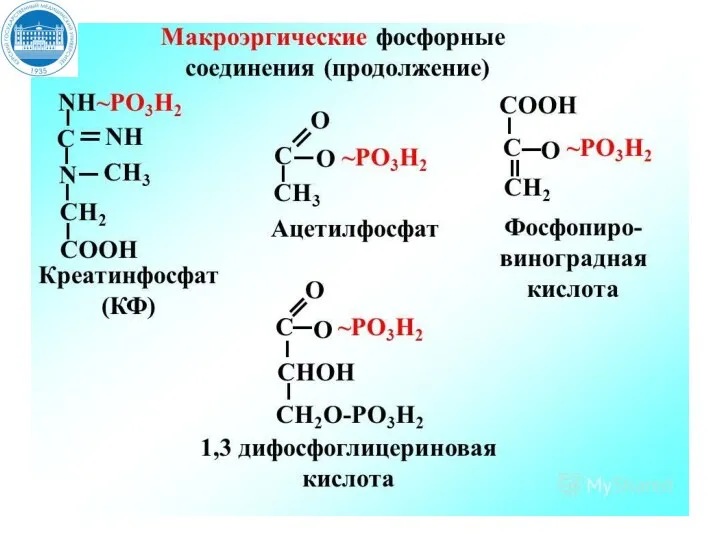
- 12. Утилизация энергии в виде макроэргических связей При разрыве макроэргической связи образуется более 30 кДж/моль свободной энергии
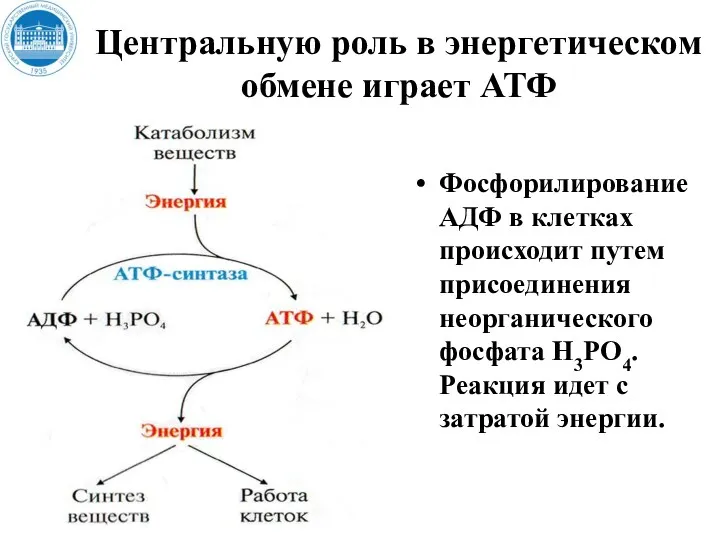
- 13. Центральную роль в энергетическом обмене играет АТФ Фосфорилирование АДФ в клетках происходит путем присоединения неорганического фосфата
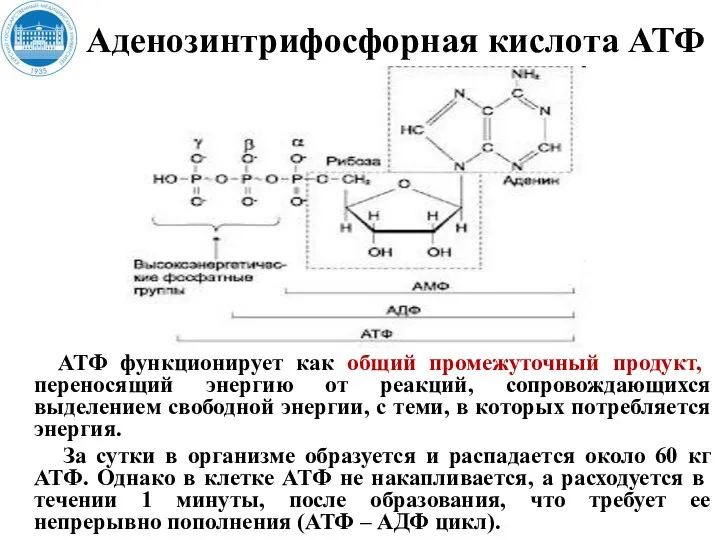
- 15. Аденозинтрифосфорная кислота АТФ АТФ функционирует как общий промежуточный продукт, переносящий энергию от реакций, сопровождающихся выделением свободной
- 16. Типы фосфорилирования АДФ В зависимости от источника энергии, обеспечивающего присоединение фосфатного участка, выделяют два типа фосфорилирования
- 17. Субстратное фосфорилирование - это процесс синтез АТФ из АДФ и неорганического фосфата за счет энергии, выделившийся
- 19. Окислительное фосфорилирование АДФ - синтез АТФ из АДФ и Н3РО4 за счет переноса электронов по ЦПЭ
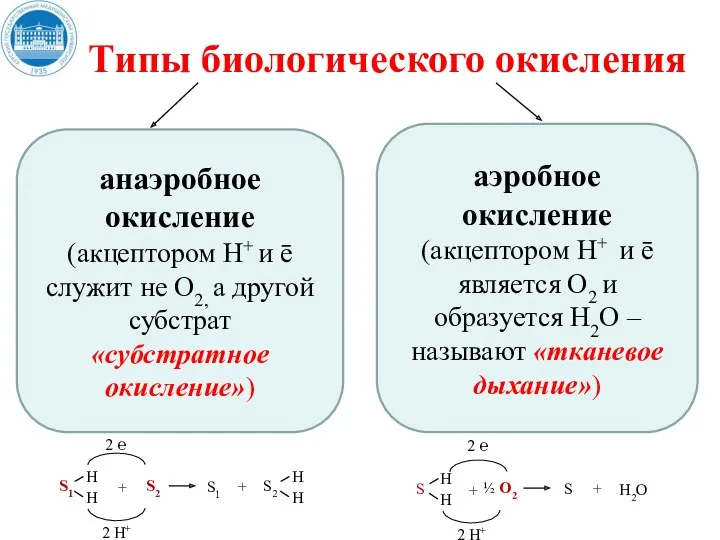
- 20. Типы биологического окисления анаэробное окисление (акцептором Н+ и ē служит не О2, а другой субстрат «субстратное
- 21. Тканевое дыхание Тканевым дыханием являются реакции окисления органических веществ, в которых используется кислород и образуется вода
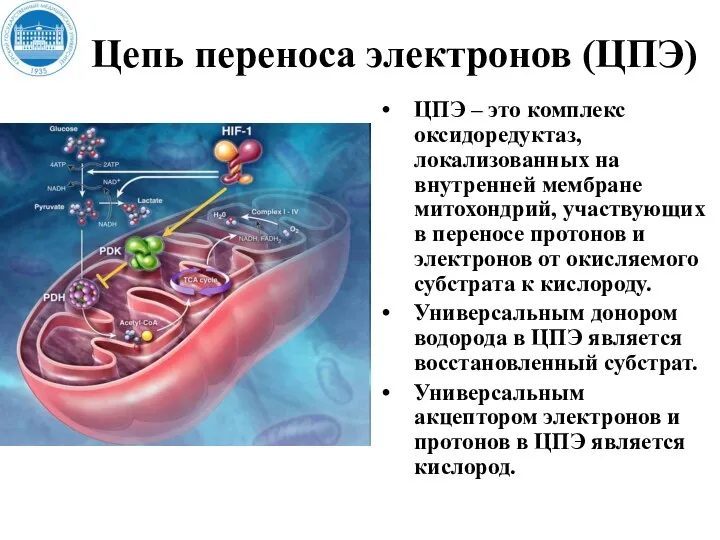
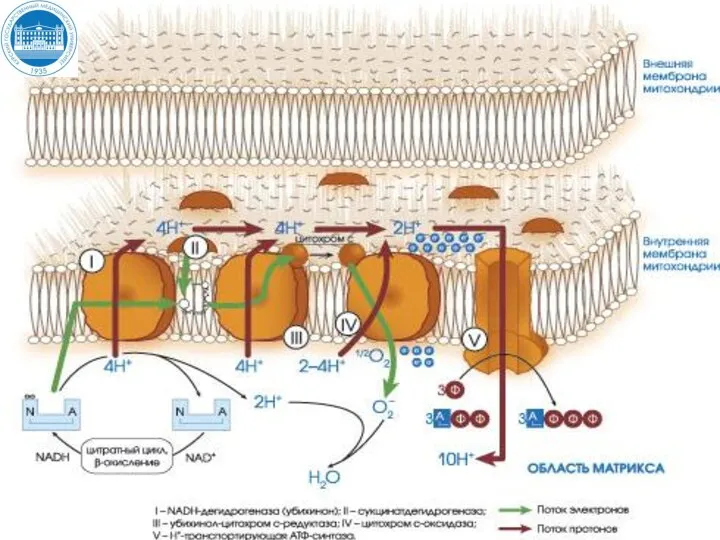
- 22. Цепь переноса электронов (ЦПЭ) ЦПЭ – это комплекс оксидоредуктаз, локализованных на внутренней мембране митохондрий, участвующих в
- 23. Первичные акцепторы водорода Никотинамидзависимые дегидрогеназы (NAD, NADР) (находятся в матриксе митохондрий или в цитозоле) NAD (NADР)
- 24. Первичные акцепторы водорода Флавинзависимые дегидрогеназы (FAD, FMN) В отличие от NAD FAD соединен прочно с белковой
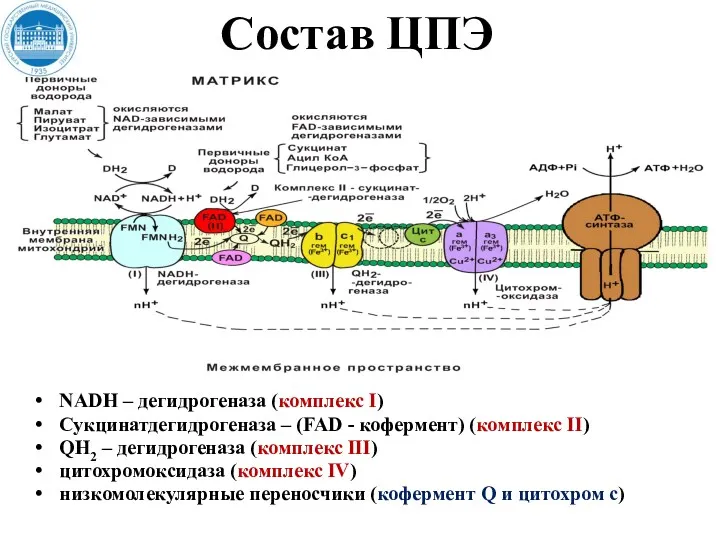
- 26. Состав ЦПЭ NADH – дегидрогеназа (комплекс I) Сукцинатдегидрогеназа – (FAD - кофермент) (комплекс II) QH2 –
- 27. NADH – дегидрогеназа (комплекс I) Комплекс I ЦПЭ содержит ФМН и 5 железосерных белков. NADН-дегидрогеназа (комплекс
- 28. Сукцинатдегидрогеназа – (FAD - кофермент) (комплекс II) Сукцинатдегидрогеназа - СДГ (FAD – зависимая дегидрогеназа) (комплекс II)
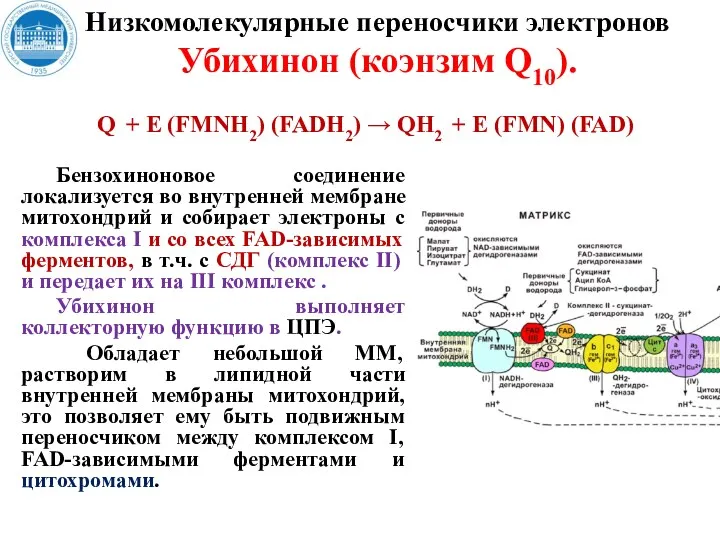
- 29. Бензохиноновое соединение локализуется во внутренней мембране митохондрий и собирает электроны с комплекса I и со всех
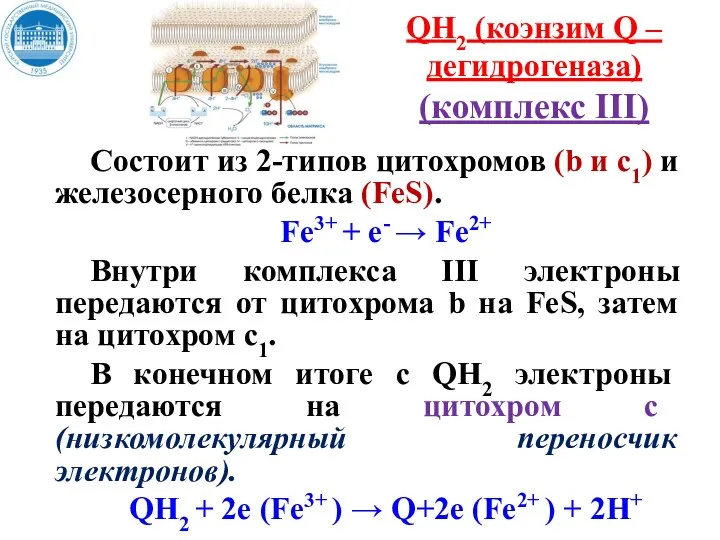
- 30. QH2 (коэнзим Q –дегидрогеназа) (комплекс III) Состоит из 2-типов цитохромов (b и с1) и железосерного белка
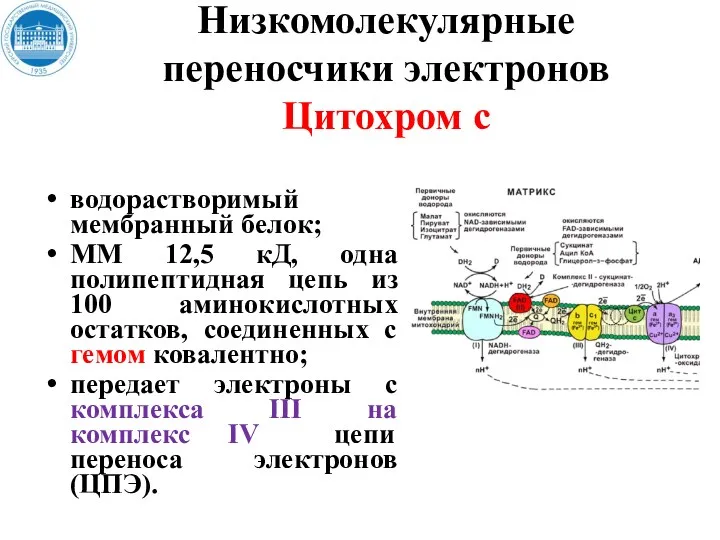
- 31. Низкомолекулярные переносчики электронов Цитохром с водорастворимый мембранный белок; ММ 12,5 кД, одна полипептидная цепь из 100
- 32. Цитохром-c-оксидаза (цит а/а3) (комплекс IV) Комплекс IV ЦПЭ содержит цитохромы а, а3, два иона меди. Это
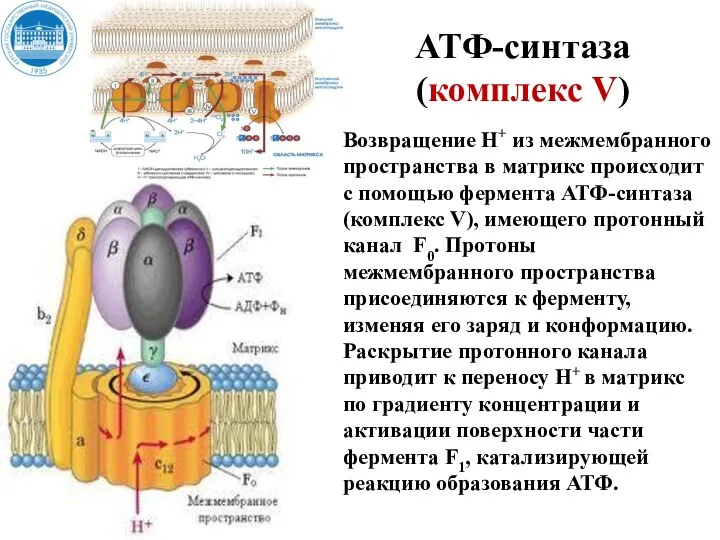
- 33. АТФ-синтаза (комплекс V) Возвращение Н+ из межмембранного пространства в матрикс происходит с помощью фермента АТФ-синтаза (комплекс
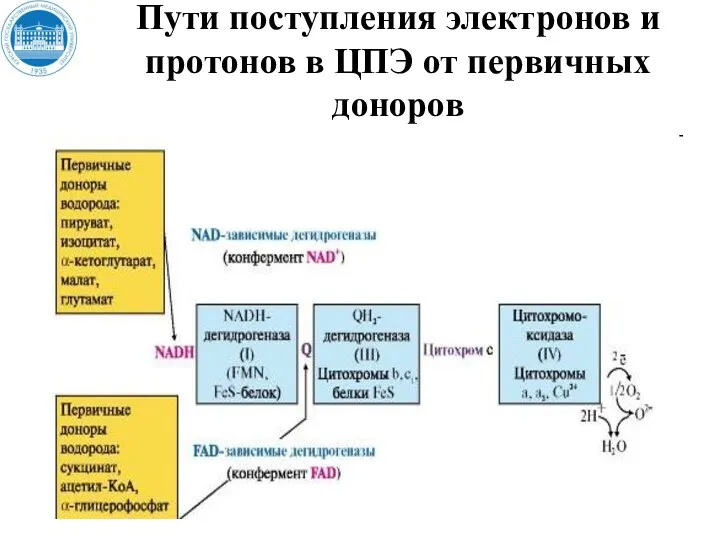
- 34. (II) Пути поступления электронов и протонов в ЦПЭ от первичных доноров
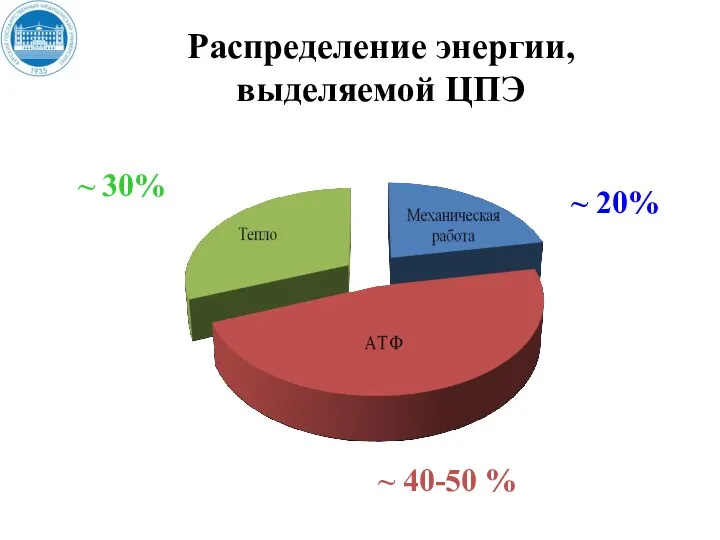
- 35. Распределение энергии, выделяемой ЦПЭ ~ 20% ~ 40-50 % ~ 30%
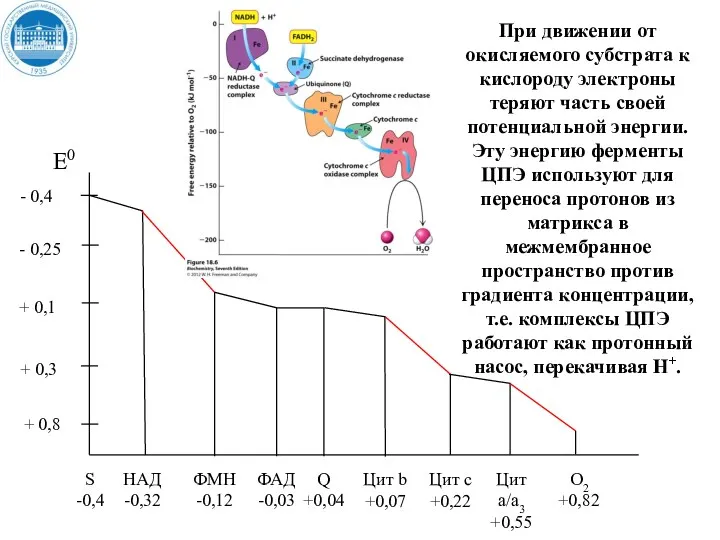
- 36. + 0,8 При движении от окисляемого субстрата к кислороду электроны теряют часть своей потенциальной энергии. Эту
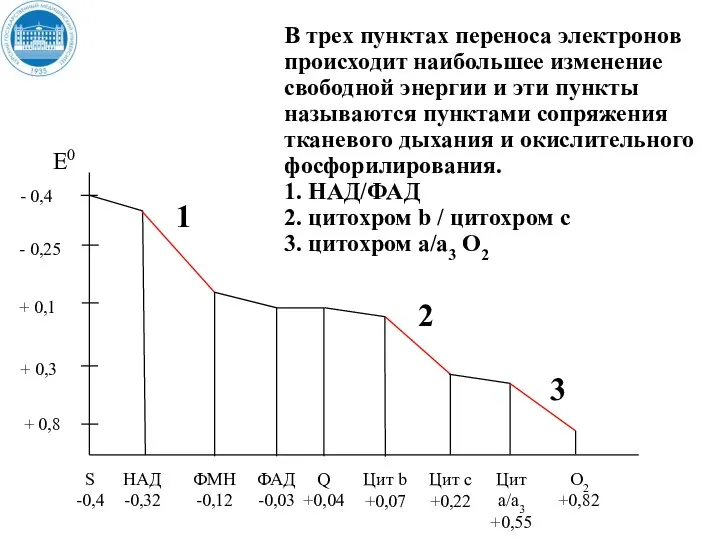
- 37. + 0,8 В трех пунктах переноса электронов происходит наибольшее изменение свободной энергии и эти пункты называются
- 38. Пункты сопряжения постоянны, но их количество зависит от природы окисляемого субстрата. При окисления НАД – зависимых
- 39. Коэффициент окислительного фосфорилирование Р/О показывает, какое количество неорганического фосфата затрачивается для фосфорилирования АДФ при использовании 1
- 40. Коэффициент окислительного фосфорилирования НАД-Н+ + ½О2 →НАД+ + Н2О 3 АДФ + 3 Н3РО4→ 3 АТФ
- 41. Причины нарушения биологического окисления Недостаток субстрата (голодание, пищева-рение, межуточное нарушение обменов белков, углеводов, липидов); Недостаток О2
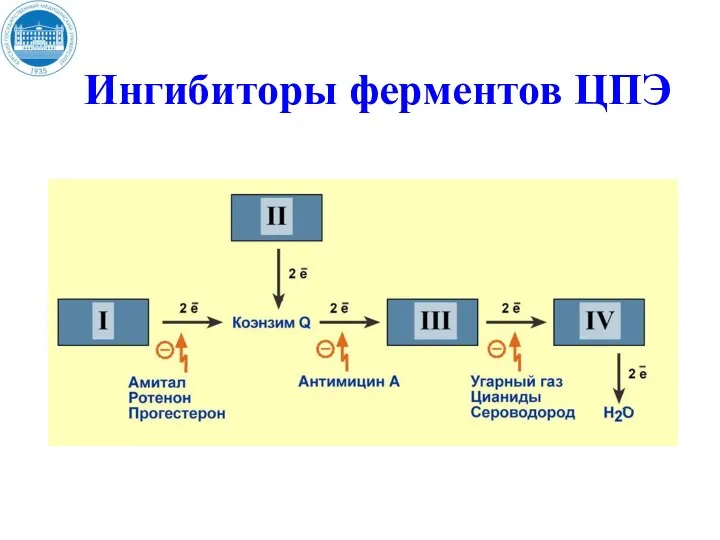
- 42. Вещества, понижающие интенсивность окислительного фосфолирирования АДФ. Ингибиторы ферментов ЦПЭ подавляют активность ферментных комплексов I, III и
- 43. Ингибиторы ферментов ЦПЭ ингибиторы NADH-дегидрогиназы - лекарственные препараты со снотворным действием – барбитураты (веронал, гексенал, нембутал,
- 44. Ингибиторы ферментов ЦПЭ
- 45. Вещество, способное полностью блокировать тканевое дыхание, синильная кислота Синильная кислота является веществом, вызывающим кислородное голодание тканевого
- 46. Вещество, способное полностью блокировать тканевое дыхание, синильная кислота Соединившись с цианидом, цитохромоксидаза теряет способность переносить электроны
- 47. Вещества, понижающие интенсивность окислительного фосфолирирования АДФ. Ингибиторы АТФ-синтазы снижают активность фермента, скорость фосфорилирования АДФ и коэффициент
- 48. Вещества, понижающие интенсивность окислительного фосфолирирования АДФ. Разобщители окисления и фосфорилирования – липофильные протонофоры способны легко проникать
- 50. Скачать презентацию




























 Щитовидная, паращитовидная, поджелудочная железы, надпочечники
Щитовидная, паращитовидная, поджелудочная железы, надпочечники Антропогенез. Этапы антропогенеза
Антропогенез. Этапы антропогенеза Презентация по биологии для учащихся 7 класса по теме Предмет зоологии. История зоологии
Презентация по биологии для учащихся 7 класса по теме Предмет зоологии. История зоологии Красная книга Чувашской Республики
Красная книга Чувашской Республики Мозжечок. Кора больших полушарий
Мозжечок. Кора больших полушарий Оплодотворение. Строение половых клеток
Оплодотворение. Строение половых клеток Дыхательная система организмов
Дыхательная система организмов Самые необычные цветы мира и удивительные животные
Самые необычные цветы мира и удивительные животные Генетика, как наука. Взаимосвязь процессов наследственности и изменчивости
Генетика, как наука. Взаимосвязь процессов наследственности и изменчивости Різновиди хижих рослин
Різновиди хижих рослин Как образуется плесень на хлебе
Как образуется плесень на хлебе Царство Грибы
Царство Грибы Гигиена содержания собак породы русский охотничий спаниель в условиях МУ МВД г. Раменское
Гигиена содержания собак породы русский охотничий спаниель в условиях МУ МВД г. Раменское Викторина Материки
Викторина Материки Внутренняя среда. Значение крови и ее состав. 8 класс
Внутренняя среда. Значение крови и ее состав. 8 класс Органические вещества липиды
Органические вещества липиды Биотехнология – достижения и проблемы
Биотехнология – достижения и проблемы Кожа. Поры
Кожа. Поры Быстрота, как физическое качество человека
Быстрота, как физическое качество человека Цитологические основы наследственности
Цитологические основы наследственности Семинар учителей биологии. Решение генетических задач
Семинар учителей биологии. Решение генетических задач Онтогенез и жизненный цикл особей
Онтогенез и жизненный цикл особей Памятный урок биологии для выпускников
Памятный урок биологии для выпускников Презентация к уроку биологии в 6 классе
Презентация к уроку биологии в 6 классе Презентации по биологии
Презентации по биологии Органография. Органы растений
Органография. Органы растений Природа человека. Теории происхождения человека
Природа человека. Теории происхождения человека Рыбы реки Ирень
Рыбы реки Ирень