Содержание
- 2. Фазовые переходы липидов в мембранах В водной среде липидные структуры ведут себя как анизотропные жидкости (жидкие
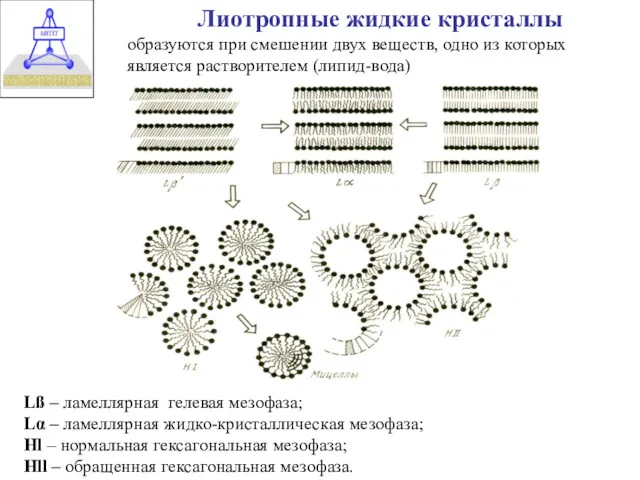
- 3. Лиотропные жидкие кристаллы образуются при смешении двух веществ, одно из которых является растворителем (липид-вода) Lß –
- 4. Гидратация липидов липид + Вода [мало ] гидратированный липид + Вода модификация полярной «головы» липида: увеличение
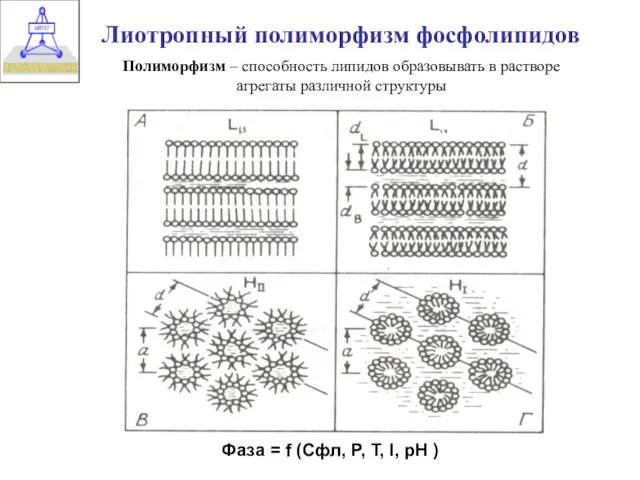
- 5. Лиотропный полиморфизм фосфолипидов Полиморфизм – способность липидов образовывать в растворе агрегаты различной структуры Фаза = f
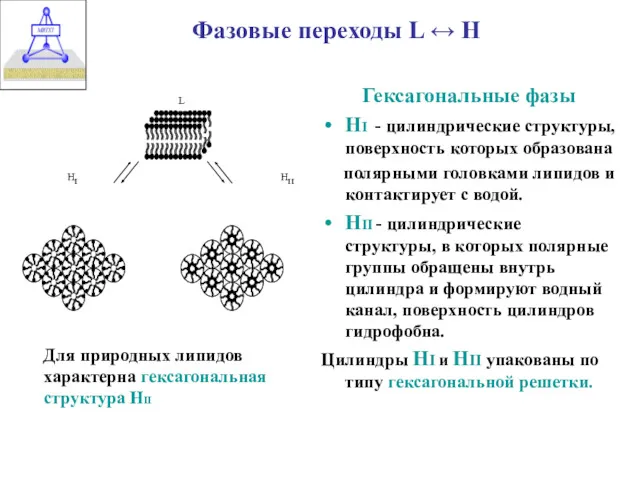
- 6. Фазовые переходы L ↔ H Гексагональные фазы НI - цилиндрические структуры, поверхность которых образована полярными головками
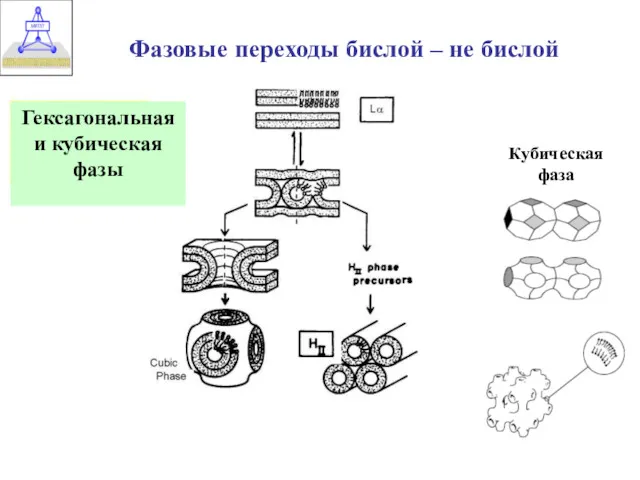
- 7. Фазовые переходы бислой – не бислой Гексагональная и кубическая фазы Кубическая фаза
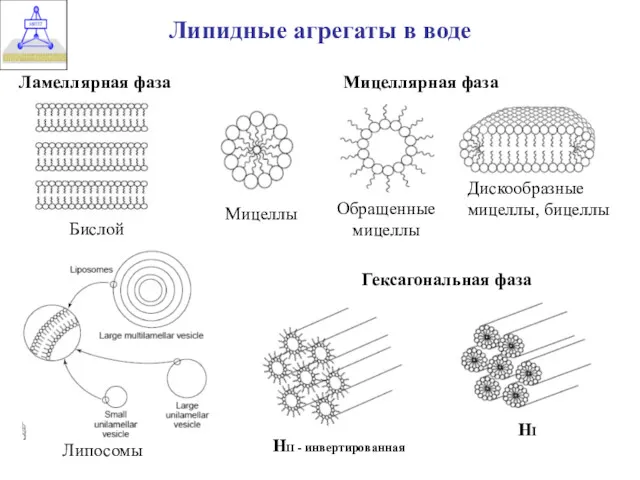
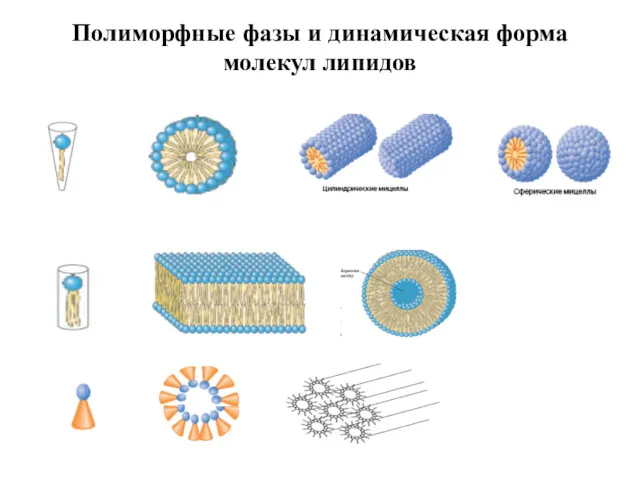
- 8. Липидные агрегаты в воде Бислой Мицеллярная фаза Обращенные мицеллы Дискообразные мицеллы, бицеллы Мицеллы Ламеллярная фаза Гексагональная
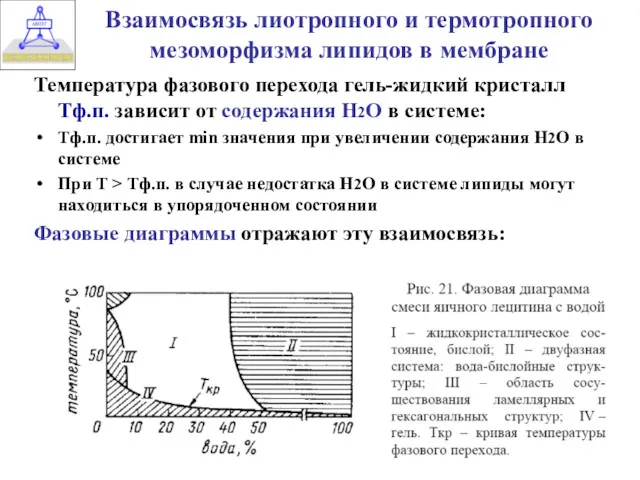
- 9. Взаимосвязь лиотропного и термотропного мезоморфизма липидов в мембране Температура фазового перехода гель-жидкий кристалл Тф.п. зависит от
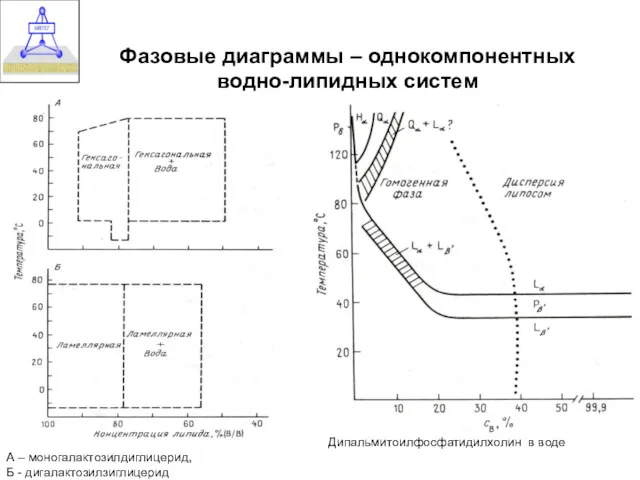
- 10. Фазовые диаграммы – однокомпонентных водно-липидных систем А – моногалактозилдиглицерид, Б - дигалактозилзиглицерид Дипальмитоилфосфатидилхолин в воде
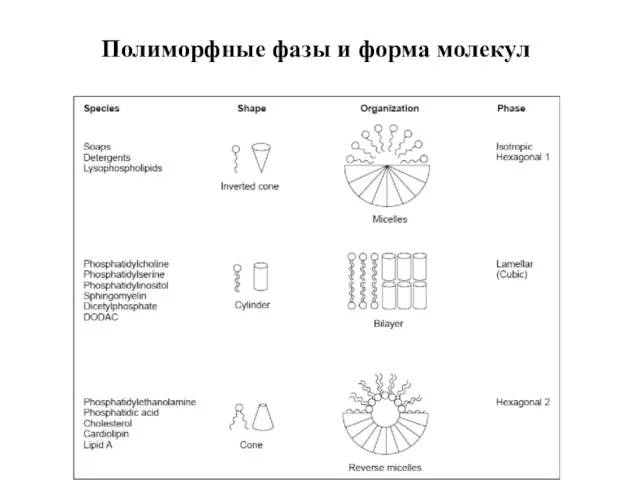
- 11. Критический параметр упаковки липидов Структура полиморфной фазы (мезофазы) определяется динамической формой молекулы липида. Геометрические размеры молекул
- 12. Критический параметр упаковки липидов Полная поверхность мицеллы - M·Sо=4πR*2 Полный объем мицеллы - M·v=4/3πR*3 → Радиус
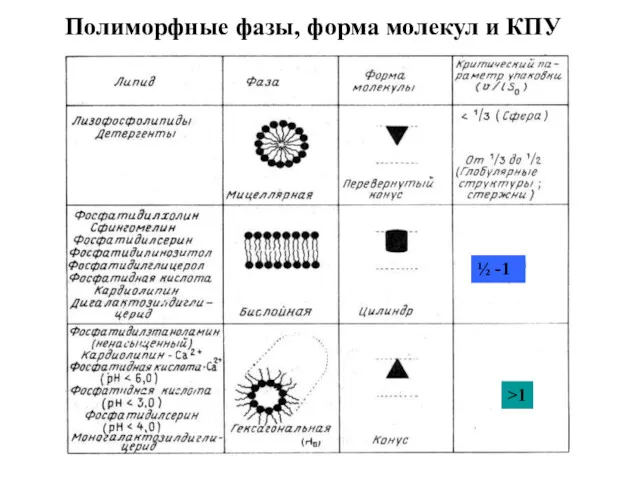
- 13. Полиморфные фазы, форма молекул и КПУ >1 ½ -1
- 14. Полиморфные фазы и форма молекул
- 15. Полиморфные фазы и динамическая форма молекул липидов
- 16. Методы изучения липидного полиморфизма - ЯМР – спектроскопия - Электронная микроскопия - Дифракционные методы
- 17. Метод Р ЯМР ФЛ – основные структурные элементы бислоя биомембран. ФЛ содержат, по крайней мере, один
- 18. Метод ЯМР на ядрах фосфора (31Р – ЯМР) 31Р-ЯМР – используют для изучения полиморфизма липидов с
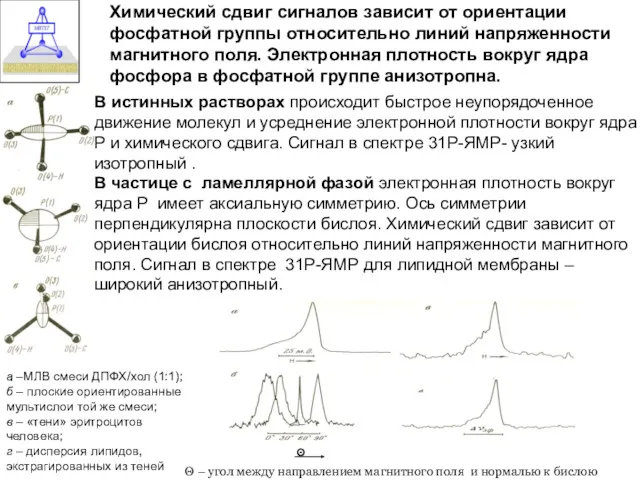
- 19. Химический сдвиг сигналов зависит от ориентации фосфатной группы относительно линий напряженности магнитного поля. Электронная плотность вокруг
- 20. Метод Р ЯМР Химический сдвиг сигналов зависит от ориентации фосфатной группы относительно линий напряженности магнитного поля.
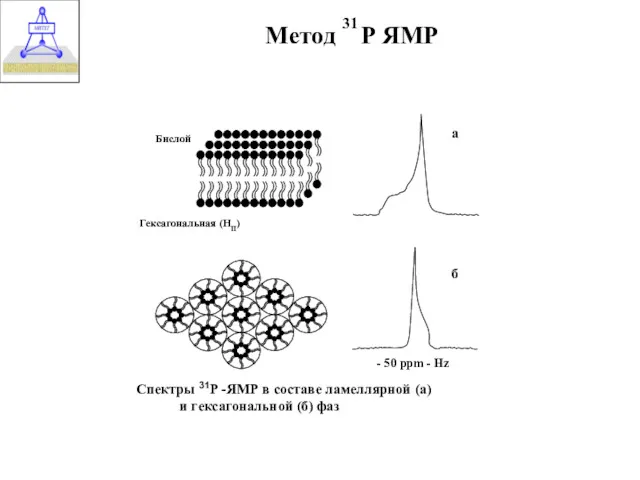
- 21. Метод Р ЯМР 31
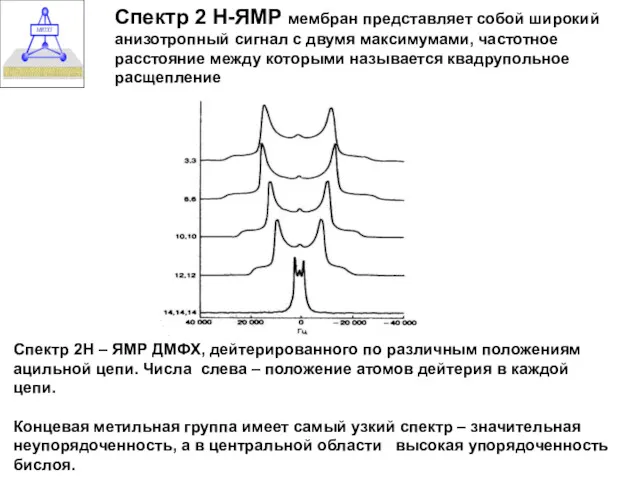
- 22. Метод Н ЯМР Спектр 2 Н-ЯМР мембран представляет собой широкий анизотропный сигнал с двумя максимумами, частотное
- 23. Спектр 2 Н-ЯМР мембран представляет собой широкий анизотропный сигнал с двумя максимумами, частотное расстояние между которыми
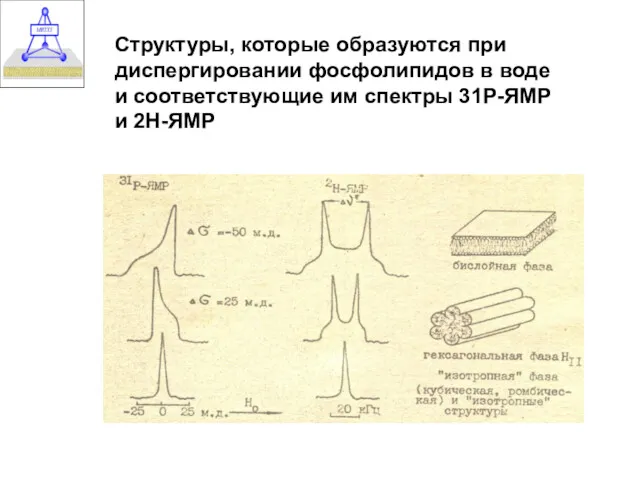
- 24. Структуры, которые образуются при диспергировании фосфолипидов в воде и соответствующие им спектры 31Р-ЯМР и 2Н-ЯМР
- 25. Электронная микроскопия Характеристика частиц по размеру и форме Методы: Просвечивающая микроскопия тонких срезов Замораживания-скалывания Негативное контрастирование
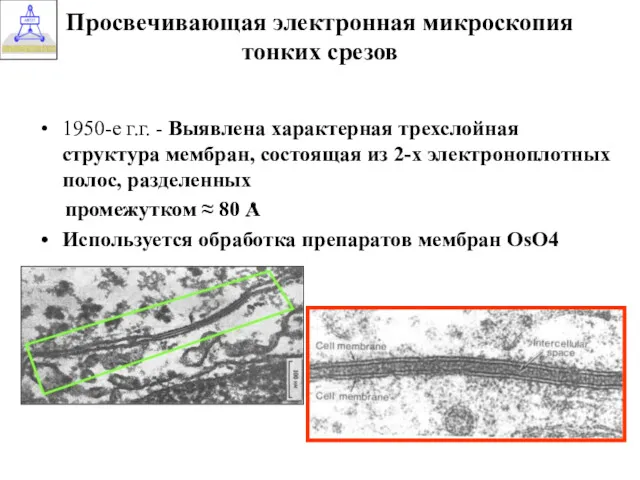
- 26. Просвечивающая электронная микроскопия тонких срезов 1950-е г.г. - Выявлена характерная трехслойная структура мембран, состоящая из 2-х
- 27. Метод замораживания-скалывания Усилия при скалывании замороженной клетки приводят к образованию среза, проходящего через образец. Оказалось, что
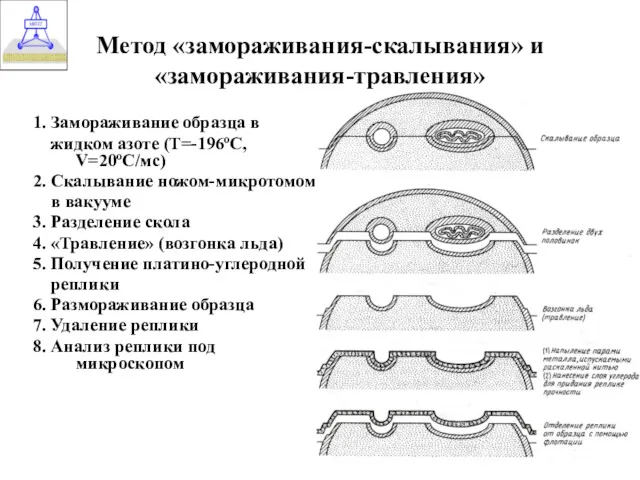
- 28. Метод «замораживания-скалывания» и «замораживания-травления» 1. Замораживание образца в жидком азоте (T=-196ºC, V=20ºC/мс) 2. Скалывание ножом-микротомом в
- 29. Электронные микрофотографии замороженных сколов Метод замораживания-скалывания
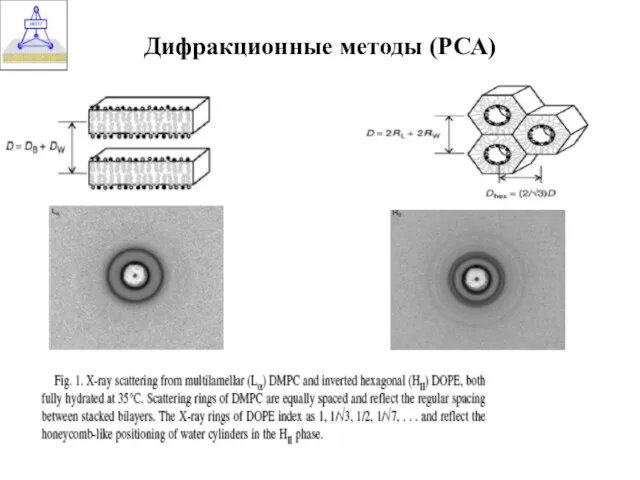
- 30. Дифракция рентгеновских лучей (РСА) Высокая упорядоченность кристаллических образцов – необходимое условие получения данных о структуре с
- 31. Дифракционные методы (РСА)
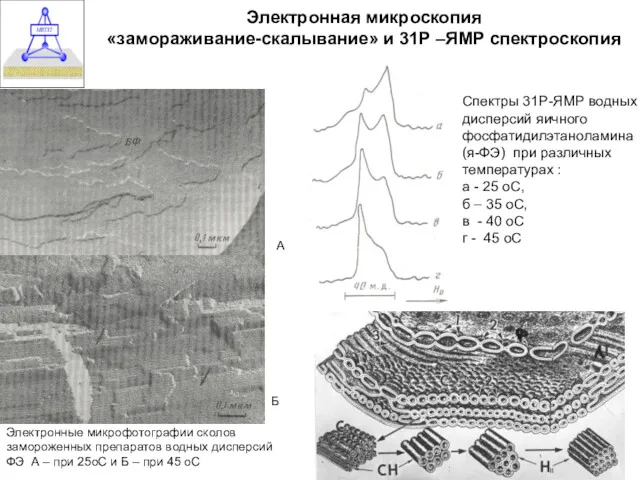
- 32. Электронная микроскопия «замораживание-скалывание» и 31Р –ЯМР спектроскопия Спектры 31Р-ЯМР водных дисперсий яичного фосфатидилэтаноламина (я-ФЭ) при различных
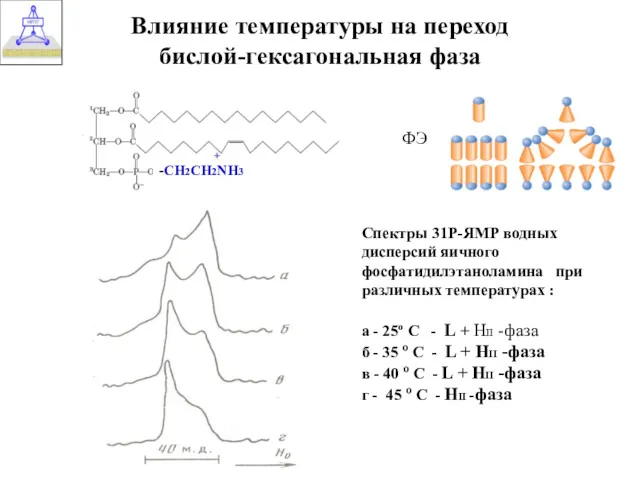
- 33. Спектры 31Р-ЯМР водных дисперсий яичного фосфатидилэтаноламина при различных температурах : а - 25º С - L
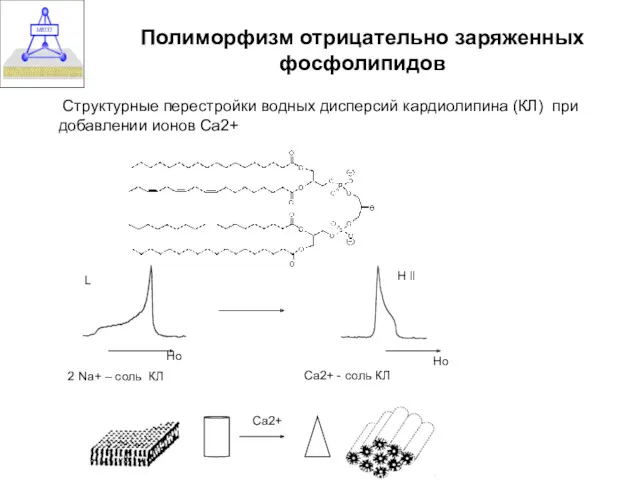
- 34. Полиморфизм отрицательно заряженных фосфолипидов Структурные перестройки водных дисперсий кардиолипина (КЛ) при добавлении ионов Са2+ 2 Na+
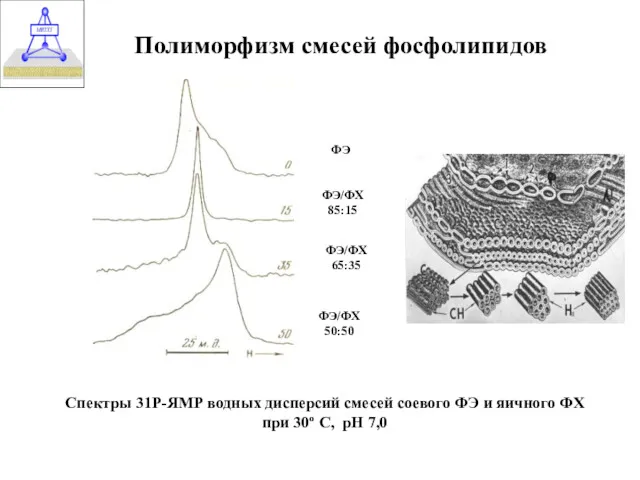
- 35. Полиморфизм смесей фосфолипидов ФЭ ФЭ/ФХ 85:15 ФЭ/ФХ 65:35 ФЭ/ФХ 50:50 Спектры 31Р-ЯМР водных дисперсий смесей соевого
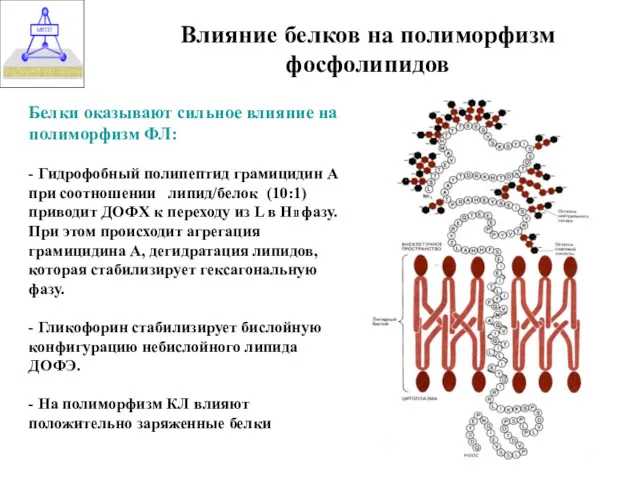
- 36. Влияние белков на полиморфизм фосфолипидов Белки оказывают сильное влияние на полиморфизм ФЛ: - Гидрофобный полипептид грамицидин
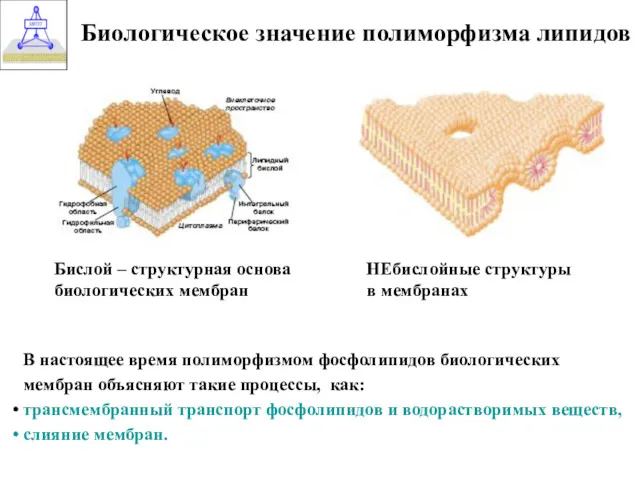
- 37. Биологическое значение полиморфизма липидов Бислой – структурная основа биологических мембран НЕбислойные структуры в мембранах В настоящее
- 39. Скачать презентацию

![Гидратация липидов липид + Вода [мало ] гидратированный липид + Вода модификация полярной](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/146151/slide-3.jpg)











 Понимание биологии. (Часть 2)
Понимание биологии. (Часть 2) Биология - наука о живом мире. Общие закономерности жизни
Биология - наука о живом мире. Общие закономерности жизни Модификационная изменчивость
Модификационная изменчивость Критерии вида (биологические задачи)
Критерии вида (биологические задачи) Презентация Здоровье – ключ к успеху
Презентация Здоровье – ключ к успеху Як змінюється навесні життя риб?
Як змінюється навесні життя риб? Асқорыту жүйесі
Асқорыту жүйесі Разнообразие насекомых
Разнообразие насекомых Терморегуляция
Терморегуляция История развития генетики. Основные понятия
История развития генетики. Основные понятия Перешеек ромбовидного мозга. Средний и промежуточный мозг
Перешеек ромбовидного мозга. Средний и промежуточный мозг Непрямой онтогенез
Непрямой онтогенез Inorganic substances. Water. Mineral salts
Inorganic substances. Water. Mineral salts Тварини-рекордсмени
Тварини-рекордсмени Презентация Отряд Перепончатокрылые
Презентация Отряд Перепончатокрылые Развитие пищеварительной системы, оболочки пищеварительной трубки. Слизистая оболочка полости рта
Развитие пищеварительной системы, оболочки пищеварительной трубки. Слизистая оболочка полости рта Газообмен. Диффузия свободных молекул газа (O2 и СО2)
Газообмен. Диффузия свободных молекул газа (O2 и СО2) Антигени. Класифікація антигенів
Антигени. Класифікація антигенів Человек как уникальный вид живой природы
Человек как уникальный вид живой природы Биологическое действие радиации
Биологическое действие радиации Хвойные растения
Хвойные растения Яблони. Классификация сортов
Яблони. Классификация сортов Презентация к уроку Тип Плоские черви
Презентация к уроку Тип Плоские черви Влияние хозяйственной деятельности на окружающую среду
Влияние хозяйственной деятельности на окружающую среду ГМО. Еда. Питание
ГМО. Еда. Питание Наука биология
Наука биология Сердечнососудистая система
Сердечнососудистая система Растения Дальневосточного региона
Растения Дальневосточного региона