Содержание
- 2. Ферменттер- Ферменттер лат. fermentum - ашытқы (энзимдер – enzyme - ашытқылар) – тірі ағзаның биохимиялық реакциясын
- 3. Жасушада 10 мыңдаған ферментативтік реакциялар өтеді. Барлық биохимиялық процесс ферменттер көмегімен жүреді. Бір ферменттің жұмысының тежелуі
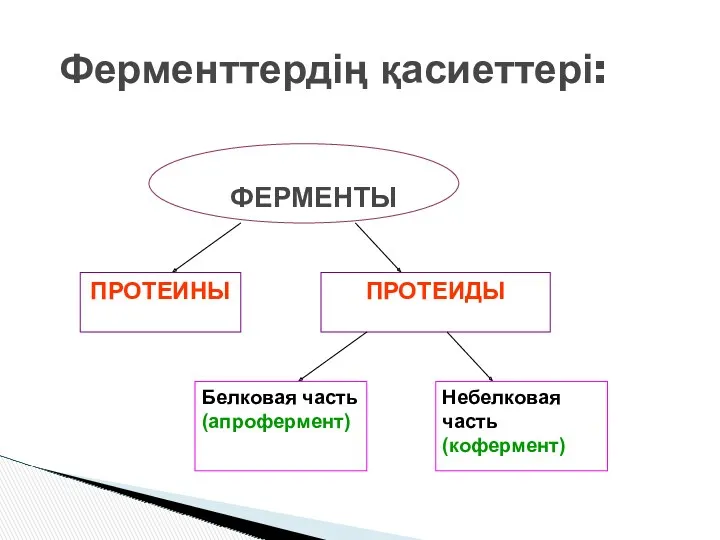
- 4. Ферменттердің қасиеттері:
- 5. Нәруызды бөлігі – субстраттың бекінуін қамтамасыз етеді. Коферменттер – нәруызды емес бөлігі, катализды жүзеге асырады.
- 6. Әр ферментте бірегей үш құрылым болады Әр ферменттің өз белсенді орталығы бар Фермент тек бір реакцияны
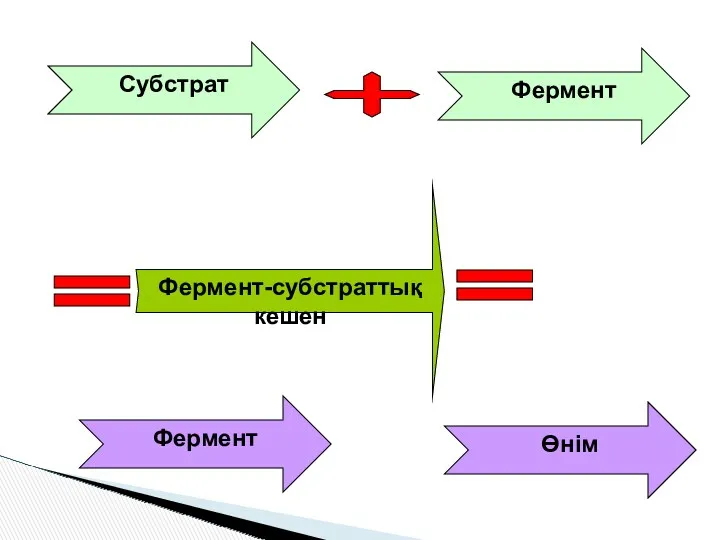
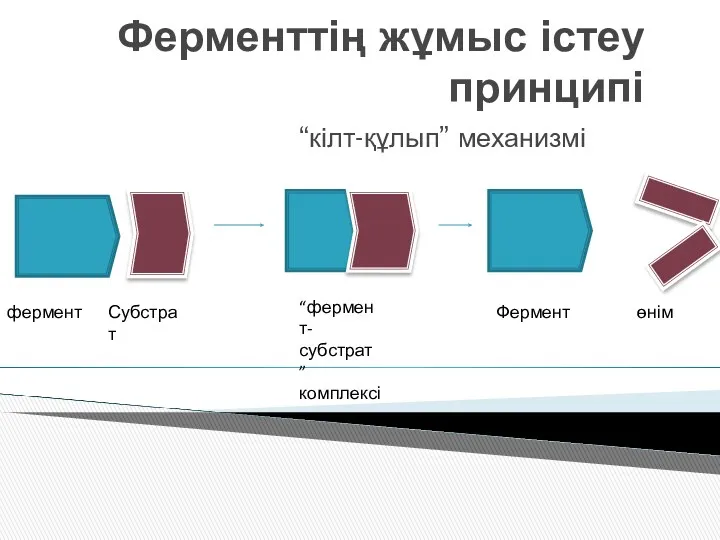
- 8. Ферменттің жұмыс істеу принципі “кілт-құлып” механизмі фермент Субстрат “фермент-субстрат ” комплексі Фермент өнім
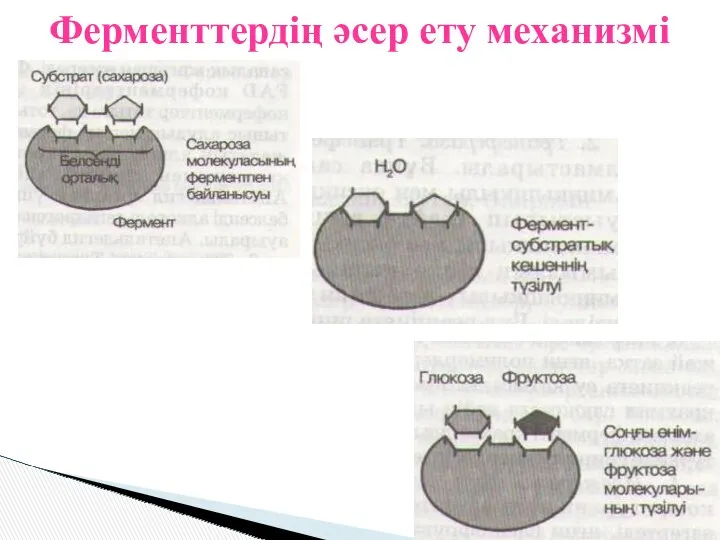
- 9. Ферменттердің әсер ету механизмі
- 10. Реакцияға белгілі бір химиялық топтың қосылуы немесе бөлініп шығуы қажет болса , онда бұл процеске ферменттен
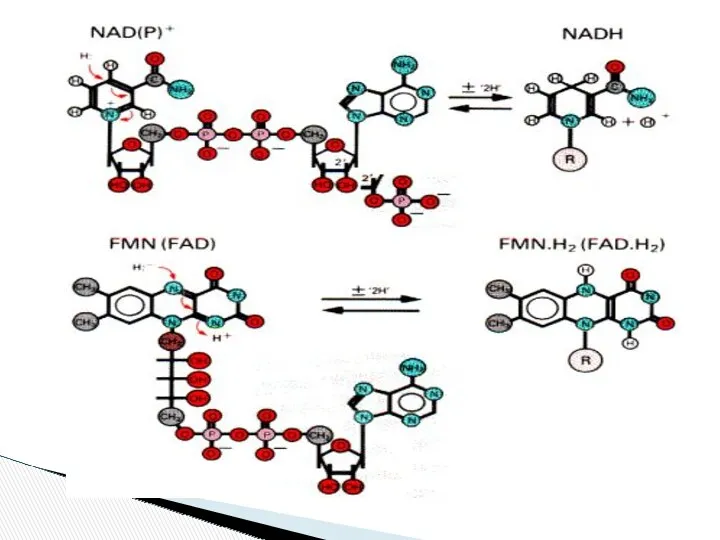
- 11. Коферментке көпшілік витаминдер қатысады. NAD→ Cубстраттан сутекті қосып алады→NADH-қа айналады АТФ коферменті фосфор қышқылының қалдығын қосып
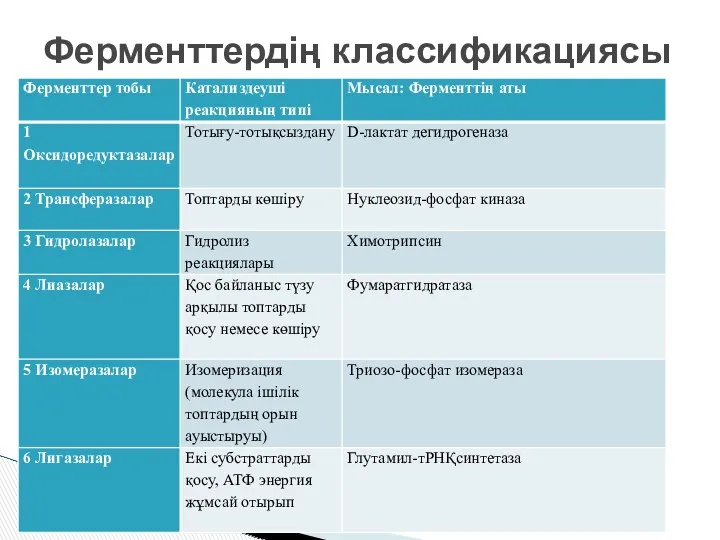
- 12. 1. Дегидрогеназа немесе оксидоредуктаза тотығу –тотықсыздану реакцияларын жүргізеді. Коферменттер- NAD, NADP, FAD Бұл коферменттер тотыға да
- 14. 2. Трансфераза Екі заттың топтарын өзара алмастырады М: амин қышқылы мен оксиқышқылы арасында амин топтарын орын
- 15. Молекулалардың конфигурациясын өзгертеді М: D формадан L формаға өзгертеді Фермент: глюкофруктоизомераза Тәтті емес глюкоза қантын→ тәтті
- 16. Заттардың қос байланысы бар жеріне әсер етіп өзгертеді Фермент: фосфоэнолпируваткиназа М: қос байланыс бар жерге фосфат
- 17. Күрделі заттарды жай заттарға ыдыратады Бұл реакцияға су қатысады. М: Крахмал→глюкоза Ферменттер: амилаза, пепсин, трипсин, лигаза
- 18. Энергияның көмегімен молекулаларға әр түрлі заттарды байланыстырады. Фермент: ДНК- лигазалар ДНК молекулаларын қосу үшін керек Лигазалар
- 19. Каталаза ферментінің 1 ғана молекуласы ағзада қосылыстардың тотығуынан пайда болған, ағза үшін улы сутек асқын тотығының
- 20. Ферменттердің классификациясы
- 21. Ферментердің ерекшелігі: арнайы бір органикалық қосылыстарға әсер етуі.
- 22. Зәрді : Н2N-СО-NН2+Н2О →2NН3+СО2 Оған туыстас зат метил зәр қышқылына әсер етпейді. Осы қасиетінінің арқасында тірі
- 23. Қалыпты температурада Қалыпты қысымда Әлсіз қышқылдық ортада Әлсіз негіздік ортада жұмыс істейді. Әр ферменттің рН көрсеткіші
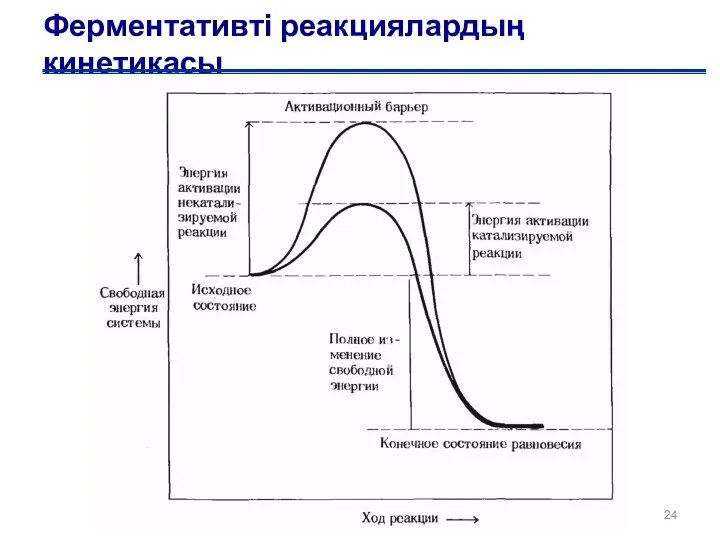
- 24. Ферментативті реакциялардың кинетикасы
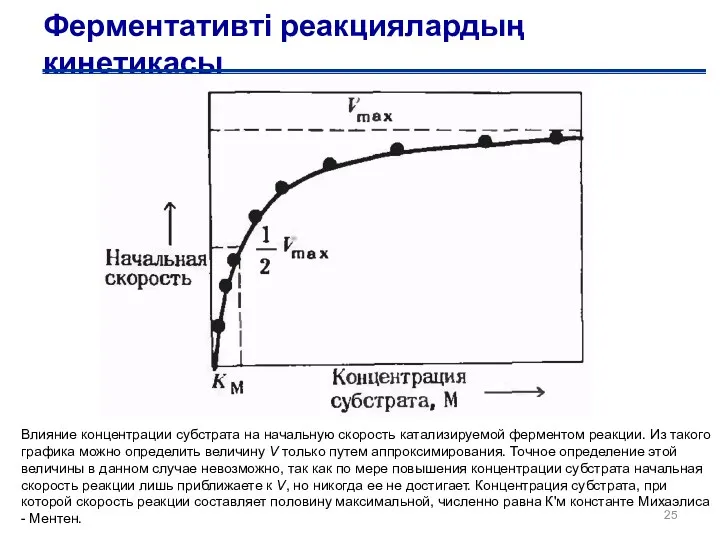
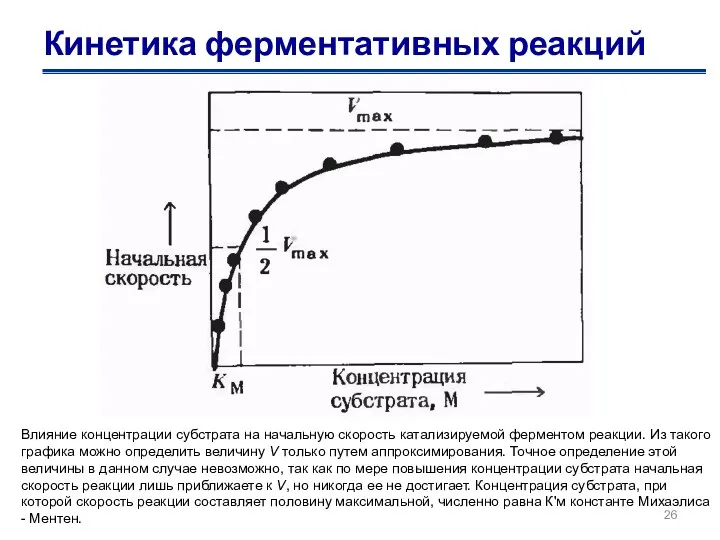
- 25. Ферментативті реакциялардың кинетикасы Влияние концентрации субстрата на начальную скорость катализируемой ферментом реакции. Из такого графика можно
- 26. Кинетика ферментативных реакций Влияние концентрации субстрата на начальную скорость катализируемой ферментом реакции. Из такого графика можно
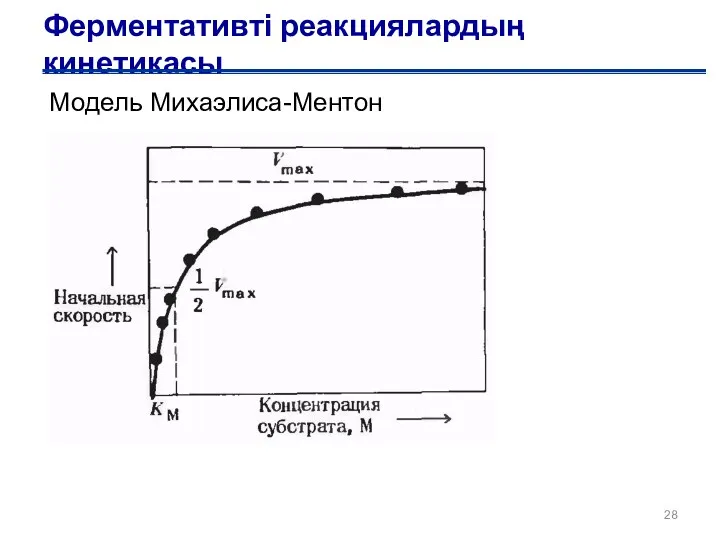
- 27. Ферментативті реакциялардың кинетикасы Виктор Генри (1903 г.) Леонор Михаэлис, Мод Ментен (1913 г.)
- 28. Ферментативті реакциялардың кинетикасы Модель Михаэлиса-Ментон
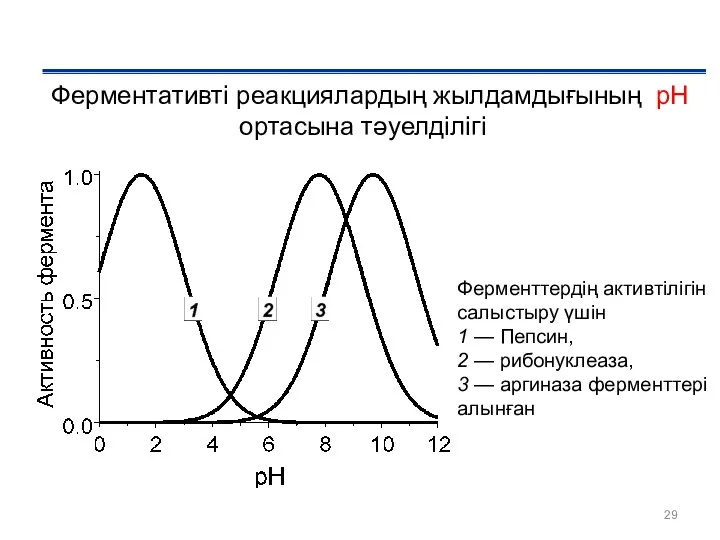
- 29. Ферментативті реакциялардың жылдамдығының рН ортасына тәуелділігі Ферменттердің активтілігін салыстыру үшін 1 — Пепсин, 2 — рибонуклеаза,
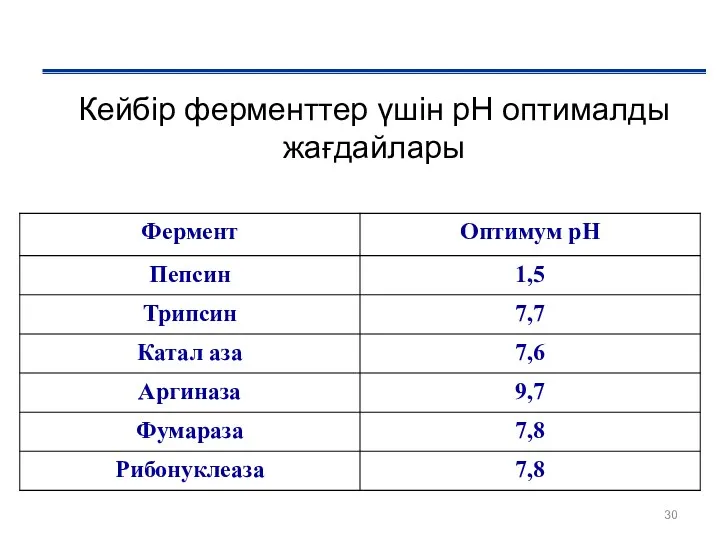
- 30. Кейбір ферменттер үшін рН оптималды жағдайлары
- 33. Скачать презентацию

















 Серый журавль
Серый журавль Biologics in Rheumatology
Biologics in Rheumatology Бионика: новейшие достижения и будущие
Бионика: новейшие достижения и будущие Эволюционная теория Жана Батиста Ламарка
Эволюционная теория Жана Батиста Ламарка Бактерії шкідливі чи корисні
Бактерії шкідливі чи корисні Искусственное осеменение коров
Искусственное осеменение коров Физиология возбудимых тканей
Физиология возбудимых тканей Породы собак
Породы собак Устройство увеличительных приборов по учебному предмету Биология (5 класс)
Устройство увеличительных приборов по учебному предмету Биология (5 класс) Общая характеристика типа Хордовые. Подтип Бесчерепные. Беспозвоночные. Позвоночные
Общая характеристика типа Хордовые. Подтип Бесчерепные. Беспозвоночные. Позвоночные Рефлексы. Условные и безусловные рефлексы. 8 класс
Рефлексы. Условные и безусловные рефлексы. 8 класс Размножение и развитие животных
Размножение и развитие животных Внутренняя среда организма. Значение крови и её состав
Внутренняя среда организма. Значение крови и её состав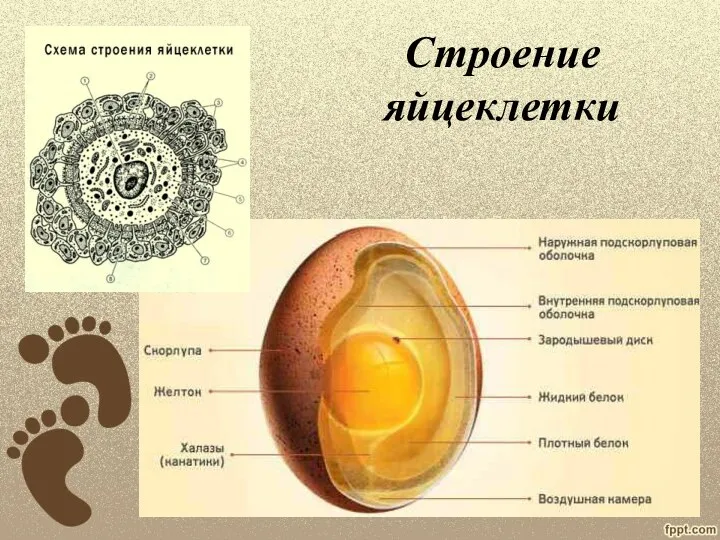 Презентация к уроку Эмбриональное развитие человека.
Презентация к уроку Эмбриональное развитие человека. Биоинформатические подходы к анализу РНК. Экспрессия генов: анализ микроэррейных данных. Лекция 8
Биоинформатические подходы к анализу РНК. Экспрессия генов: анализ микроэррейных данных. Лекция 8 Классификация животного мира. 7 класс
Классификация животного мира. 7 класс Дыхание животных. Презентация по биологии для 7 класса
Дыхание животных. Презентация по биологии для 7 класса Универсальность строительных и функциональных блоков на молекулярном уровне организации биологических систем
Универсальность строительных и функциональных блоков на молекулярном уровне организации биологических систем Перелётные птицы (загадки)
Перелётные птицы (загадки) Опора и движение. Вопросы и ответы по анатомии и физиологии опорно-двигательного аппарата
Опора и движение. Вопросы и ответы по анатомии и физиологии опорно-двигательного аппарата Қазақстандағы бауырмен жорғалаушылардың ресурстары
Қазақстандағы бауырмен жорғалаушылардың ресурстары Органы дыхания
Органы дыхания Ткани, образующие организм человека
Ткани, образующие организм человека Різноманітний світ тварин
Різноманітний світ тварин Как животные приспосабливаются к среде обитания
Как животные приспосабливаются к среде обитания Презентация к уроку биологии в 6 классе
Презентация к уроку биологии в 6 классе Законы зависимости организмов от факторов среды
Законы зависимости организмов от факторов среды Дезоксирибонуклеиновая кислота (ДНК)
Дезоксирибонуклеиновая кислота (ДНК)