Содержание
- 2. «Жизнь – сложная совокупность химических реакций, катализируемых специфическими ферментами» И.П. Павлов
- 3. Ферменты – это специфические белки клеток, выполняющие роль биологических катализаторов. За исключением рибозимов – молекул РНК,
- 4. История изучения ферментов В 1877 немецкий физиолог Wilhelm Kühne (Кюне) предложил термин «энзим». 50-е г 19
- 5. Химическая природа ферментов Ферментативная активность пропорциональна количеству белка. Обладают физико-химическими свойствами белков. Получены в виде кристаллов
- 6. Свойства ферментов Не расходуются в реакции. Проявляют эффект в малых концентрациях. Не влияют на величину констант
- 7. Отличие от неорганических катализаторов ферменты термолабильны; активность зависит от рН; обладают специфичностью действия; скорость ферментативных реакций
- 8. Механизм действия ферментов Е + S ↔ [ ЕS ] → E +P Е – фермент
- 9. Механизмы, облегчающие ферментативный катализ. Пространственный (сближением). Кислотно-основной катализ (семейство аспартатных протеаз – пепсин, лизосомальные катепсины, HIV).
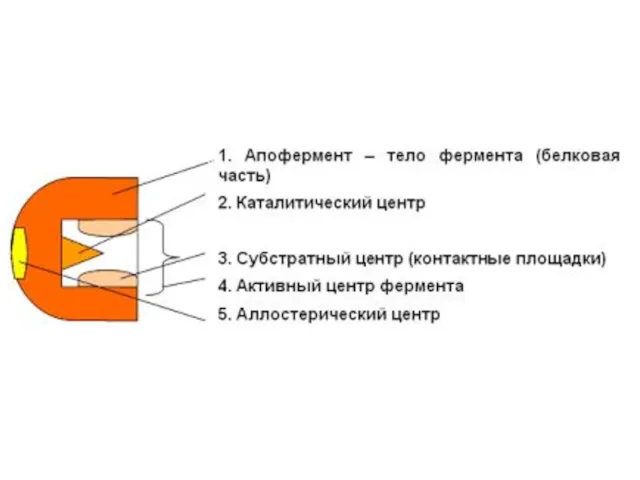
- 11. Строение фермента
- 13. Активный центр фермента - участок молекулы фермента, который специфически взаимодействует с субстратом. В активном центре различают:
- 14. Аллостерический центр - участок молекулы фермента, с которым связываются активаторы или ингибиторы. В результате происходят конформационные
- 15. Структура фермента Простые ферменты – состоят только из аминокислот. Сложные ферменты – кроме белковой части содержит
- 16. Простетическая группа – небелковая часть, которая плотно и стабильно встраивается в белковую структуру фермента с помощью
- 17. Кофакторы – выполняют такую же функцию как и простетические группы, но находятся в нестабильной, диссоциированой форме
- 18. Коферменты группа транспортных агентов (рециклические переносчики), которые переносят многие субстраты для ферментативных реакций в пределах клетки.
- 19. Some enzymes or enzyme complexes require several cofactors. For example, the multienzyme complex pyruvate dehydrogenase[5] at
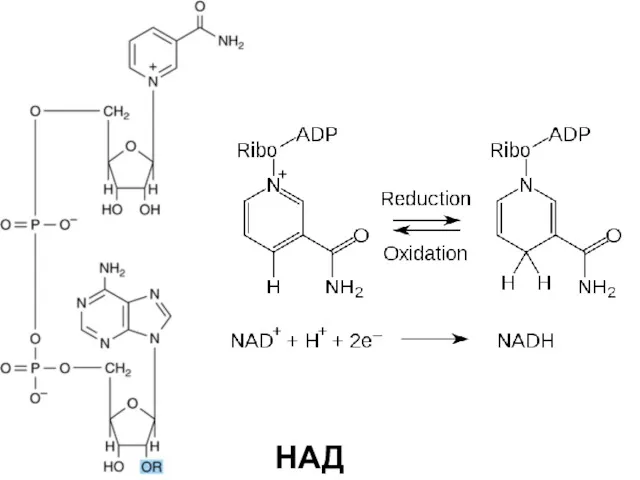
- 20. К коферментам относятся : производные витаминов (группы В): никотинамид (В3) – компонент кофермента НАД и НАДФ;
- 21. НАД
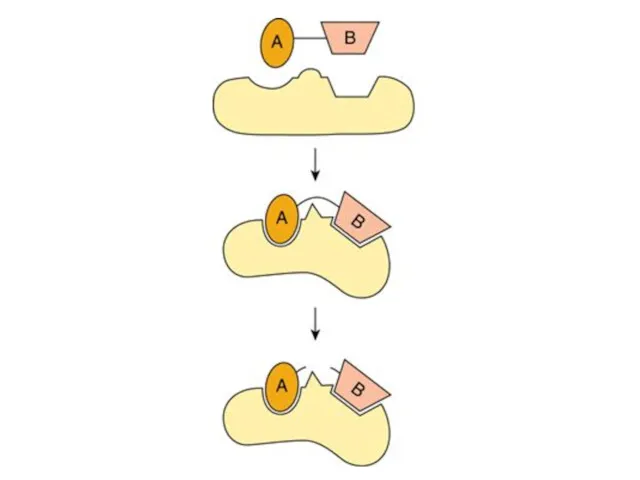
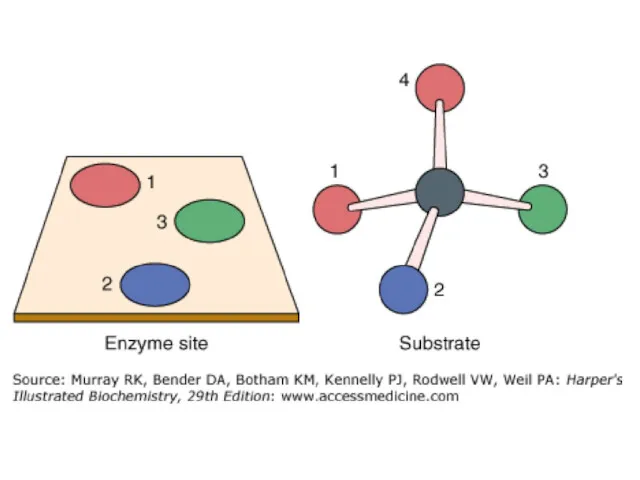
- 22. Гипотезы взаимодейсвия фермента с субстратом I. Теория Фишера – «ключ - замок» Строгое соответствие конформации субстрата
- 24. II. Теория Кошленда – «рука - перчатка» Активный центр фермента может подстраиваться под форму субстрата.
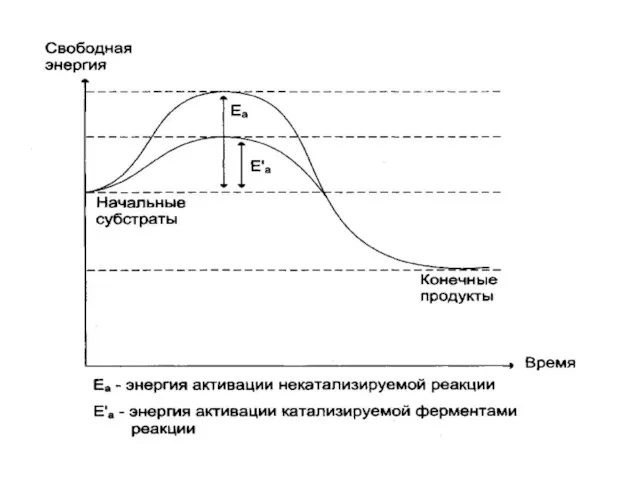
- 25. Снижают энергию активации молекул субстрата. Энергия активации – энергия, необходимая для перевода молекул 1 моля субстрата
- 27. Специфичность действия ферментов абсолютная (уреаза); относительная (липаза) ; относительная групповая (трипсин); стереохимическая (фумараза).
- 28. Классификация ферментов Оксидоредуктазы; Трансферазы; Гидролазы; Лиазы; Изомеразы; Лигазы (синтетазы).
- 29. Номенклатура ферментов Рабочее название. Систематическое название. Шифр фермента: 1-ая цифра – класс фермента; 2-ая – подкласс;
- 30. Гексокиназа АТФ : D-гексоза 6 фосфотрансфераза Гексоза 6 – фосфорилировние происходит по 6-му углеродному атому гексоз.
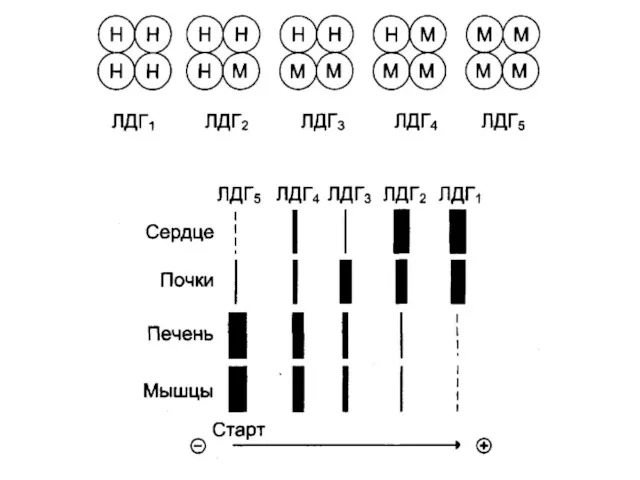
- 31. ИЗОФЕРМЕНТЫ Это множественные формы фермента, которые катализируют одну и ту же реакцию. Могут отличаться: по структуре
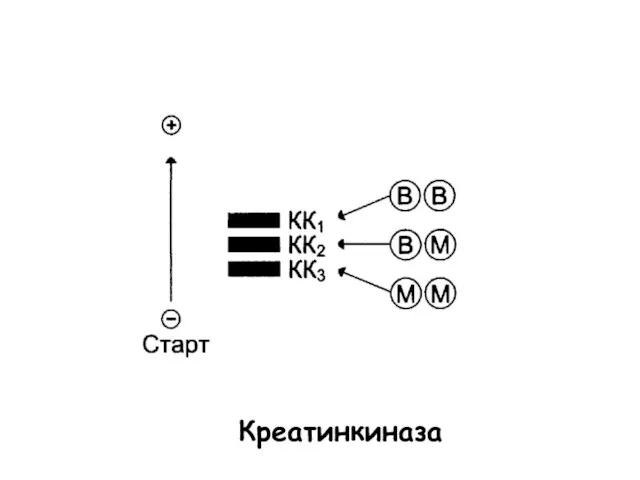
- 33. Креатинкиназа
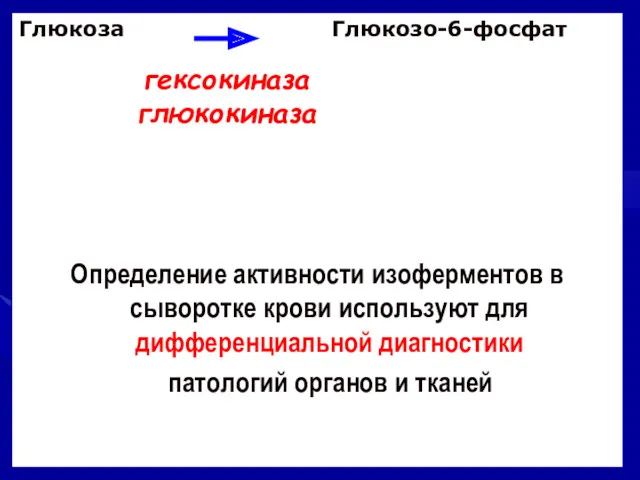
- 34. Глюкоза Глюкозо-6-фосфат Определение активности изоферментов в сыворотке крови используют для дифференциальной диагностики патологий органов и тканей
- 35. Единицы измерения активности ферментов Катал - (моль/сек) IU – международная единица (мкмоль / мин) Удельная активность
- 37. Скачать презентацию






![Механизм действия ферментов Е + S ↔ [ ЕS ]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/136348/slide-7.jpg)



















 презентация по биологии Гидра пресноводнаядля 7 класса
презентация по биологии Гидра пресноводнаядля 7 класса Голосеменные растения
Голосеменные растения 20231130_9_klass._stroenie_lyogkih._gazoobmen
20231130_9_klass._stroenie_lyogkih._gazoobmen Жизнь и творчество И.И.Левитана
Жизнь и творчество И.И.Левитана Генетика 2
Генетика 2 Моногибридное скрещивание
Моногибридное скрещивание Растения Донского края
Растения Донского края Удивительные факты из жизни рыб
Удивительные факты из жизни рыб Тема Тип Членистоногие
Тема Тип Членистоногие Влияние социальных факторов на развитие и становление вида Homo Sapiens
Влияние социальных факторов на развитие и становление вида Homo Sapiens Сравнительная характеристика классов типа Моллюски
Сравнительная характеристика классов типа Моллюски Рукотворная жизнь. Окружающий мир. 4 класс
Рукотворная жизнь. Окружающий мир. 4 класс Animal’s world
Animal’s world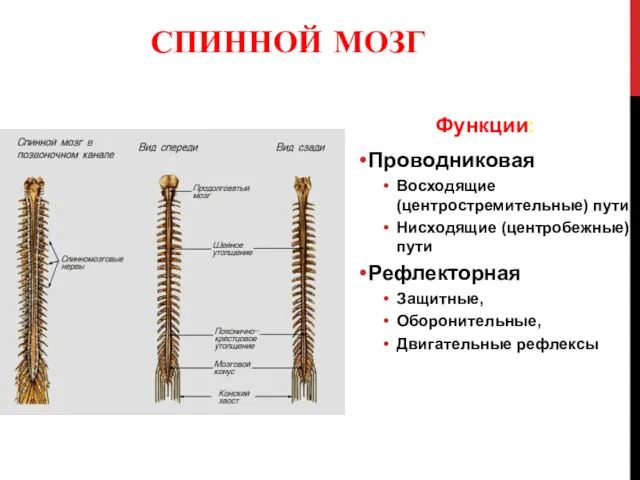 Спинной мозг (medulla spinalis). Лекция №3
Спинной мозг (medulla spinalis). Лекция №3 Красота мира растений
Красота мира растений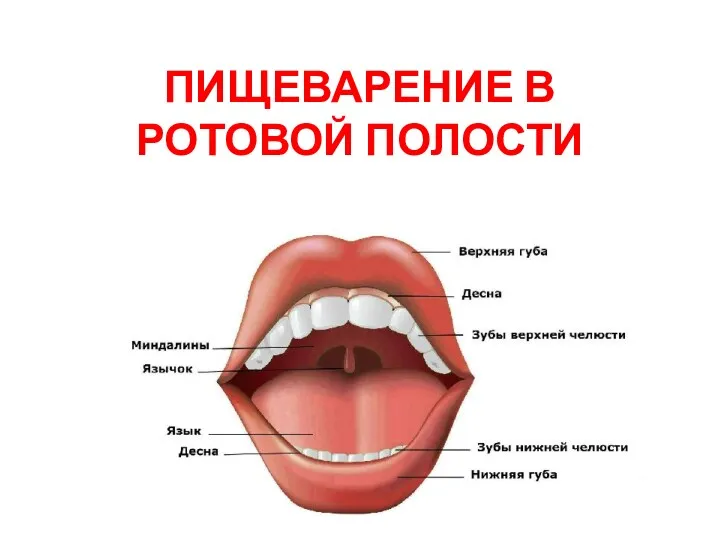 Пищеварение в ротовой полости
Пищеварение в ротовой полости Ядовитые растения, произрастающие в Ленинградской области
Ядовитые растения, произрастающие в Ленинградской области Fruits and their classification. Spreading of fruits and seeds
Fruits and their classification. Spreading of fruits and seeds Пищеварение в желудке и 12-п. кишке. Лекция 26
Пищеварение в желудке и 12-п. кишке. Лекция 26 Формы размножения живых организмов
Формы размножения живых организмов Грибы. Окружающий мир 3 класс (по учебнику Н.Ф.Виноградовой, Г.С. Калиновой)
Грибы. Окружающий мир 3 класс (по учебнику Н.Ф.Виноградовой, Г.С. Калиновой) Царства живой природы
Царства живой природы Паразитизм в типе. Плоские черви
Паразитизм в типе. Плоские черви Мейоз. Первое и второе мейотическое деление. Биологическое значение кроссинговера
Мейоз. Первое и второе мейотическое деление. Биологическое значение кроссинговера Человек родился. Биологическая наследственность
Человек родился. Биологическая наследственность Электрофорез белков в геле
Электрофорез белков в геле Тип Черви
Тип Черви Вступ до курсу медичної біології. Структурно-функціональна організація клітини
Вступ до курсу медичної біології. Структурно-функціональна організація клітини