Содержание
- 2. Кинетика ферментативных реакций Кинетика – изучает скорость химической реакции и её зависимость от факторов - to,
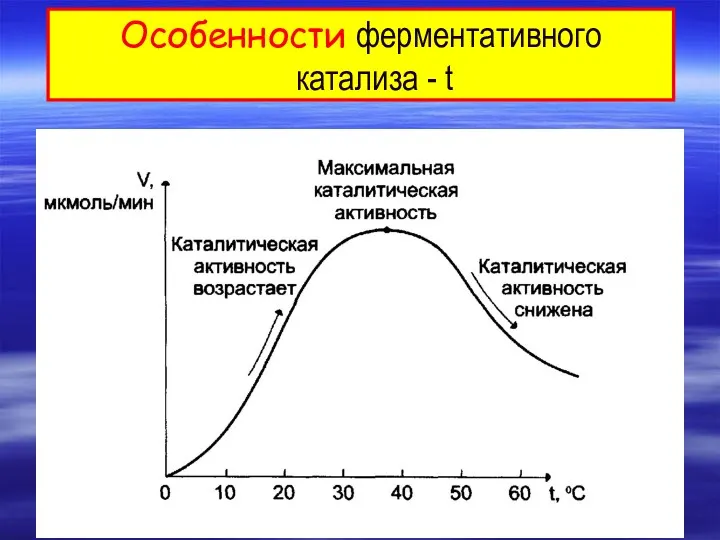
- 3. Особенности ферментативного катализа - t
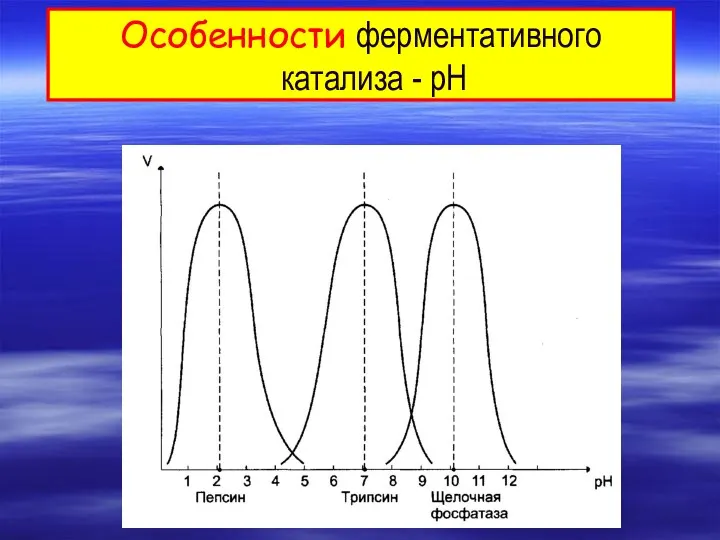
- 4. Особенности ферментативного катализа - pH
- 5. Особенности ферментативного катализа – [S]
- 6. Особенности ферментативного катализа – [E]
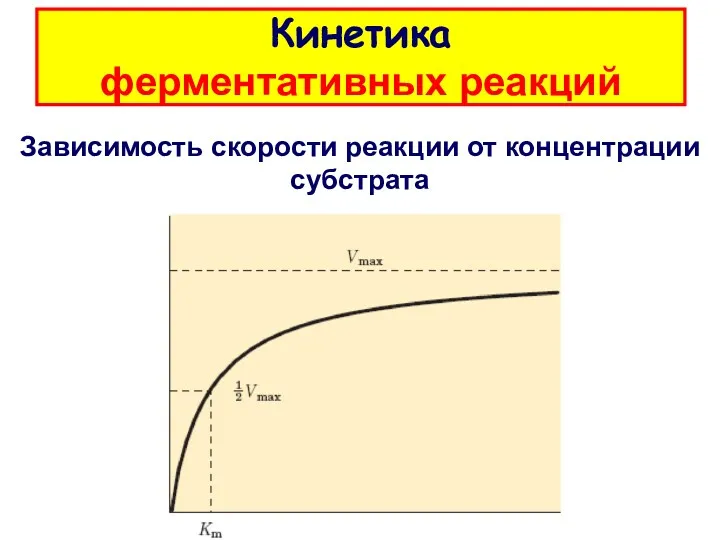
- 7. Кинетика ферментативных реакций Зависимость скорости реакции от концентрации субстрата
- 8. Кинетика ферментативных реакций Уравнение Михаэлиса – Ментен V0 = Vmax [S] Km + [S]
- 9. Л. Михаэлис М. Ментен
- 10. V0 = k2[ES] [Et] – общий уровень фермента, участвующего в реакции на данный момент. [Et] -
- 11. (Образование) ES = k1([Et] - [ES])[S] (Распад) ES = k-1[ES] + k2[ES]
- 12. k1([Et] - [ES])[S] (Образование) ES = k1([Et] - [ES])[S] (Распад) ES = k-1[ES] + k2[ES]
- 13. k1([Et] - [ES])[S] =
- 14. k1([Et] - [ES])[S] = k-1[ES] + k2[ES]
- 15. k1[Et][S] - k1[ES][S] = k-1[ES] + k2[ES]
- 16. k1[Et][S] - k1[ES][S] = k-1[ES] + k2[ES]
- 17. k1[Et][S] = (k1[S] + k-1 + k2)[ES]
- 18. k1[Et][S] = (k1[S] + k-1 + k2)[ES] Решаем уравнение относительно [ES]:
- 19. /K1
- 20. Соотношение суммы констант скорости распада к константе скорости синтеза получило название константа Михаэлиса - Km (k2
- 22. V0 = k2[ES]
- 23. Максимальная скорость - Vmax возможна при условии полного насыщения фермента субстратом, т.е. когда [ES] = [Et]
- 25. Зависимость скорости реакции от концентрации субстрата V [S]
- 26. V0 = ½ Vmax При условии подставляем в уравнение
- 27. разделив обе половины уравнения на Vmax получаем: решая его относительно Km получаем: Km + [S] =
- 28. Константа Михаэлиса - это концентрация субстрата при которой скорость ферментативной реакции ровна половине максимальной. Km =
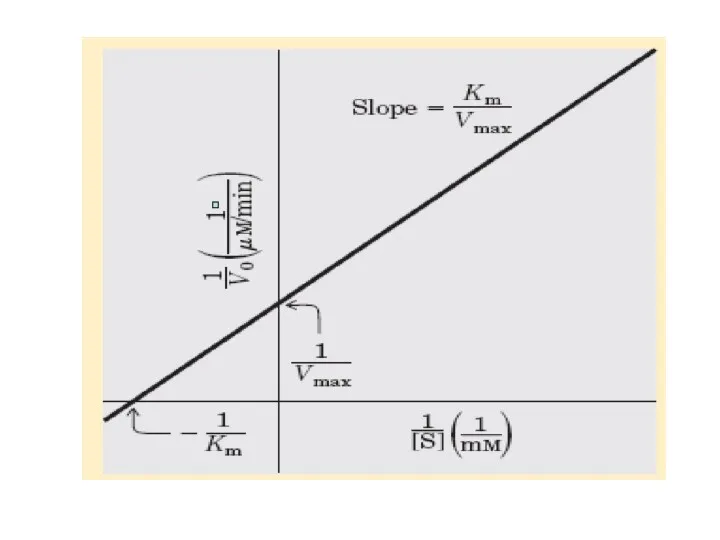
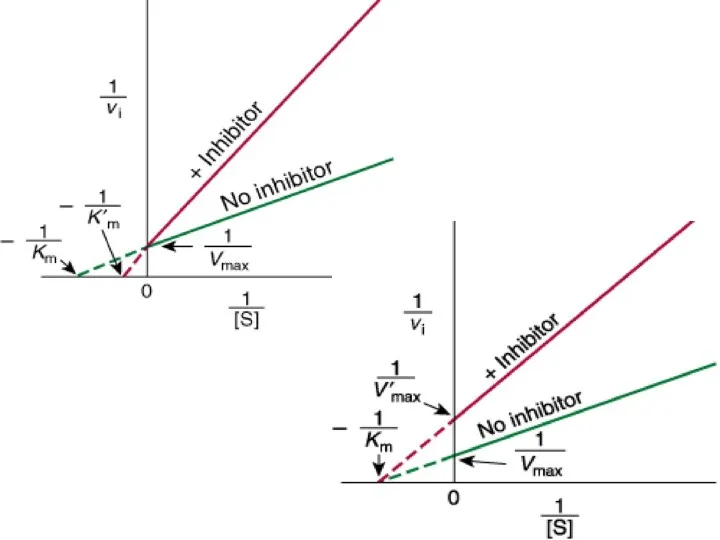
- 29. Уравнение Лайнвивер-Бэрка (Lineweaver-Burk).
- 30. Уравнение и график Лайнуивера -Берка
- 32. Активаторы ферментов Повышают ферментативную активность; Формируют конформацию активного центра фермента; Облегчают образование фермент- субстратного комплекса; Стабилизируют
- 33. Ингибиторы ферментов НЕСПЕЦИФИЧЕСКИЕ. СПЕЦИФИЧЕСКИЕ: А) НЕОБРАТИМЫЕ Б) ОБРАТИМЫЕ: - КОНКУРЕНТНЫЕ - НЕКОНКУРЕНТНЫЕ.
- 34. НЕСПЕЦИФИЧЕСКИЕ ИНГИБИТОРЫ Вызывают денатурацию молекулы фермента – кислоты, щелочи, соли тяжелых металлов.
- 35. НЕОБРАТИМЫЕ ИНГИБИТОРЫ Необратимое ингибирование -наблюдается при образовании ковалентных связей между ингибитором и активным центром фермента. Фермент
- 36. ОБРАТИМЫЕ ИНГИБИТОРЫ Связываются с активным центром фермента слабыми нековалентными связями и легко отделяются от фермента. Обратимые
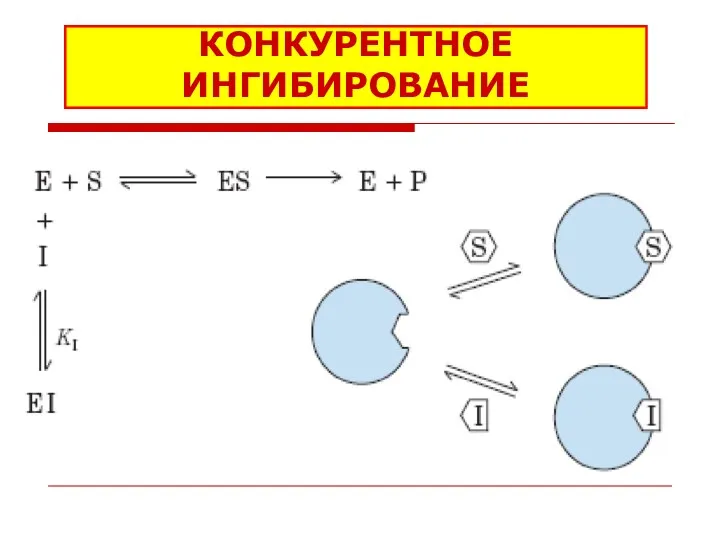
- 37. КОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ
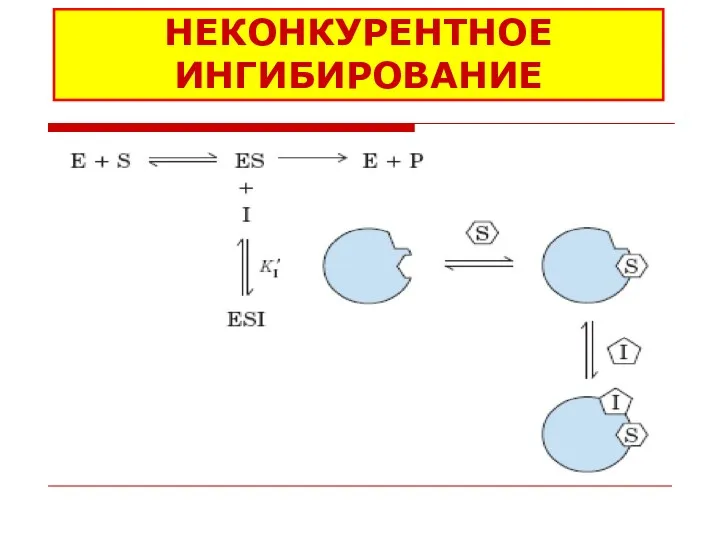
- 38. НЕКОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ
- 40. Регуляция активности ферментов 1) Активация ферментов при присоединении регуляторных белков – аденилатциклаза 2) Изменение активности ферментов
- 41. 3) Химическая модификация фермента Регуляция активности ферментов путем фосфорилирования/дефосфорилирования фосфорилаза Регуляция активности ферментов частичным протеолизом пепсиноген
- 43. Скачать презентацию

![Особенности ферментативного катализа – [S]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/187198/slide-4.jpg)
![Особенности ферментативного катализа – [E]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/187198/slide-5.jpg)
![Кинетика ферментативных реакций Уравнение Михаэлиса – Ментен V0 = Vmax [S] Km + [S]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/187198/slide-7.jpg)

![V0 = k2[ES] [Et] – общий уровень фермента, участвующего в](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/187198/slide-9.jpg)
![(Образование) ES = k1([Et] - [ES])[S] (Распад) ES = k-1[ES] + k2[ES]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/187198/slide-10.jpg)
![k1([Et] - [ES])[S] (Образование) ES = k1([Et] - [ES])[S] (Распад) ES = k-1[ES] + k2[ES]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/187198/slide-11.jpg)
![k1([Et] - [ES])[S] =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/187198/slide-12.jpg)
![k1([Et] - [ES])[S] = k-1[ES] + k2[ES]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/187198/slide-13.jpg)
![k1[Et][S] - k1[ES][S] = k-1[ES] + k2[ES]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/187198/slide-14.jpg)
![k1[Et][S] - k1[ES][S] = k-1[ES] + k2[ES]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/187198/slide-15.jpg)
![k1[Et][S] = (k1[S] + k-1 + k2)[ES]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/187198/slide-16.jpg)
![k1[Et][S] = (k1[S] + k-1 + k2)[ES] Решаем уравнение относительно [ES]:](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/187198/slide-17.jpg)



![V0 = k2[ES]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/187198/slide-21.jpg)

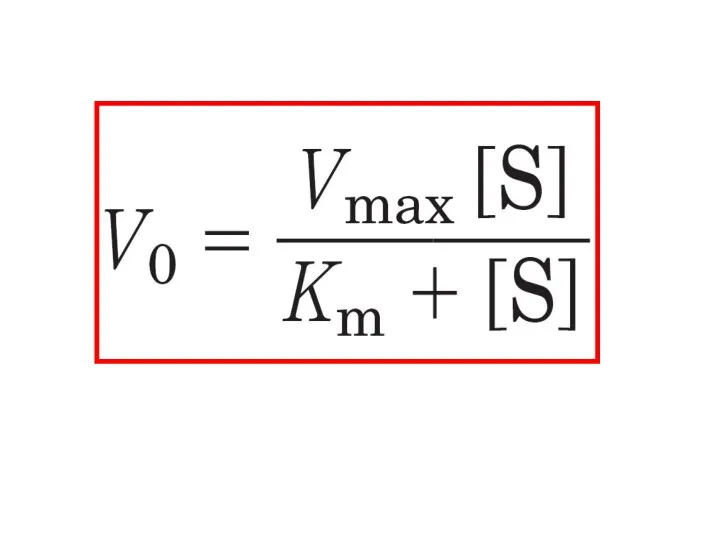
![Зависимость скорости реакции от концентрации субстрата V [S]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/187198/slide-24.jpg)












 Организация генома. Прокариот и эукариот
Организация генома. Прокариот и эукариот Ягоды. Кроссворд
Ягоды. Кроссворд Обитатели тайги
Обитатели тайги Bases of phytocenology
Bases of phytocenology Опорно-двигательная система. Скелет, строение и соединение костей
Опорно-двигательная система. Скелет, строение и соединение костей Мутации – изменения в структуре генов
Мутации – изменения в структуре генов Минеральные вещества. Эндемические заболевания
Минеральные вещества. Эндемические заболевания Охраняемые животные в российской Артике
Охраняемые животные в российской Артике Общая характеристика транспортных процессов в клетке
Общая характеристика транспортных процессов в клетке Размножение и развитие организмов
Размножение и развитие организмов Растения-рекордсмены
Растения-рекордсмены Царство Животные
Царство Животные Зернобобові культури. Лекція 3
Зернобобові культури. Лекція 3 Химический состав растений
Химический состав растений Продукция пчеловодства: мед, прополис, пчелиный яд, маточное молочко, пыльца, воск. Урок 203-204
Продукция пчеловодства: мед, прополис, пчелиный яд, маточное молочко, пыльца, воск. Урок 203-204 Влияние СМИ и компьютера на здоровье подростков
Влияние СМИ и компьютера на здоровье подростков Нервная и гуморальная регуляция функций организма
Нервная и гуморальная регуляция функций организма Растениеводство. Гречиха, как культурное растение
Растениеводство. Гречиха, как культурное растение Биохимия нервной ткани. (Лекция 23)
Биохимия нервной ткани. (Лекция 23) Вирусы. Особенности вирусов
Вирусы. Особенности вирусов Таргетинг генов
Таргетинг генов Лишайники. Разнообразие
Лишайники. Разнообразие Презентация Многообразие биогеоценозов
Презентация Многообразие биогеоценозов Оплодотворение. Этапы
Оплодотворение. Этапы Невидимые нити. Окружающий мир, 2 класс
Невидимые нити. Окружающий мир, 2 класс Биоэнергетика мышечной деятельности
Биоэнергетика мышечной деятельности Дыхательная система человека
Дыхательная система человека Водне середовище життя. Пристосування організмів до життя у воді
Водне середовище життя. Пристосування організмів до життя у воді