Содержание
- 2. Ферменты (энзимы) специфические и высокоэффективные катализаторы химических реакций, протекающих в живой клетке Энзимология один из главных
- 3. Обмен веществ был бы невозможен без участия биологических катализаторов – ферментов Биокаталитически ускоряются самые различные превращения
- 4. Сходство и отличия ферментов и традиционных катализаторов
- 5. не создают реакции, а лишь ускоряют достижение равновесия ускоряют реакции за счет снижения энергии активации Катализаторы
- 6. Н2О2 → Н2О + ½ О2 Еа = 75,24 кДж/моль (18 ккал/моль) Мелкодисперсная Pt ускоряет реакцию
- 7. Бо́льшая эффективность Отличия ферментов и традиционных катализаторов
- 8. Ферменты проявляют высокую каталитическую активность в очень мягких условиях температура (?) давление (?) рН (?) Гидролиз
- 9. Высокая специфичность действия пределы ее у разных ферментов различны Отличия ферментов и традиционных катализаторов
- 10. Виды специфичности ферментов Относительная (групповая) Наибольшее значение – тип химической связи в молекуле субстрата Пепсин расщепляет
- 11. Виды специфичности ферментов Абсолютная Фермент катализирует превращение одного-единственного субстрата Аргиназа ускоряет гидролиз аргинина Уреаза – мочевины
- 12. Виды специфичности ферментов стереохимическая обусловлена существованием оптически активных субстратов оксидазы L- и D-аминокислот аспартатдекарбоксилаза (отщепление СО2
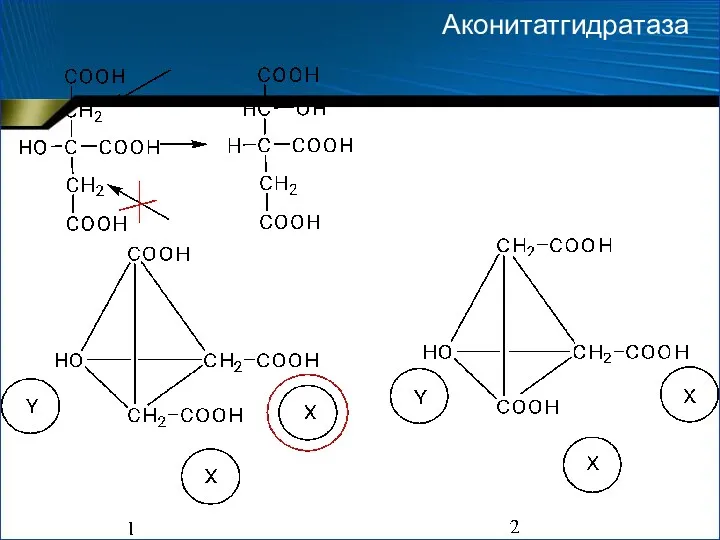
- 13. Аконитатгидратаза
- 14. Отличия, связанные с белковой природой ферментов (термолабильность, зависимость активности от рН, наличие активаторов и ингибиторов и
- 15. Строение ферментов
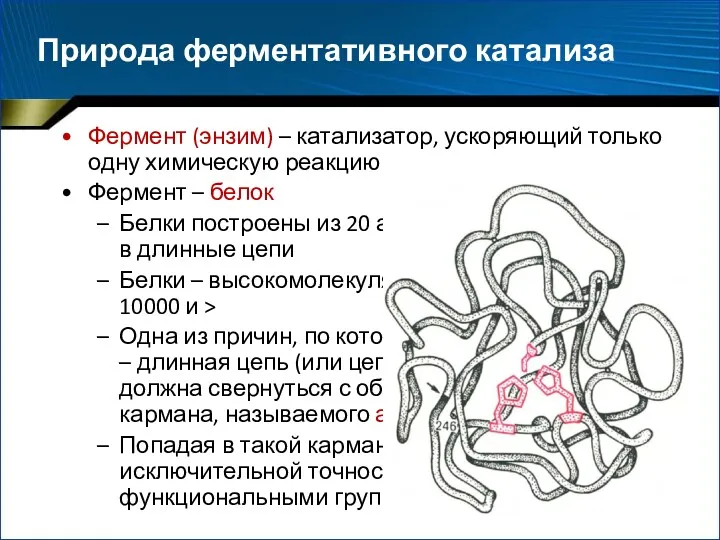
- 16. Природа ферментативного катализа Фермент (энзим) – катализатор, ускоряющий только одну химическую реакцию Фермент – белок Белки
- 17. Простые (однокомпонентные) Сложные (двухкомпонентные)
- 18. Однокомпонентные ферменты (ферменты-протеины) Каталитический центр Субстратный центр Субстратный центр может совпадать (или перекрываться) с каталитическим Каталитический
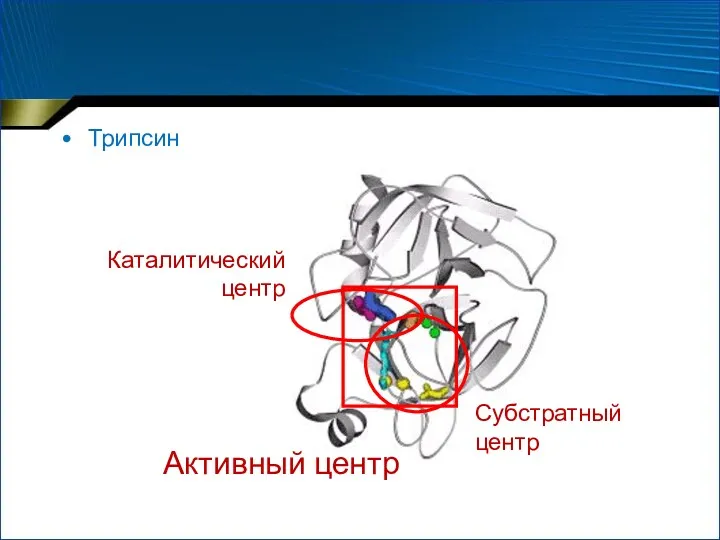
- 19. Трипсин Каталитический центр Субстратный центр Активный центр
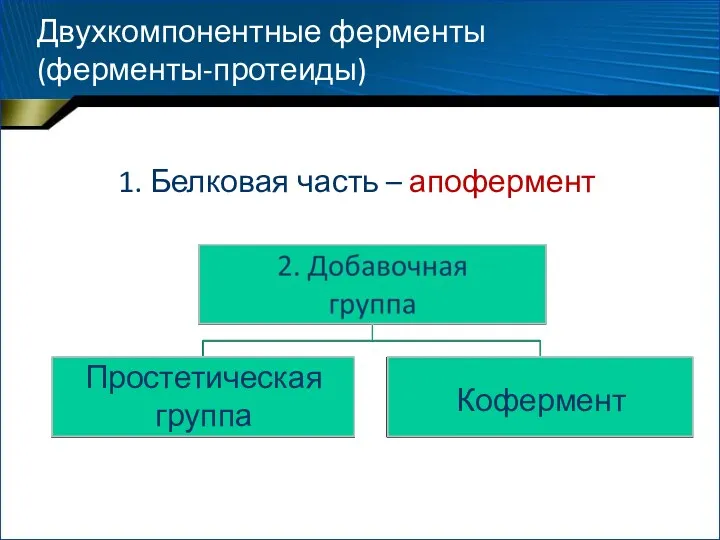
- 20. Двухкомпонентные ферменты (ферменты-протеиды) Простетическая группа Кофермент 1. Белковая часть – апофермент
- 21. Природа коферментов (О. Г. Варбург, Р. Кун, П. Каррер) Витамины (Е, К, Q, В1, В2, В6,
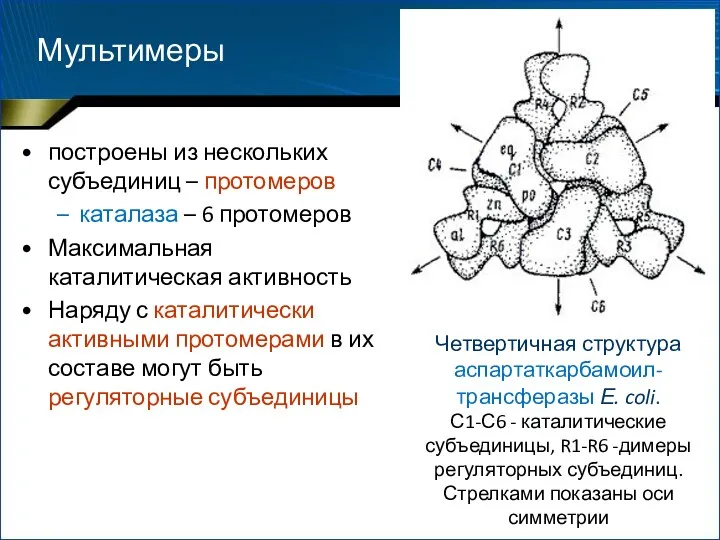
- 22. построены из нескольких субъединиц – протомеров каталаза – 6 протомеров Максимальная каталитическая активность Наряду с каталитически
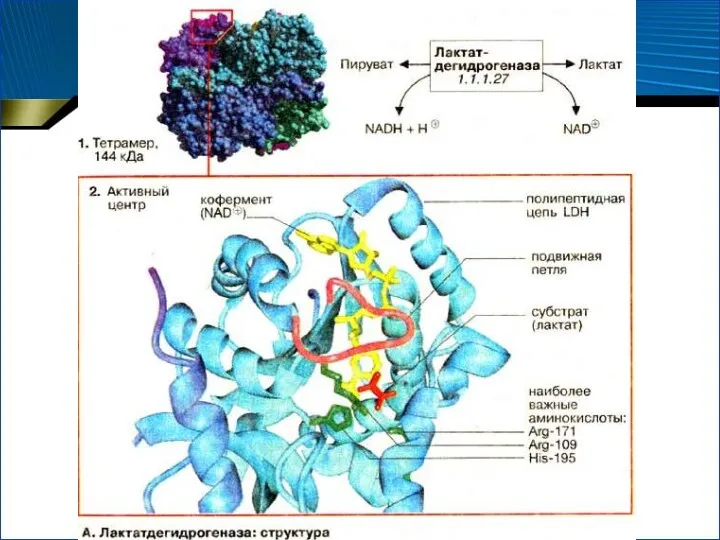
- 23. лактатдегидрогеназа НННН, НННМ, ННММ, НМММ, ММММ H – от англ. heart – сердце M – от
- 25. отличаются по степени активности по некоторым физическим свойствам по локализации в органах и тканях и т.
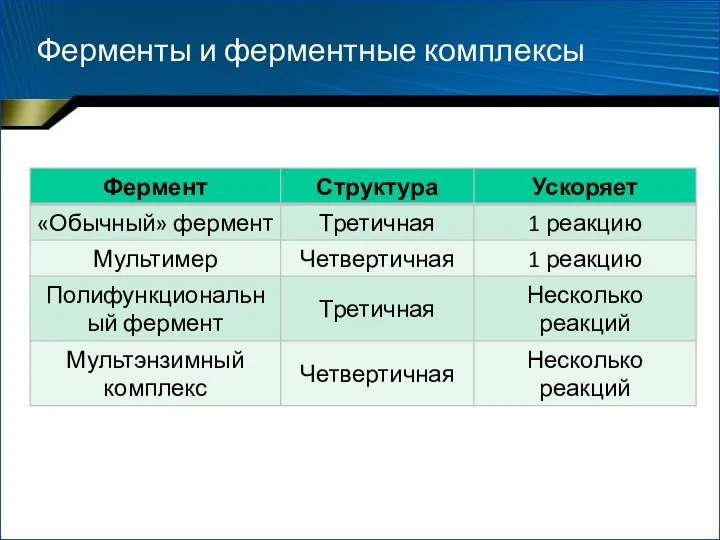
- 26. ферменты, способные одновременно ускорять несколько химических реакций и осуществлять сложные превращения субстрата пируватдегидрогеназный комплекс Мультиэнзимы
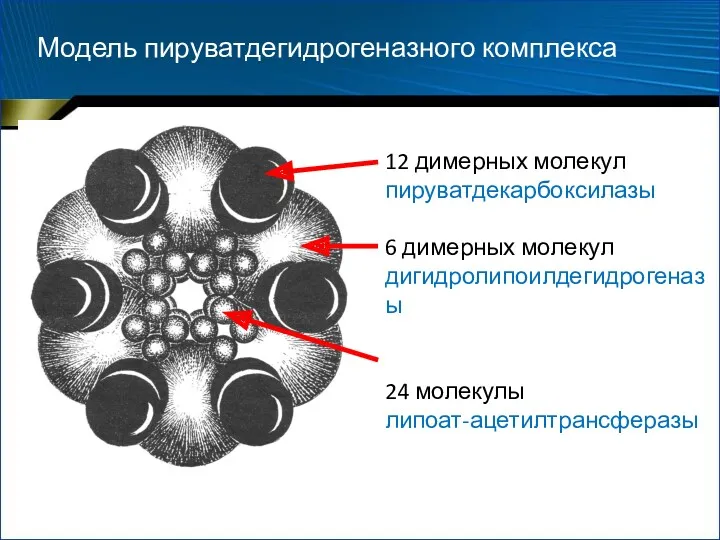
- 27. Модель пируватдегидрогеназного комплекса 12 димерных молекул пируватдекарбоксилазы 6 димерных молекул дигидролипоилдегидрогеназы 24 молекулы липоат-ацетилтрансферазы
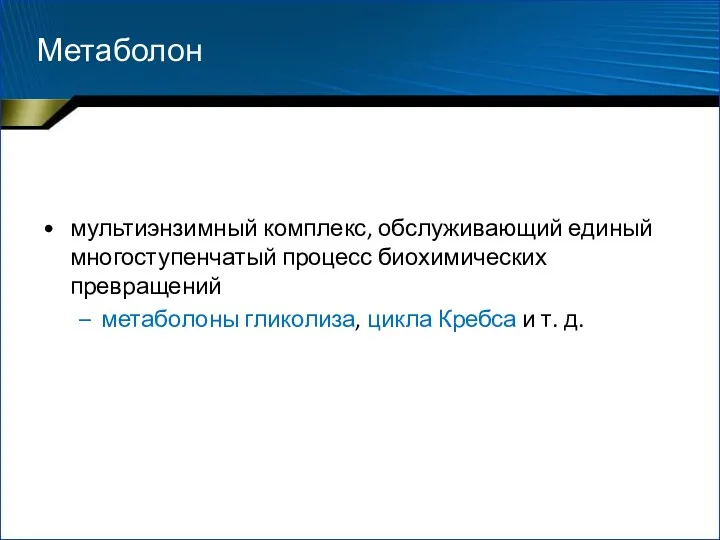
- 28. мультиэнзимный комплекс, обслуживающий единый многоступенчатый процесс биохимических превращений метаболоны гликолиза, цикла Кребса и т. д. Метаболон
- 29. состоят из одной полипептидной цепи, содержащей несколько доменов, каждый из которых характеризуется своей каталитической активностью Полифункциональные
- 30. Ферменты и ферментные комплексы
- 31. Физиологический смысл мультиэнзимных комплексов и полифункциональных ферментов слаженность во времени и пространстве действия ферментов или доменов
- 32. Кинетика ферментативных реакций (самостоятельно + лабораторные занятия)
- 33. Номенклатура и классификация ферментов
- 34. Номенклатура ферментов
- 35. 1. Тривиальная номенклатура пепсин – от греч. пепсис – пищеварение трипсин – от греч. трипсис –
- 36. 2. Рациональная номенклатура Название субстрата + окончание –аза (1883 г., П. Э. Дюкло) амилаза – от
- 37. 3. По названию простетической группы (кофермента) геминфермент (простетическая группа – гем) пиридоксальфермент (кофермент – пиридоксаль, витамин
- 38. 4. По характеру субстрата и типу катализируемой реакции Сукцинатдегидрогеназа НООС–СН2–СН2–СООН → НООС–СН=СН–СООН + 2Н янтарная кислота
- 39. 5. Международная (московская) номенклатура V Международный биохимический конгресс, 10–16 августа 1961 г., Москва Химическое название субстрата
- 40. пиридоксальфермент, ускоряющий реакцию переаминирования между L-ала и α-кетоглутаровой кислотой L-аланин: 2-оксоглутаратаминотрансфераза
- 41. Названия ферментов выигрывают в точности, НО в ряде случаев гораздо сложнее тривиальных уреаза – карбамид-амидогидролаза трегалаза
- 42. Классификация ферментов
- 43. Список ферментов
- 44. Международной комиссией был составлен детальный список ферментов, в котором на основании классификации каждому ферменту присвоен шифр,
- 45. 1 число Класс Оксидоредуктазы Трансферазы Гидролазы Лиазы Изомеразы Лигазы (синтетазы)
- 46. 2 число Подкласс у оксидоредуктаз показывает природу той группы в молекуле донора, которая подвергается окислению (1
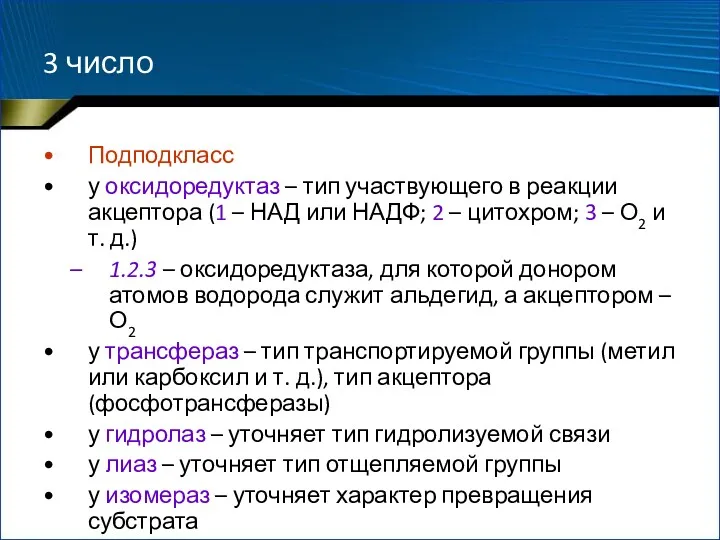
- 47. 3 число Подподкласс у оксидоредуктаз – тип участвующего в реакции акцептора (1 – НАД или НАДФ;
- 48. 4 число Порядковый номер Уреаза 3.5.1.5 3 – класс гидролаз 5 – подкласс С–N-гидролаз 1 –
- 49. Оксидоредуктазы
- 50. I. Оксидоредуктазы ускоряют ОВР Окисление – процесс отнятия атомов Н или электронов от субстрата, а восстановление
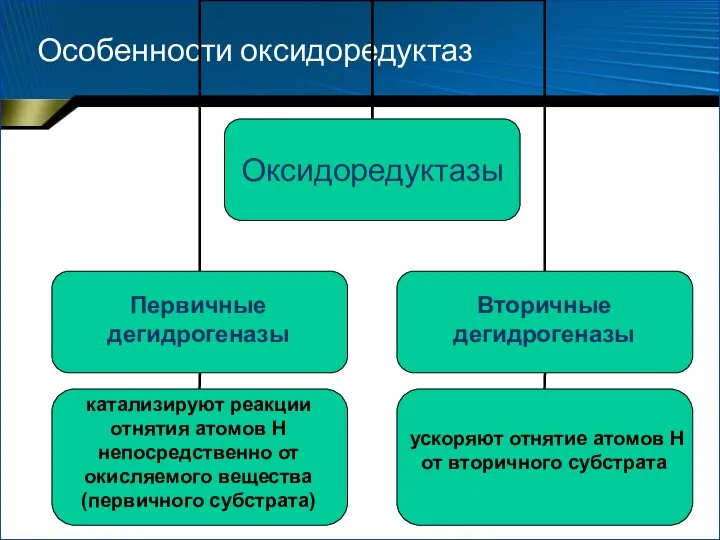
- 51. Особенности оксидоредуктаз Способность образовывать цепи, в которых осуществляется многоступенчатый перенос атомов Н или электронов от первичного
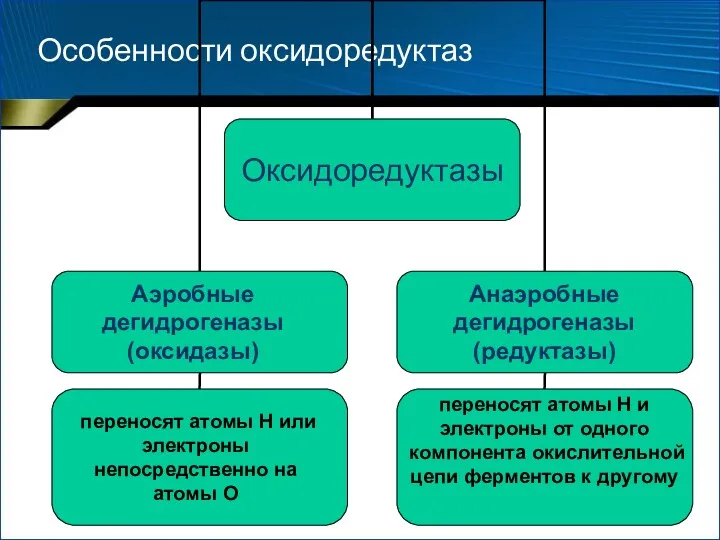
- 52. Особенности оксидоредуктаз Аэробные дегидрогеназы (оксидазы) переносят атомы Н или электроны непосредственно на атомы О Анаэробные дегидрогеназы
- 53. Особенности оксидоредуктаз Первичные дегидрогеназы катализируют реакции отнятия атомов Н непосредственно от окисляемого вещества (первичного субстрата) Вторичные
- 54. Особенности оксидоредуктаз Двухкомпонентные ферменты с ограниченным набором коферментов, но способные ускорять большое число самых разнообразных ОВР,
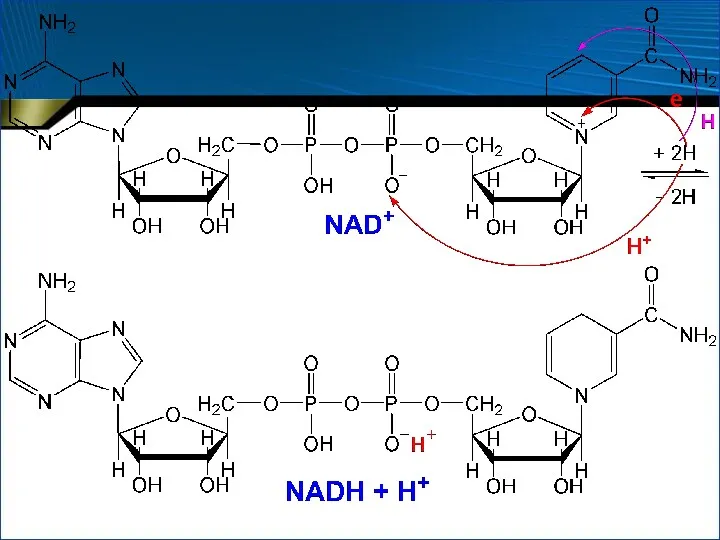
- 55. Особенности оксидоредуктаз Пиридинпротеины Аэробные дегидрогеназы Пример – алкогольдегидрогеназа Коферменты никотинамидадениндинуклеотид (NAD+, НАД+) никотинамидадениндинуклеотидфосфат (NADP+, НАДФ+)
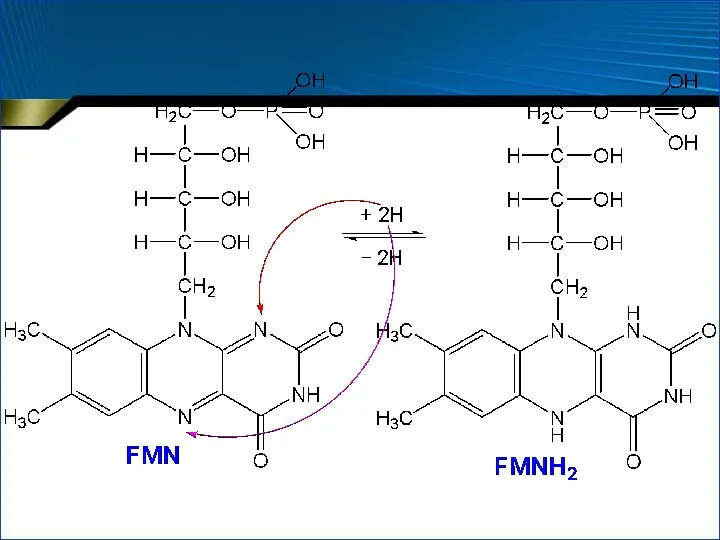
- 57. Особенности оксидоредуктаз Флавопротеины (ФП) Партнеры восстановленных форм пиридинпротеинов в окислительно-восстановительной цепи В большинстве случаев – вторичные
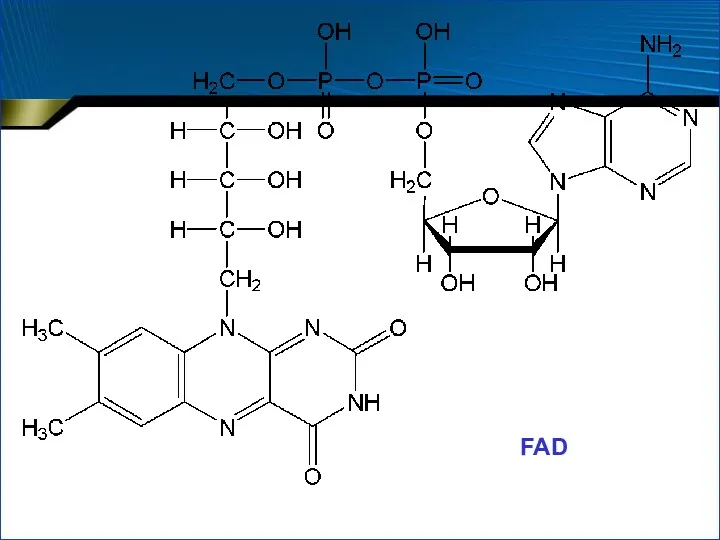
- 59. FAD
- 60. Особенности оксидоредуктаз Другие коферменты оксидоредуктаз хиноны (убихинон – витамин Q) железопорфирины (цитохромы)
- 61. Особенности оксидоредуктаз Ускоряют протекание реакций, связанных с высвобождением энергии (цитохромная система)
- 62. Трансферазы
- 63. II. Трансферазы ускоряют реакции переноса функциональных групп и молекулярных остатков от одного соединения к другому
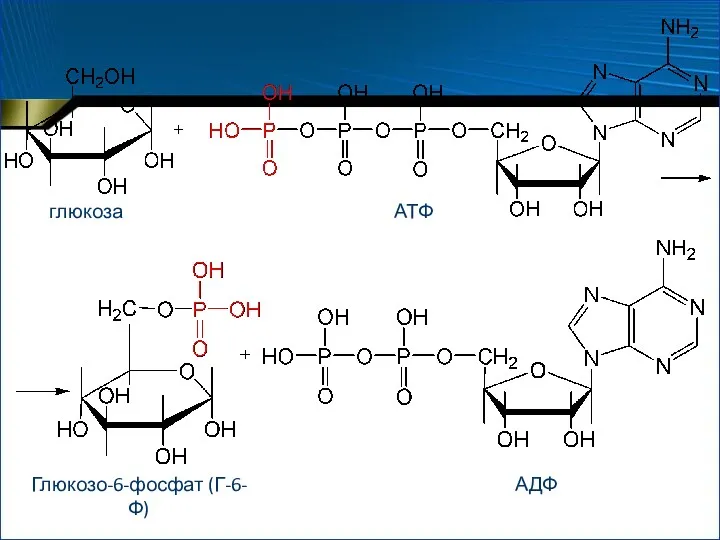
- 64. Подклассы Фосфотрансферазы (киназы) переносят фосфатные группы с участием АТФ Гексокиназа (АТФ: D-глюкоза-6-фосфотрансфераза)
- 65. глюкоза АТФ Глюкозо-6-фосфат (Г-6-Ф) АДФ
- 66. Подклассы Аминотрансферазы (трансаминазы) ускоряют реакции переаминирования аминокислот с кетокислотами Кофермент – пиридоксальфосфат
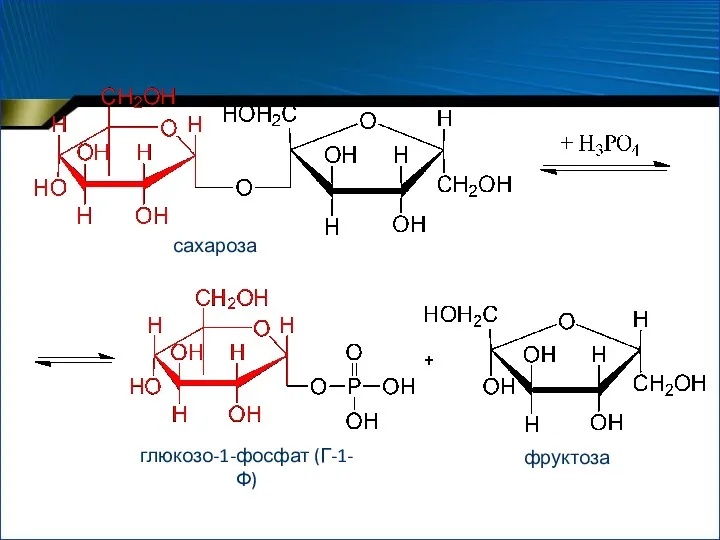
- 67. Подклассы Гликозилтрансферазы ускоряют реакции переноса остатков сахаров на различные акцепторы фосфорилазы катализируют реакции переноса гликозильных групп
- 68. сахароза глюкозо-1-фосфат (Г-1-Ф) фруктоза
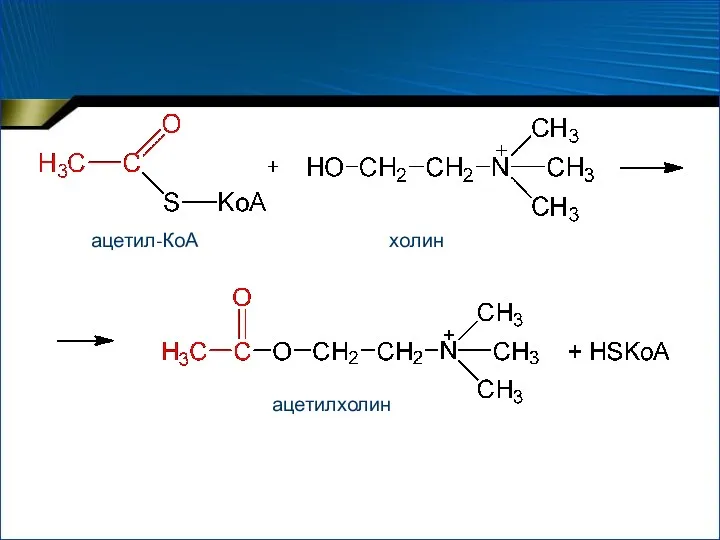
- 69. Подклассы Ацилтрансферазы ускоряют перенос ацильных групп на аминокислоты, амины, спирты и др. Кофермент – коэнзим А
- 70. ацетил-КоА холин ацетилхолин
- 71. Подклассы ферменты, ускоряющие перенос одноуглеродных фрагментов Метилтрансферазы Оксиметилтрансферазы Формилтрансферазы и др. нуклеотидных остатков Нуклеотидилтрансферазы
- 72. Гидролазы
- 73. III. Гидролазы ускоряют реакции гидролиза органических соединений Делятся на подклассы по характеру субстрата
- 74. Подклассы Эстеразы ускоряют гидролиз сложных эфиров Липаза ускоряет гидролиз α-сложноэфирных связей в молекулах триглицеридов (жиров) Фосфатазы
- 75. Подклассы Гликозидазы ускоряют гидролиз гликозидов Мальтаза Сахараза Амилаза
- 76. Подклассы Пептидазы (пептид-гидролазы) ускоряют гидролиз пептидных связей в белках и пептидах протеиназы (пептидил-пептидогидролазы) ускоряют гидролиз внутренних
- 77. Подклассы Амидазы ускоряют гидролиз амидов кислот уреаза (гидролиз мочевины до NH3 и СО2) аспарагиназа и глутаминаза
- 78. Лиазы
- 79. IV. Лиазы ускоряют реакции негидролитического распада органических соединений При этом замыкаются двойные связи и выделяются такие
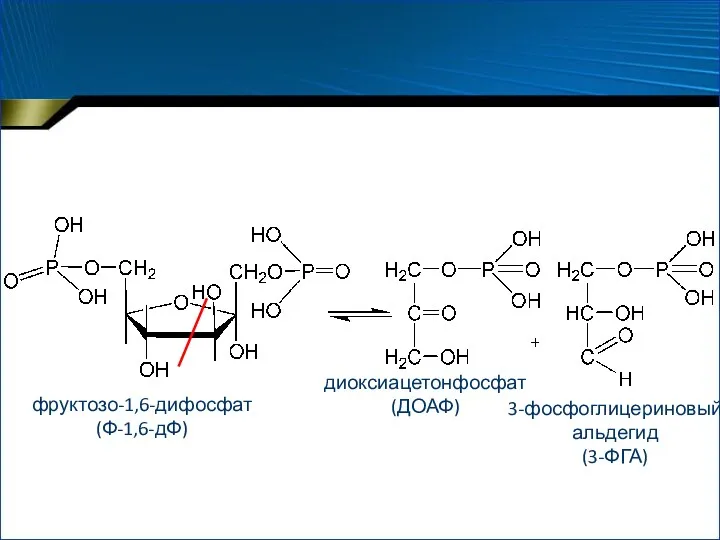
- 80. Подклассы С–С-лиазы декарбоксилазы кетокислот (кофермент – витамин В1) декарбокислазы аминокислот (кофермент – витамин В6) альдегид-лиазы альдолаза
- 81. фруктозо-1,6-дифосфат (Ф-1,6-дФ) диоксиацетонфосфат (ДОАФ) 3-фосфоглицериновый альдегид (3-ФГА)
- 82. Подклассы С–О-лиазы (гидратазы) ускоряют гидратацию и дегидратацию органических соединений Фумаратгидратаза НООС–СН(ОН)–СН2–СООН ⇄ НООС–СН=СН–СООН + Н2О Яблочная
- 83. Подклассы С–N-лиазы аспартат-аммиак-лиаза ускоряет прямое дезаминирование асп НООС–СН(NH2)–СН2–СООН ⇄ НООС–СН=СН–СООNH4 Аспарагиновая кислота (асп) Фумарат аммония
- 84. Изомеразы
- 85. V. Изомеразы ускоряют геометрические или структурные изменения в пределах одной молекулы
- 86. Подклассы Рацемазы и эпимеразы Мутаротаза α-D-глюкопираноза ⇄ β-D-глюкопираноза Цис-транс-изомеразы Ретинол-изомераза
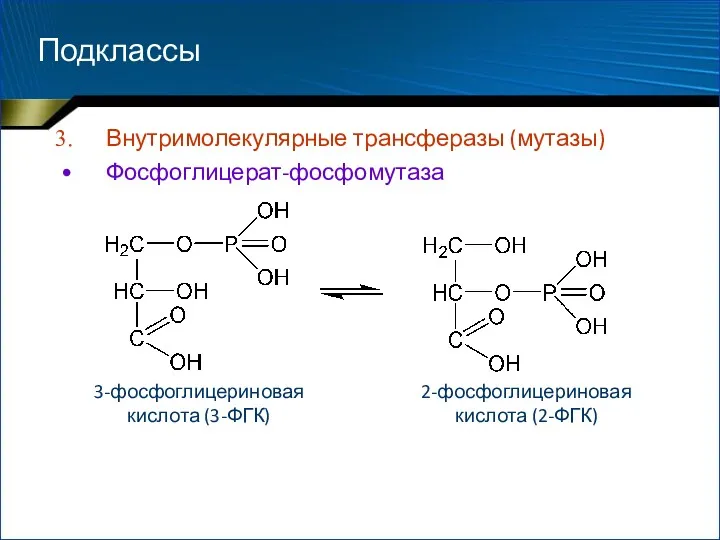
- 87. Подклассы Внутримолекулярные трансферазы (мутазы) Фосфоглицерат-фосфомутаза 3-фосфоглицериновая кислота (3-ФГК) 2-фосфоглицериновая кислота (2-ФГК)
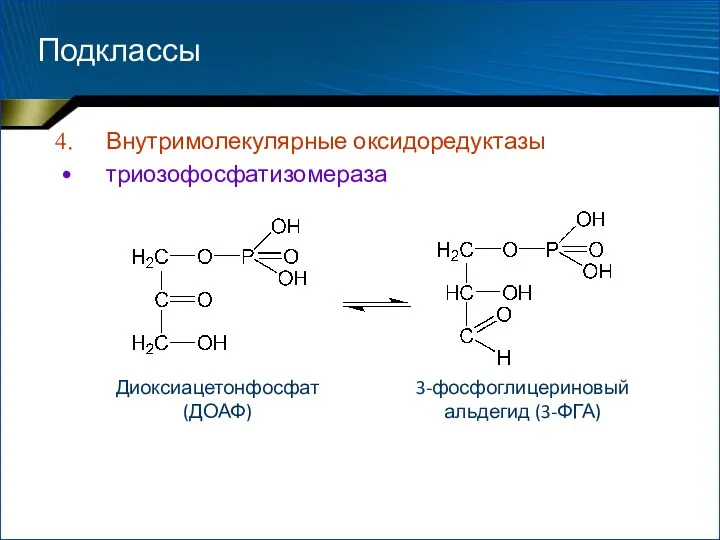
- 88. Подклассы Внутримолекулярные оксидоредуктазы триозофосфатизомераза Диоксиацетонфосфат (ДОАФ) 3-фосфоглицериновый альдегид (3-ФГА)
- 89. Лигазы
- 90. VI. Лигазы Ускоряют присоединение друг к другу двух молекул Процесс сопряжен с разрывом макроэргической связи АТФ;
- 92. Скачать презентацию



































































 Морфология и ультраструктура бактерий
Морфология и ультраструктура бактерий A review of studies on quantum biology
A review of studies on quantum biology Генная инженерия
Генная инженерия Знакомый и незнакомый картофель
Знакомый и незнакомый картофель Мышцы туловища
Мышцы туловища Метаболизм белков, пептидов, аминокислот. Лекция 19-21
Метаболизм белков, пептидов, аминокислот. Лекция 19-21 Мастер-класс Я есть то, что я ем
Мастер-класс Я есть то, что я ем Физиология микроорганизмов. Бактерии
Физиология микроорганизмов. Бактерии Естественный отбор и борьба за существование
Естественный отбор и борьба за существование Презентация Печень, строение и функции
Презентация Печень, строение и функции Журавлеподібні
Журавлеподібні Продукты питания, ядовитые для собак и кошек
Продукты питания, ядовитые для собак и кошек Respiration Module
Respiration Module Закономерности развития живой природы
Закономерности развития живой природы Онтогенез речи
Онтогенез речи Постройка и реальность (моделирование форм подводного мира)
Постройка и реальность (моделирование форм подводного мира) Конспект урока и презентация Внешнее строение листа
Конспект урока и презентация Внешнее строение листа Обмен липидов. (Часть 2)
Обмен липидов. (Часть 2) Мутационная изменчивость
Мутационная изменчивость Физиология дыхательной системы. Внешнее дыхание
Физиология дыхательной системы. Внешнее дыхание Як тварини визначають напрямок руху
Як тварини визначають напрямок руху Биотехнология. Достижения и перспективы развития
Биотехнология. Достижения и перспективы развития Деление царств на группы
Деление царств на группы История развития генетики. Основные генетические понятия
История развития генетики. Основные генетические понятия Синтез белков в клетке
Синтез белков в клетке Биохимия липидов. Классификация, биологические функции. Переваривание и всасывание. Обмен липопротеидов
Биохимия липидов. Классификация, биологические функции. Переваривание и всасывание. Обмен липопротеидов Наука генетика. Генетика пола и наследование, сцепленное с полом
Наука генетика. Генетика пола и наследование, сцепленное с полом Водоросли. Общая характеристика. Классификация
Водоросли. Общая характеристика. Классификация