Содержание
- 2. «Ферменты, есть так сказать, первый акт жизненной деятельности. Все химические процессы направляются в теле именно этими
- 3. ФЕРМЕНТЫ (от лат. fermentum — брожение, закваска) – это энзимы, специфические белки, увеличивающие скорость протекания химических
- 4. Термин «фермент» был предложен в XVII веке химиком ван Гельмонтом при обсуждении механизмов пищеварения. История изучения
- 5. В XIX в. Луи Пастер, изучая превращение углеводов в этиловый спирт под действием дрожжей, пришёл к
- 6. Юстас Либих и его сторонники, отстаивая химическую природу брожения, считали, что оно является следствием образования в
- 7. История изучения Дискуссия Либиха и Пастера о природе брожения была разрешена в 1897 Эдуардом Бухнером, который,
- 8. Впервые ферменты выделили в кристалитической форме в 1926 году Джеймс Бетчеллер Самнер и Джон Говард Нортроп.
- 9. В 1961 году предложена комиссией международного биохимического союза систематическая номенклатура ферментов. Ферменты подразделили на 6 групп
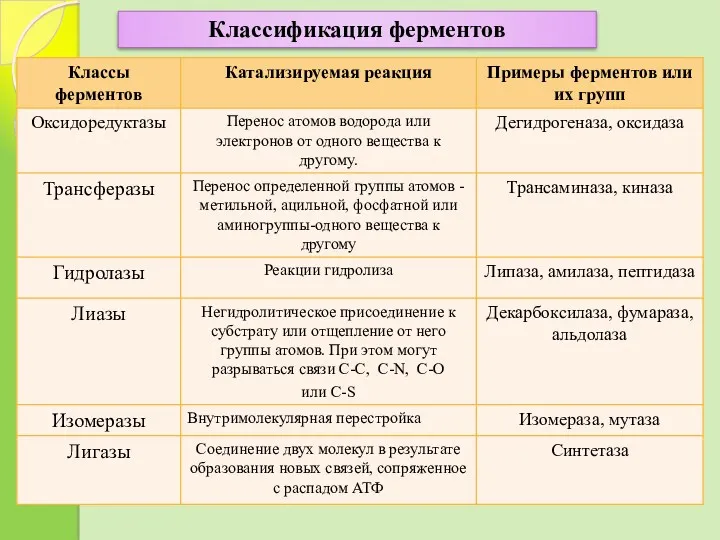
- 10. Классификация ферментов
- 11. Обычно ферменты выделяют из тканей животных, растений, клеток и культуральных жидкостей микроорганизмов, биологических жидкостей (кровь, лимфа
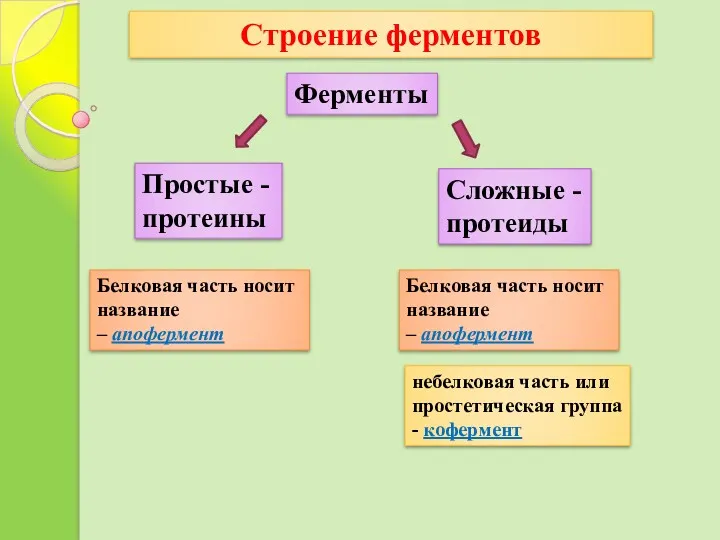
- 12. Строение ферментов Ферменты Простые - протеины Сложные - протеиды небелковая часть или простетическая группа - кофермент
- 13. Строение ферментов Коферменты можно рассматривать как составную часть молекулы фермента. Это органические вещества, среди которых различают:
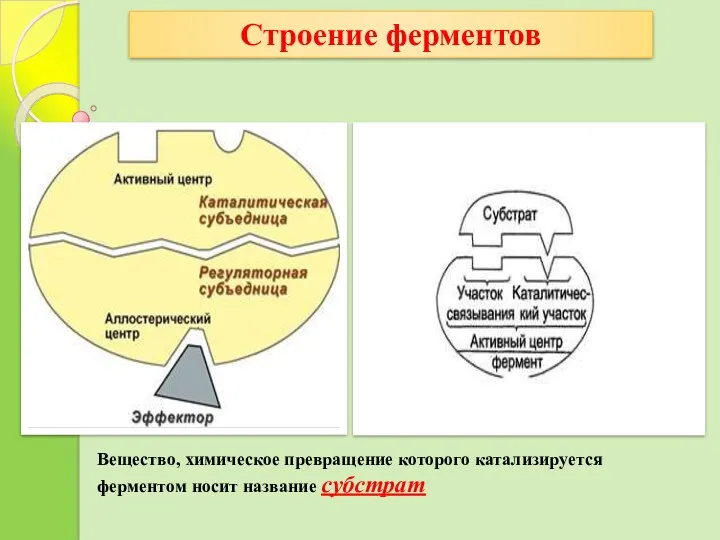
- 14. Ферменты имеют 2 центра: Активный центр и Аллостерический центр. Строение ферментов Активный центр (АЦФ) – это
- 15. Аллостерический центр - комбинация аминокислотных остатков на поверхности фермента, с которым связываются низкомолекулярные соединения (эффекторы), молекулы
- 16. Строение ферментов Вещество, химическое превращение которого катализируется ферментом носит название субстрат
- 17. Субстрат- вещество на которое действует фермент Фермент и субстрат должны подходить друг к другу «как ключ
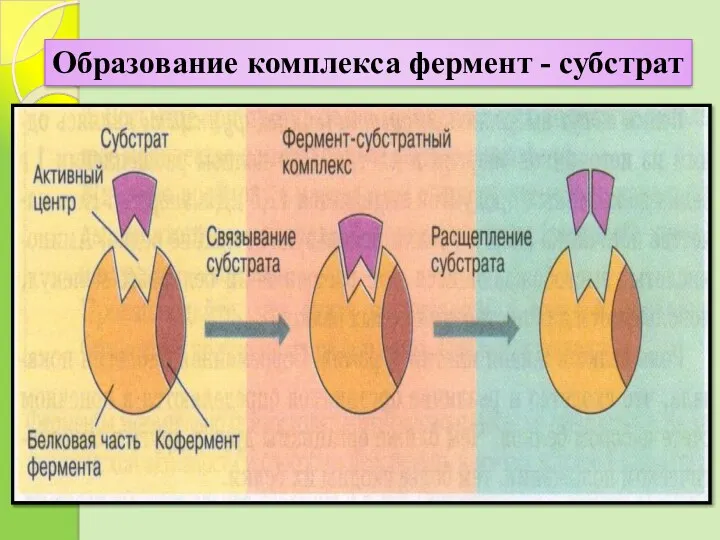
- 18. Образование комплекса фермент - субстрат
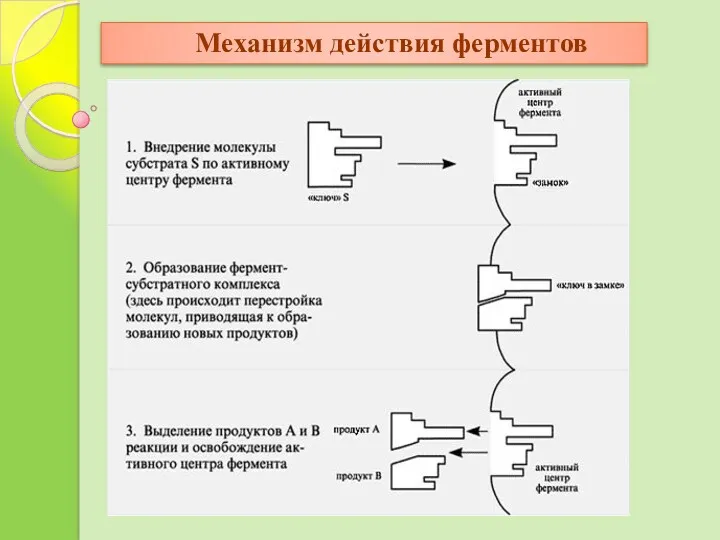
- 19. Акт катализа складывается из трех последовательных этапов. 1. Образование фермент-субстратного комплекса при взаимодействии через активный центр.
- 20. Механизм действия ферментов
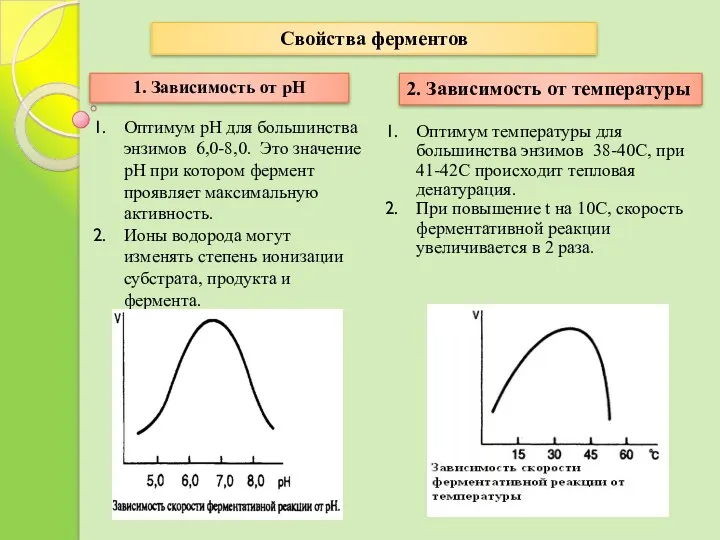
- 21. Ферменты обладают свойствами белков, но имеют и особенности: 1. Зависимость от РН 2. Зависимость от температуры
- 22. Оптимум рН для большинства энзимов 6,0-8,0. Это значение рН при котором фермент проявляет максимальную активность. Ионы
- 24. Специфичность действия определяется структурой активного центра фермента и заключается в том, что каждый фермент катализирует превращение
- 25. Свойства ферментов Различают несколько видов специфичности. Стереохимическая субстратная специфичность - фермент катализирует превращение только одного стереоизомера
- 26. Свойства ферментов 4. Способностью к регуляции Влияние на активность ферментов активаторов и ингибиторов. К числу факторов,
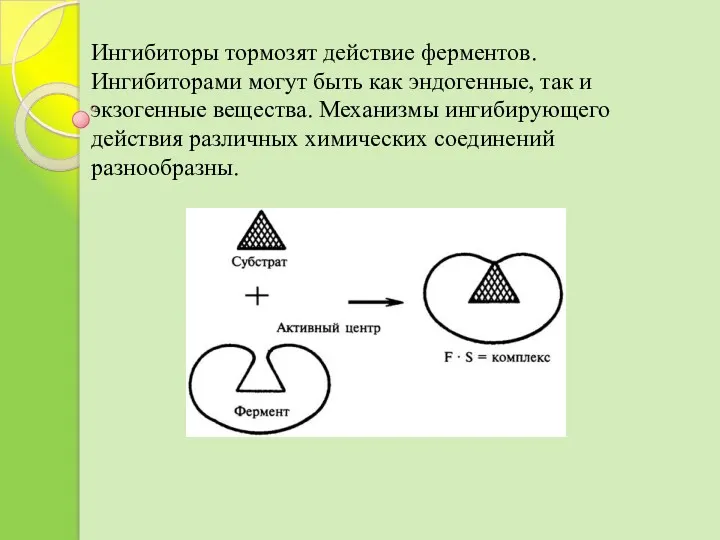
- 27. Ингибиторы тормозят действие ферментов. Ингибиторами могут быть как эндогенные, так и экзогенные вещества. Механизмы ингибирующего действия
- 28. Ферменты, участвующие в синтезе белков, нуклеиновых кислот и ферменты энергетического обмена присутствуют во всех клетках организма.
- 29. Ферменты получили широкое применение в легкой, пищевой и химической промышленности, а также в медицинской практике. В
- 30. Тесты «Ферменты» 1. Ферменты являются: А) регуляторами; Б) катализаторами; В) активаторами субстратов; Г) переносчиками веществ через
- 31. 4.Простетическая группа – это: А) белковая часть сложного фермента; Б) стабилизатор структуры фермента; В) активатор сложного
- 32. 7. Как называется центр фермента, в котором происходит присоединение субстрата? А) Каталитический; Б) аллостерический; В) субстратный;
- 34. Скачать презентацию
























 Задачи и достижения биотехнологии
Задачи и достижения биотехнологии Капуста
Капуста Жизнь пресного водоёма
Жизнь пресного водоёма Нервная система. Спинной мозг
Нервная система. Спинной мозг Юрский период (195 -137 млн.)
Юрский период (195 -137 млн.) Дощовий черв'як
Дощовий черв'як Биогеоценоз. Биогеоценотический уровень организации жизни. Разнообразие видов
Биогеоценоз. Биогеоценотический уровень организации жизни. Разнообразие видов Биологическое действие радиоактивных изотопов. Радиация и жизнь
Биологическое действие радиоактивных изотопов. Радиация и жизнь Тип Членистоногие
Тип Членистоногие Природные сообщества. Биогеоценоз и экосистемы
Природные сообщества. Биогеоценоз и экосистемы Функциональная анатомия мышечной системы
Функциональная анатомия мышечной системы Презентация по биологии 9 класс.
Презентация по биологии 9 класс. Методологическая роль лабораторных и практических работ по биологии в рамках ФГОС.
Методологическая роль лабораторных и практических работ по биологии в рамках ФГОС. Историческое развитие растительного мира на Земле
Историческое развитие растительного мира на Земле Сад и его обитатели
Сад и его обитатели Гормональная регуляция обмена веществ
Гормональная регуляция обмена веществ Мозговой ствол
Мозговой ствол Строение цветка. Соцветие. Значение оплодотворения
Строение цветка. Соцветие. Значение оплодотворения Бактериофаги. Вирусы бактерий
Бактериофаги. Вирусы бактерий Лесные доктора
Лесные доктора Разработка полимерсодержащих композиционных сорбентов и их применение в молекулярной биотехнологии
Разработка полимерсодержащих композиционных сорбентов и их применение в молекулярной биотехнологии Древнейшие люди
Древнейшие люди Буферные растворы
Буферные растворы Проект Белоствольная красавица
Проект Белоствольная красавица Витамины
Витамины Наследственная информация и ее реализация в клетке
Наследственная информация и ее реализация в клетке Белки
Белки Лимбическая система
Лимбическая система