Содержание
- 2. Поджелудочная железа (pancreas) – орган пищеварительной и эндокринной систем. 1. Экзокринная (внешнесекреторная) функция. В клетках ацинусов
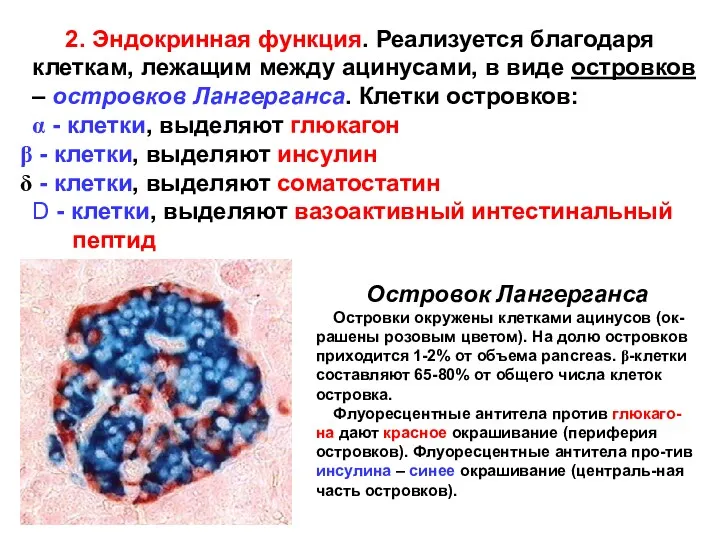
- 3. 2. Эндокринная функция. Реализуется благодаря клеткам, лежащим между ацинусами, в виде островков – островков Лангерганса. Клетки
- 4. ИНСУЛИН 1889 г. - Минковски и Меринг: устновили, что отсут-ствие некоего продукта в соке pancreas («диабетичес-кий
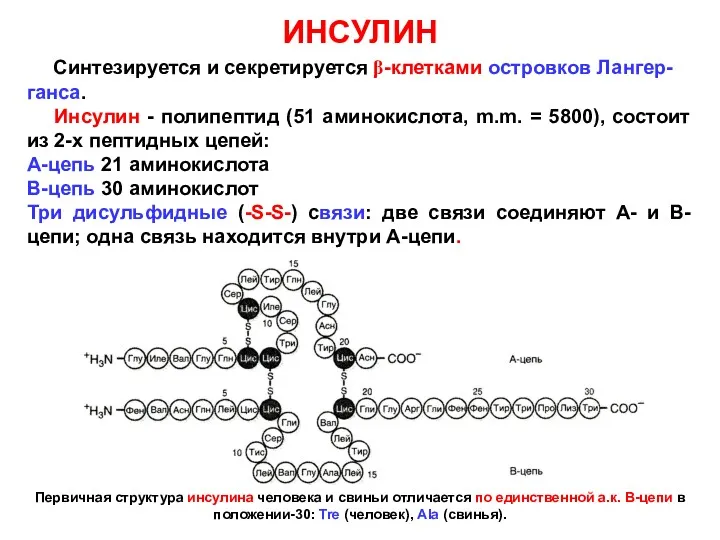
- 5. ИНСУЛИН Синтезируется и секретируется β-клетками островков Лангер-ганса. Инсулин - полипептид (51 аминокислота, m.m. = 5800), состоит
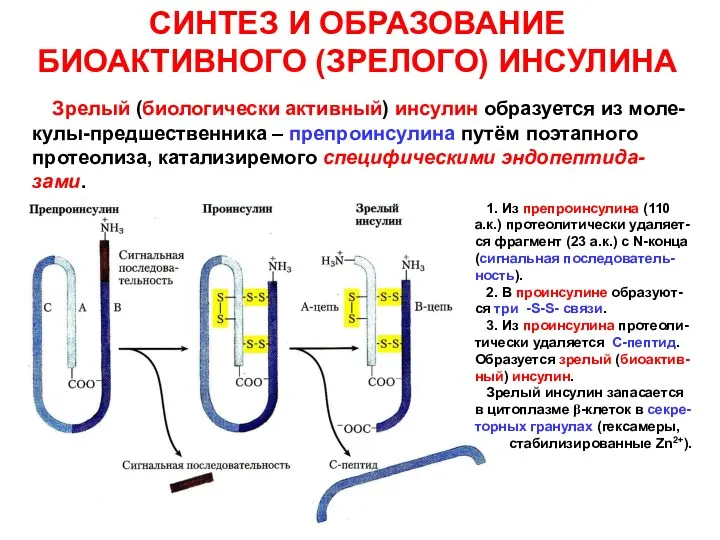
- 6. СИНТЕЗ И ОБРАЗОВАНИЕ БИОАКТИВНОГО (ЗРЕЛОГО) ИНСУЛИНА Зрелый (биологически активный) инсулин образуется из моле-кулы-предшественника – препроинсулина путём
- 7. КОМПАРТМЕНТЫ СОЗРЕВАНИЯ ИНСУЛИНА Мембрана шероховатого ЭПР: Сигнальная последовательность связывается с мембраной ЭПР, что позволяет растущей на
- 8. СИГНАЛИЗАЦИЯ К ОСВОБОЖДЕНИЮ ИНСУЛИНА В КРОВЬ Ведущий метаболический сигнал для выделения инсулина – повышение [глюкозы] в
- 9. Помимо глюкозы, синтез и секрецию инсулина сти-мулируют: аргинин лизин гормоны ЖКТ: желудочный ингибиторный поли- пептид (инсулин),
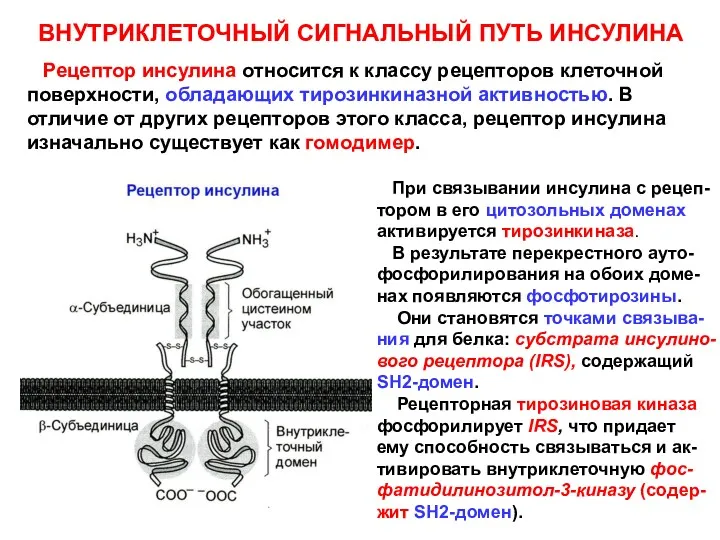
- 10. ВНУТРИКЛЕТОЧНЫЙ СИГНАЛЬНЫЙ ПУТЬ ИНСУЛИНА Рецептор инсулина относится к классу рецепторов клеточной поверхности, обладающих тирозинкиназной активностью. В
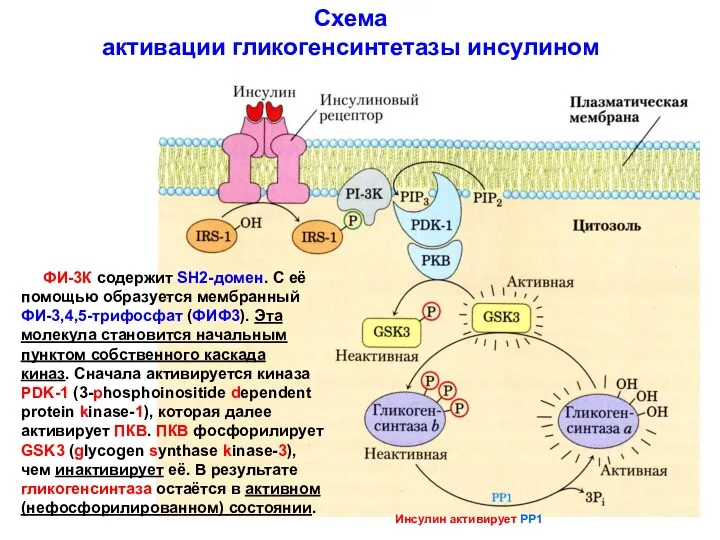
- 11. Схема активации гликогенсинтетазы инсулином ФИ-3К содержит SH2-домен. С её помощью образуется мембранный ФИ-3,4,5-трифосфат (ФИФ3). Эта молекула
- 12. ПЕЧЕНЬ: Активация гликолиза (окисление глюкозы) Активация синтеза гликогена: посредством активации ПКВ (фосфорилирует и инактивирует киназу ГС,
- 13. Активация синтеза липидов: усиление окисления глюкозы даёт избыток цитрата в ЦТК. Цитрат переносится в цитозоль, где
- 14. МЫШЦЫ: Транспорт глюкозы в гепатоциты обеспечивает ГЛЮТ 2. Мембра- ны адипоцитов и сарколемма миоцитов исходно непроницаемы
- 15. ЖИРОВАЯ ТКАНЬ: Активация синтеза липидов: происходит согласно меха- низмам, аналогичным для печени. Активация гликолиза: служит источником
- 16. ГЛЮКАГОН Синтезируется и секретируется α-клетками островков Лангерганса. Глюкагон - полипептид (29 аминокислот, m.m. = 3500), состоит
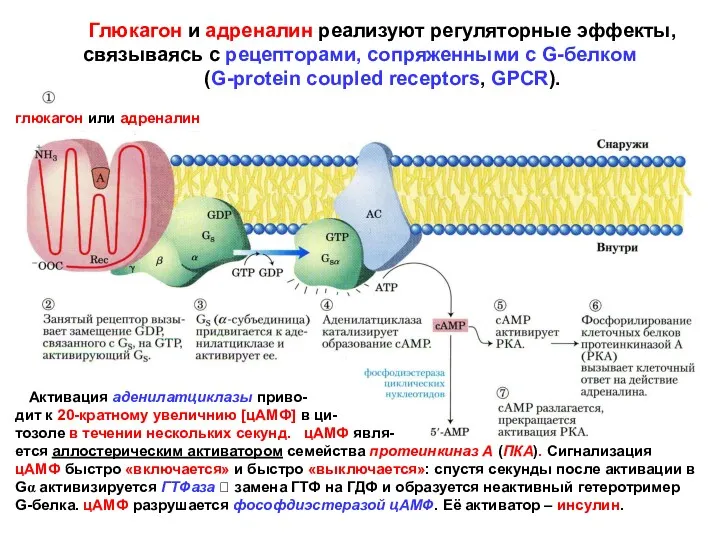
- 17. Глюкагон и адреналин реализуют регуляторные эффекты, связываясь с рецепторами, сопряженными с G-белком (G-protein coupled receptors, GPCR).
- 18. МЕТАБОЛИЧЕСКИЕ ЭФФЕКТЫ ГЛЮКАГОНА ПЕЧЕНЬ: Активация гликогенолиза (расщепления гликогена): а). цАМФ активирует ПКА, которая активирует киназу гликоген-
- 19. Подавление синтеза липидов: Активированная ПКА фосфорилирует ацетил-КоА-карбоксила-зу, переводя её в неактивную форму ? снижение синтеза малонил-КоА
- 20. МЫШЦЫ: В ответ на снижение [глюкозы] в крови усиливается секреция адреналина, который действует на мышцы как
- 21. ЖИРОВАЯ ТКАНЬ: Как и в мышцах, адреналин действует на адипоциты в качестве синер- гиста глюкагона. На
- 23. Скачать презентацию












![МЫШЦЫ: В ответ на снижение [глюкозы] в крови усиливается секреция](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/261078/slide-19.jpg)

 Устройство речевого аппарата
Устройство речевого аппарата Власне сполучна тканина
Власне сполучна тканина Внешнее строение листа. 6 класс
Внешнее строение листа. 6 класс Морфология прокариот
Морфология прокариот Різноманітність тварин у природі. Звірі. Урок №46. Я досліджую світ
Різноманітність тварин у природі. Звірі. Урок №46. Я досліджую світ Направления и формы эволюции групп. Лекция 2
Направления и формы эволюции групп. Лекция 2 Пори року. Дні тижня. Доба. Урок №97. Я досліджую світ
Пори року. Дні тижня. Доба. Урок №97. Я досліджую світ Микробы в жизни растений
Микробы в жизни растений Algae. Division: Chlorophyta and Charоphyta
Algae. Division: Chlorophyta and Charоphyta Лимфа жүйесінің құрылысы
Лимфа жүйесінің құрылысы Состав и свойства помидоров
Состав и свойства помидоров Половое размножение
Половое размножение Морфология нервной системы. Часть 1
Морфология нервной системы. Часть 1 Полезные и лекарственные растения Зауралья
Полезные и лекарственные растения Зауралья Гормональная регуляция метаболических процессов
Гормональная регуляция метаболических процессов Плауны. Хвощи. Папоротники
Плауны. Хвощи. Папоротники Генотоксиканты. Классификации мутагенов. Генотоксические поражения и болезни
Генотоксиканты. Классификации мутагенов. Генотоксические поражения и болезни Все о чае
Все о чае КЛЕТКА
КЛЕТКА Bryophyta – моховидные или мхи
Bryophyta – моховидные или мхи Програмированный тест по теме Биогеоценоз
Програмированный тест по теме Биогеоценоз Продуктивность кукурузы в зависимости от приемов выращивания в центральной зоне Краснодарского края
Продуктивность кукурузы в зависимости от приемов выращивания в центральной зоне Краснодарского края Волчеягодник обыкновенный
Волчеягодник обыкновенный Основные методы селекции
Основные методы селекции Жорғалаушылардың сыртқы, ішкі құрылысы мен тіршілік
Жорғалаушылардың сыртқы, ішкі құрылысы мен тіршілік Cladocera
Cladocera Пищеварение в ротовой полости и желудке
Пищеварение в ротовой полости и желудке Ткани внутренней среды организма. Костная ткань
Ткани внутренней среды организма. Костная ткань