Содержание
- 2. ЖОСПАР: Кіріспе Негізгі бөлім Химиялық реакциялардың жылдамдығы Химиялық реакциялар жылдамдығының температураға тәуелділігі Химиялық реакциялар жылдамдығының катализаторлардың
- 3. ХИМИЯЛЫҚ КИНЕТИКА Химиялық кинетика – химиялық реакцияның жылдамдығын, реакцияның жүру механизмін және оған әртүрлі факторлардың әсерін
- 4. ХИМИЯЛЫҚ РЕАКЦИЯЛАРДЫҢ ЖЫЛДАМДЫҒЫ белгілі бір уақытта әрекеттесетін заттар мөлшерінің өзгеруін айтады Uорташа = ±
- 5. Химиялық реакция жылдамдығына әсер ететін факторлар: температура қысым катализатор реакцияға қатысқан заттардың табиғаты еріткіштің табиғаты реагенттердің
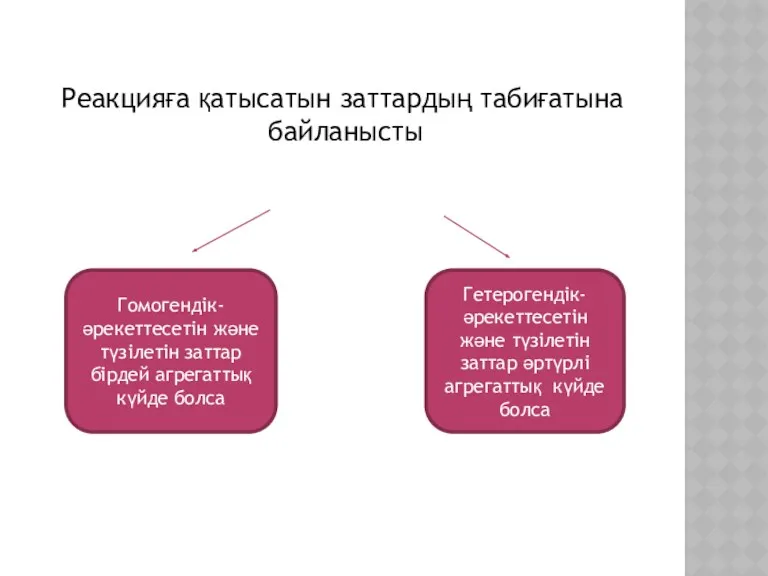
- 6. Реакцияға қатысатын заттардың табиғатына байланысты Гомогендік- әрекеттесетін және түзілетін заттар бірдей агрегаттық күйде болса Гетерогендік- әрекеттесетін
- 7. Әрекеттесуші заттардың концентрациясы химиялық реакция жылдамдығына қалай әсер етеді? Химиялық реакциялар тез жүруі үшін түйісетін молекулалар
- 8. ХИМИЯЛЫҚ РЕАКЦИЯЛАР ЖЫЛДАМДЫҒЫНЫҢ ТЕМПЕРАТУРАҒА ТӘУЕЛДІЛІГІ Температура жоғарлаған сайын химиялық реакцияның жылдамдығы артады.Гомогендік реакциялар жылдамдығының температураның жоғарлауына
- 9. Химиялық реакцияның жылдамдығының температураға тәуелділігін график түрінде де көрсетуге болады: U t g
- 10. Химиялық реакцияның жылдамдығының температурасы өсуіне сәйкес жоғарлауын 1889 жылы ашылған С.Аррениус теориясы дәлірек көрсетеді: К= А•
- 11. С.Аррениус теориясы бойынша молекулалардың әрекеттесуі, олардың соқтығысқан кездегі энергия қорына байланысты, яғни реакцияға тек бойында артық
- 12. ХИМИЯЛЫҚ РЕАКЦИЯЛАР ЖЫЛДАМДЫҒЫНЫҢ КАТАЛИЗАТОРДЫҢ ҚАТЫСУЫНА ТӘУЕЛДІЛІГІ Катализатор деп, реакция жылдамдығын өзгертетін және реакция нәтижесінде өзгеріссіз қалатын
- 13. ҚЫШҚЫЛДЫ – НЕГІЗДІК КАТАЛИЗ Қышқылды – негіздік катализ- қышқылдың реакцияға қатысатын заттың біріне өзінің протонын беруі
- 14. Бұл мысал қышқылдың катализаторлық үлесін көрсетеді: 1) Күрделі эфирге қышқыл өз протонын береді де өзі ионға
- 15. ХИМИЯЛЫҚ РЕАКЦИЯЛАРДЫҢ РЕТІ Реакциялардың реттілігі деп жалпы түрде экспериментальды жолмен табылған кинетикалық теңдеулердегі реагент концентрациясының дәрежелік
- 16. КҮРДЕЛІ РЕАКЦИЯЛАР Күрделі реакциялар деп – жалпы кинетикалық теңдеу бойынша жылдамдық константасы болатын реакцияларды айтады. Күрделі
- 17. а) Қайтымды реакция- тура және кері бағытта жүреді, яғни реакция нәтижесінде түзілген жаңа заттар қайтадан әрекеттесіп,
- 18. в) Қатар жүретін реакция- бір реакция екінші реакциямен қабаттасып жүреді. Г) Тізбекті реакция - бос күйдегі
- 19. ҚОРЫТЫНДЫ Химиялық кинетиканың ғылыми және практикалық маңызы зор. Қазіргі кездегі химия мен химиялық технологияның басты бағыттарының
- 20. Т.С. Сейтембетов « ХИМИЯ» Б.А. Бірімжанов, Н.Н. Нұрахметов «ЖАЛПЫ ХИМИЯ» А.Ж. Сейтембетова «БИОЛОГИЯЛЫҚ ХИМИЯ» www.google.kz ,
- 22. Скачать презентацию

















 Теоретическая, функциональная и возрастная анатомия костной системы
Теоретическая, функциональная и возрастная анатомия костной системы Общие свойства живого
Общие свойства живого Водоросли. 6 класс
Водоросли. 6 класс Конечный мозг (thelencephalon, cerebrum)
Конечный мозг (thelencephalon, cerebrum) Тайская кошка
Тайская кошка Красная книга
Красная книга Введение в биомеханику. Общая, дифференциальная и частная биомеханика
Введение в биомеханику. Общая, дифференциальная и частная биомеханика Ноосфера
Ноосфера Сон и его значение
Сон и его значение Микрофлора организма человека. Дисбактериоз. Экология микроорганизмов
Микрофлора организма человека. Дисбактериоз. Экология микроорганизмов Основы селекции организмов
Основы селекции организмов Зимующие птицы
Зимующие птицы Биологические ресурсы
Биологические ресурсы Презентация по биологии на тему Абиотические факторы среды. Влажность для 11 класса
Презентация по биологии на тему Абиотические факторы среды. Влажность для 11 класса Авторская дидактическая игра Угадай, кто спрятался?
Авторская дидактическая игра Угадай, кто спрятался? Биологические ритмы
Биологические ритмы Закон гомологических рядов
Закон гомологических рядов Семейство кошачьих
Семейство кошачьих Размножение - свойство живых организмов
Размножение - свойство живых организмов Введение в биоинформатику. Биологические базы данных. Лекция 1
Введение в биоинформатику. Биологические базы данных. Лекция 1 Организация генома. Прокариот и эукариот
Организация генома. Прокариот и эукариот Многолетние растения: флоксы, пионы, розы
Многолетние растения: флоксы, пионы, розы Готовимся к ЕГЭ по биологии
Готовимся к ЕГЭ по биологии Презентация к выступлению на научной конференции Совершенствование естественнонаучного школьного образования
Презентация к выступлению на научной конференции Совершенствование естественнонаучного школьного образования Пептиды. Белки. (Лекция 16)
Пептиды. Белки. (Лекция 16) Классификация царства грибы. Низшие и высшие грибы
Классификация царства грибы. Низшие и высшие грибы Редкие животные нашего округа
Редкие животные нашего округа Интегративная деятельность организма. Рефлексы
Интегративная деятельность организма. Рефлексы