Слайд 2

Ферменты или энзимы (Е) – биокатализаторы, от латинского слова «fermentum» -
закваска; от греческого «en zyme» – в дрожжах
Слайд 3

В 1783 г. итальянский ученый Спаланцани, изучая переваривание мяса у хищных
птиц, показал, что в организме есть катализаторы, расщепляющие мясо. Сделал вывод, что процессы в живой природе происходят при помощи специфических веществ.
Слайд 4

В 1814 г. русский ученый, К. Кирхгоф впервые установил, что крахмал
превращается в сахар под действием некоторых веществ, находящихся в вытяжке проросших зерен ячменя.
Слайд 5

В 1833 г. французские химики А. Пайен и Ж. Пирсо выделили
вещество, расщепляющее крахмал, которое они назвали диастаза (фермент амилаза)
Слайд 6

Луи Пастер высказал предположение, что процессы брожения могут вызывать микроорганизмы
и,
следовательно, связаны лишь с их жизнедеятельностью.
Слайд 7

Ю. Либих и К. Бернар отстаивали химическую природу брожения, считая, что
брожение вызывают особые вещества, подобные диастазе (амилазе).
Слайд 8

В 1837 г. шведский химик Й. Берцелиус показал, что ферменты
– это катализаторы, поставляемые живыми клетками. Именно тогда появились термины «фермент» и «энзим»
Слайд 9

В 1897 г. немецкие ученые Ганс и Эдвард Бухнеры показали,
что дрожжевой бесклеточный сок способен Э. Бухнер сбраживать сахар с образованием спирта и СО2
Слайд 10

После этого стало ясно, что в нем содержится смесь ферментов («зимаза»),
которые функционируют как внутри, так и вне клеток
Слайд 11

В 1926 г. американский биохимик Д. Самнер выделил из бобов
канавалии фермент уреазу, катализирующий реакцию расщепления мочевины до NH3 и CO2
Слайд 12

В 1930 г., норвежец
Д. Нортроп
выделил фермент
пепсин,
а затем трипсин
и химотрипсин
Слайд 13

С этого периода стало общепринятым утверждение, что все ферменты являются белками
Слайд 14

Большинство ферментов белки
Но есть ферменты небелковой природы.
Н-р, рибозимы, состоящие из
РНК.
Есть ферменты, которые в первую очередь выполняют другие функции. Н-р, абзимы, являющиеся антителами.
Слайд 15

В 1961 г. в Москве на 5-ом биохимическом конгрессе Международная комиссия
по ферментам предложила рекомендации по номенклатуре и классификации ферментов
Слайд 16

Номенклатура ферментов
Каждый фермент имеет два названия: 1 – рабочее (короткое), 2
– систематическое (более полное), применяемое для однозначной идентификации ферментов
Слайд 17

1 тип названия находится в зависимости от субстрата, на который действует
фермент с добавлением суффикса «аза»
Например, сахараза расщепляет сахарозу, лактаза – лактозу, мальтаза – мальтозу и т.д.
Слайд 18

Некоторые ферменты имеют специфическое название: например, пепсин, трипсин и т.д.
Слайд 19

2 тип включает в себя название субстрата + название реакции, катализируемой
данным ферментом
Например, лактатдегидрогеназа
Слайд 20

Классификация ферментов
Все ферменты разделены на 6 классов, каждый из которых имеет
строго определенный номер. Классы делятся на подклассы, а те на подподклассы
Слайд 21

Для каждого фермента существует специальный шифр, состоящий из 4-х цифр: 1
– номер класса, 2 – номер подкласса, 3 – номер подподкласса, 4 – порядковый номер фермента
Слайд 22
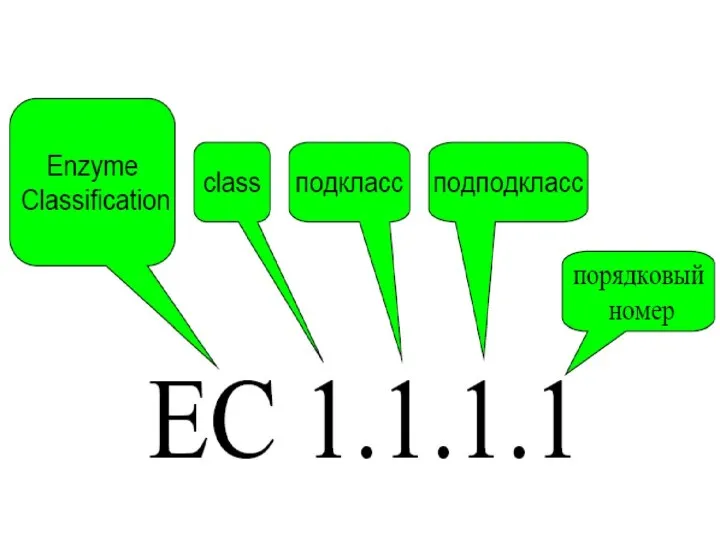
Слайд 23
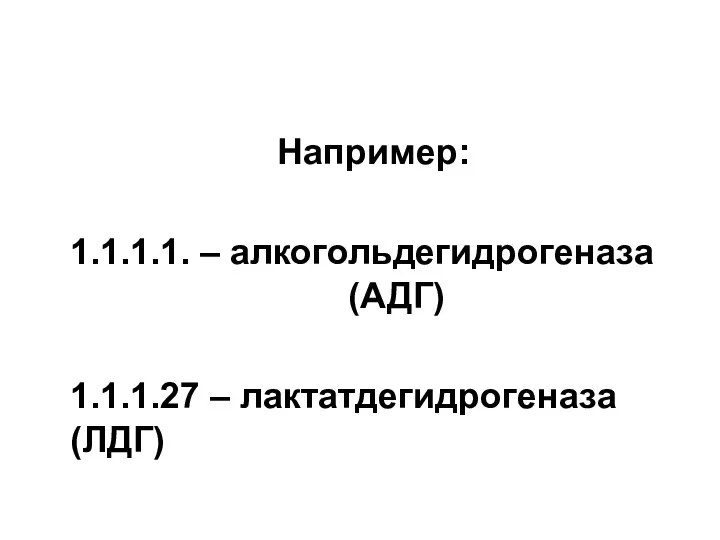
Например:
1.1.1.1. – алкогольдегидрогеназа (АДГ)
1.1.1.27 – лактатдегидрогеназа (ЛДГ)
Слайд 24

Классы ферментов:
I. Оксидоредуктазы
II. Трансферазы
III. Гидролазы
IV. Лиазы
V. Изомеразы
VI. Лигазы (синтетазы)
Слайд 25

I. Оксидоредуктазы
Катализируют окислительно-восстановительные реакции с участием двух субстратов (перенос электронов или
атомов водорода с одного субстрата на другой)
Слайд 26

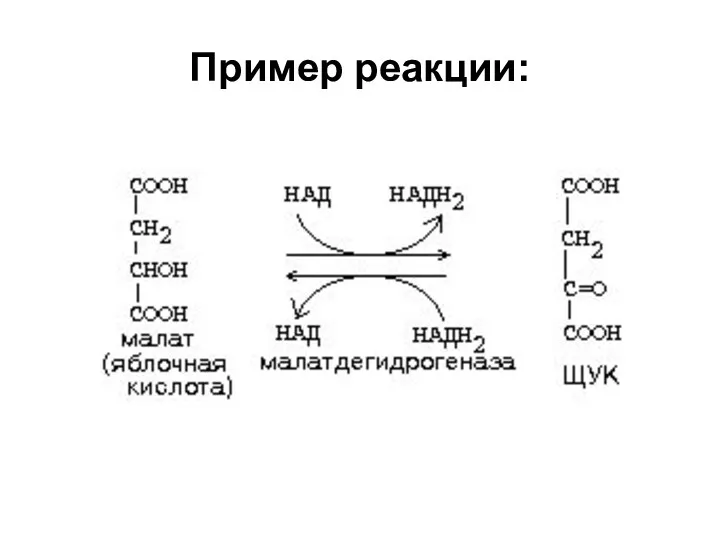
В классе 17 подклассов. Например:
1. Дегидрогеназы Сюда входят ферменты, катализирующие реакции
дегидрирования (отщепления водорода). В качестве акцепторов водорода используются коферменты: НАД+, НАДФ+, ФАД, ФМН
Слайд 27
Слайд 28

2. Оксидазы Акцептором ē служит молекулярный кислород.
Пример реакции:
О2 + 4 Н+
+ 4 е → 2 Н2О цитохромоксидаза
Слайд 29

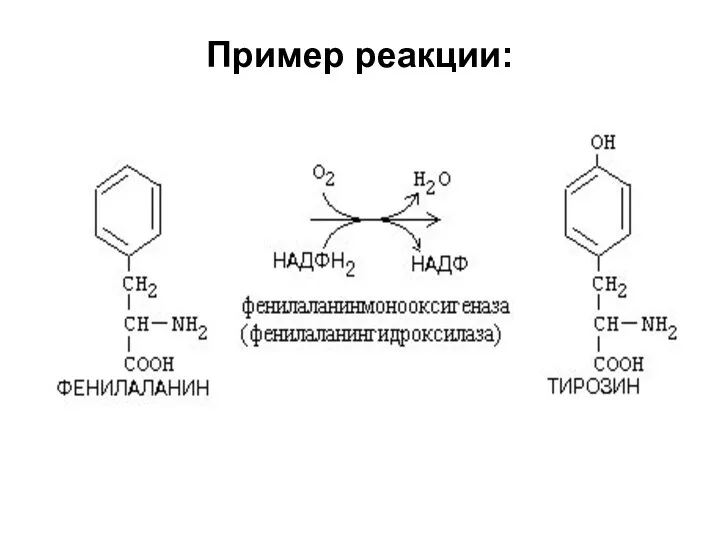
3. Оксигеназы (гидроксилазы)
Атом кислорода из молекулы кислорода присоединяется к субстрату
Слайд 30
Слайд 31

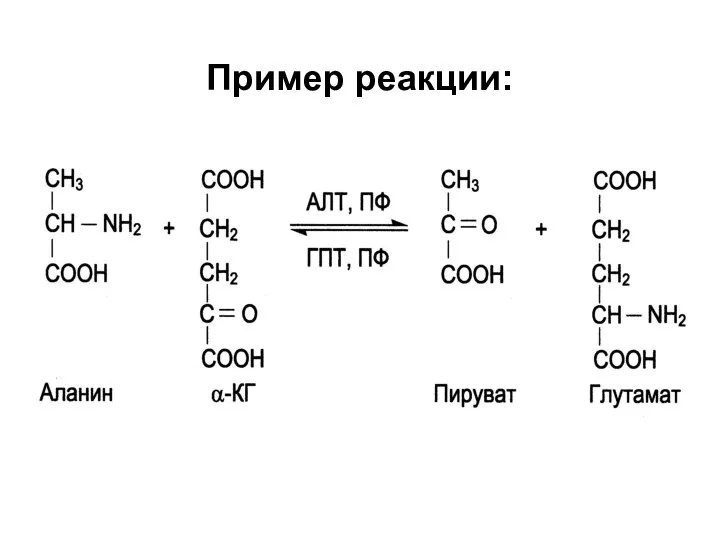
II. Трансферазы
Катализируют перенос функциональных групп от одного соединения к другому.
В
зависимости от переносимой группы: аминотрансферазы, ацилтрансферазы, метилтрансферазы, гликозилтрансферазы, киназы (фосфотрансферазы)
Слайд 32
Слайд 33

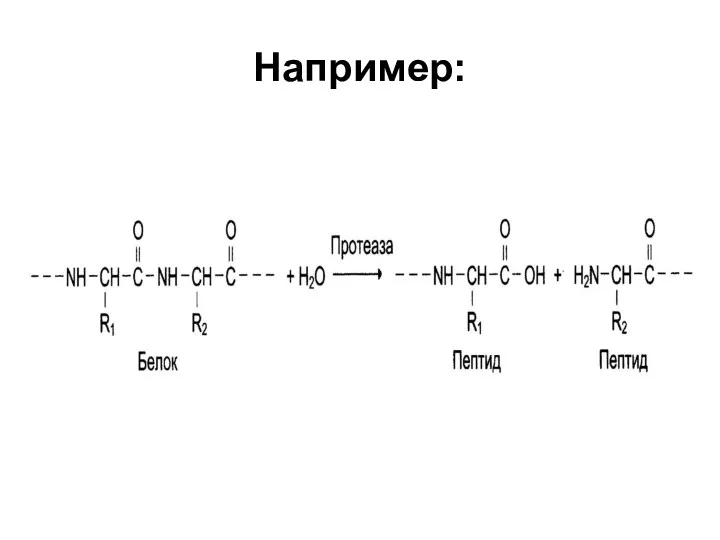
III. Гидролазы
Катализилируют реакции гидролиза (расщепление ковалентных связей с присоединением молекулы воды по
месту разрыва).
Например: протеаза, липаза, фосфолипаза, рибонуклеаза
Слайд 34
Слайд 35

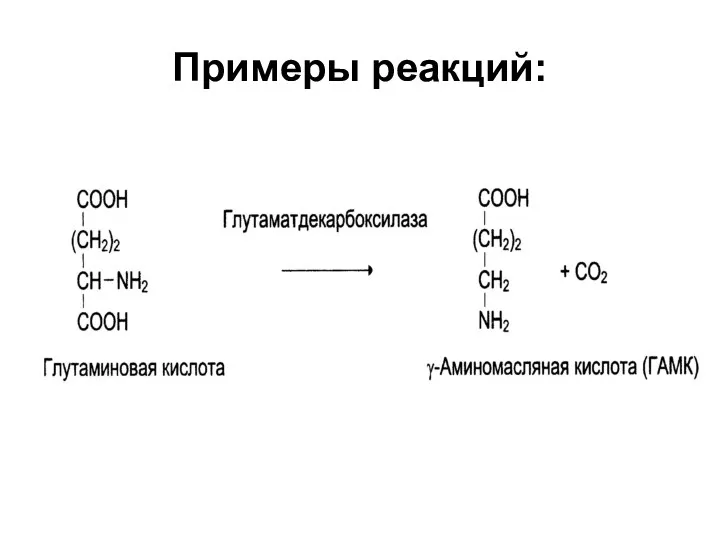
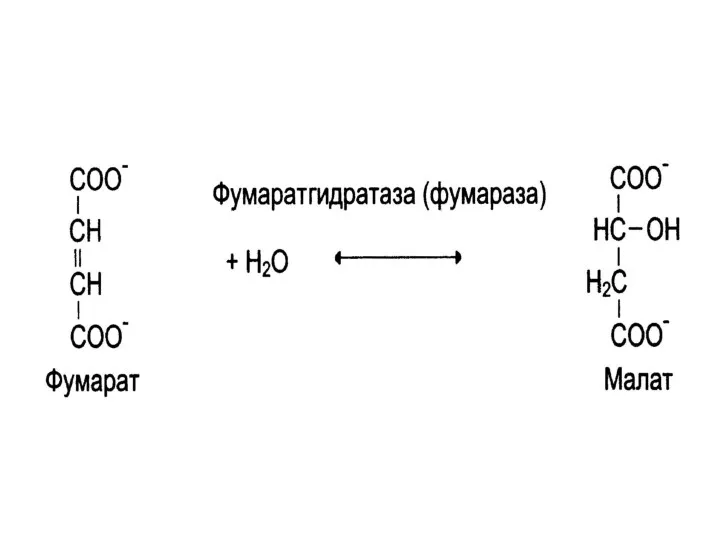
IV. Лиазы
Катализируют отщепление от субстратов определенные группы (СО2, Н2О, NH2, SH2 и
др.) без участия воды или присоединение по двойной связи молекулы воды
Слайд 36
Слайд 37
Слайд 38
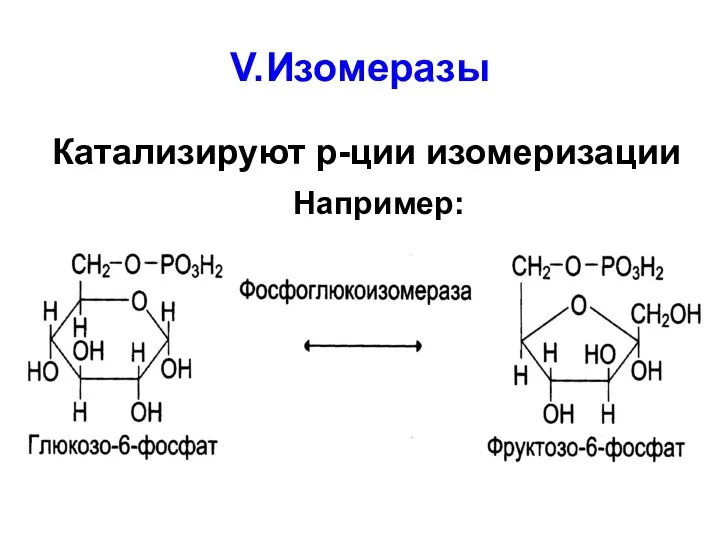
V. Изомеразы
Катализируют р-ции изомеризации
Например:
Слайд 39

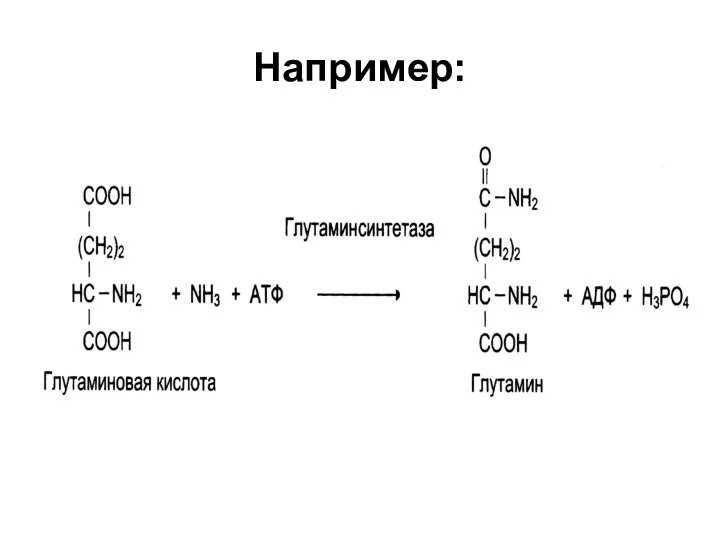
VI. Лигазы (синтетазы)
Катализируют реакции синтеза
различных веществ при участии
АТФ
Слайд 40
Слайд 41

Структура ферментов
Простые ферменты состоят только из белка (пепсин, трипсин, папаин, рибонуклеаза,
фосфатаза, уреаза и др.)
Сложные ферменты - из белковой части (апофермента) и небелковой (кофактора): низкомолекулярной органической части и/или иона металла
Слайд 42

Если константа диссоциации (Kd) комплекса «белок-кофактор» очень мала и обе части
не разделяются при выделении и очистке, то такой фермент называется холофермент, а кофактор простетической группой
Слайд 43

Другие термины небелковой части:
Кофермент (коэнзим) - часть некоторых ферментов, которая легко
отделяется от белковой части фермента и удаляется через полупроницаемую мембрану при диализе.
Кофермент должен быть непосредственно вовлечен в реакцию катализа.
Слайд 44

Коферменты:
производные витаминов;
гемы, входящие в состав цитохромов, каталазы, пероксидазы, гуанилатциклазы, NO-синтазы;
нуклеотиды –
доноры и акцепторы остатка фосфорной кислоты;
Слайд 45

Убихинон (кофермент Q), участвующий в переносе ē и Н+ в дыхательной
цепи;
Фосфоаденозилфосфосульфат (ФАФС), участвующий в переносе сульфата;
S-аденозилметионин (SAM) – донор метильной группы;
глутатион, участвующий в ОВР
Слайд 46

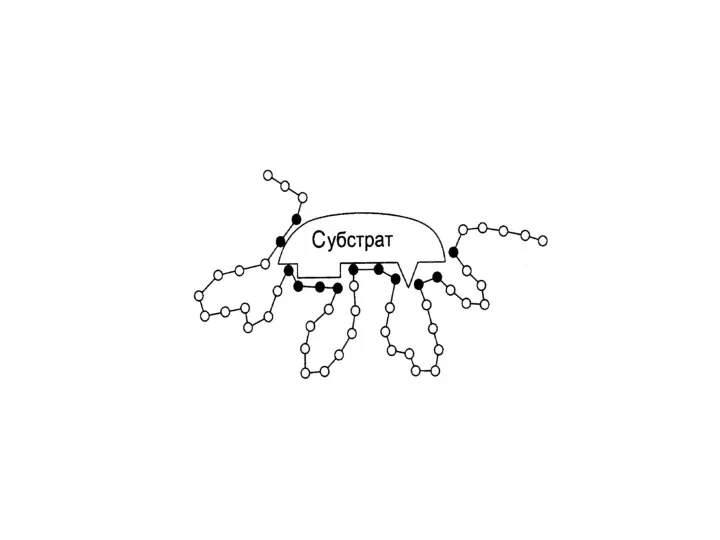
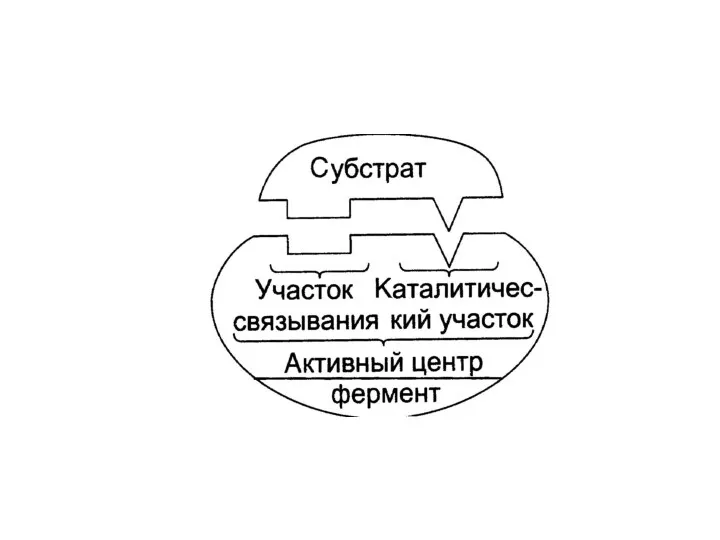
Активный центр фермента (А)
А – участок ответственный за присоединение субстрата (S)
и его химическое превращение. В нем выделяют 2 центра
Слайд 47

1. Каталитический центр – участок, непосредственно вступающий в химическое взаимодействие с
субстратом (S)
2. Связывающий центр (якорная или контактная площадка) – участок обеспечивающий связывание E с S
Слайд 48
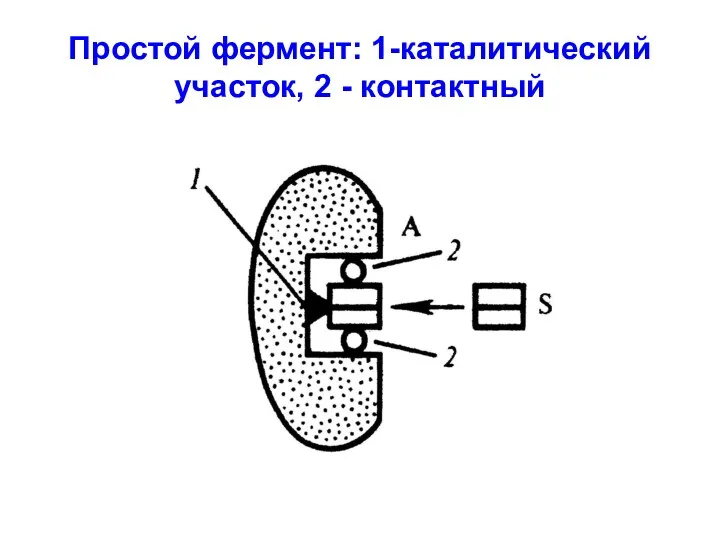
Простой фермент: 1-каталитический участок, 2 - контактный
Слайд 49
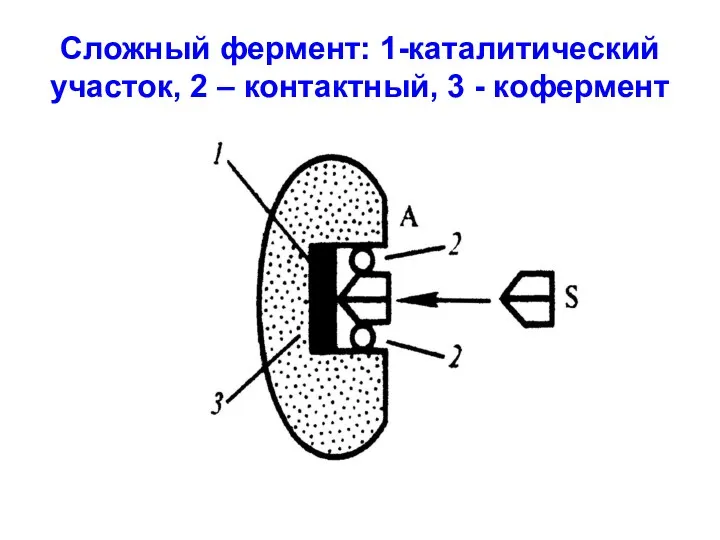
Сложный фермент: 1-каталитический участок, 2 – контактный, 3 - кофермент
Слайд 50
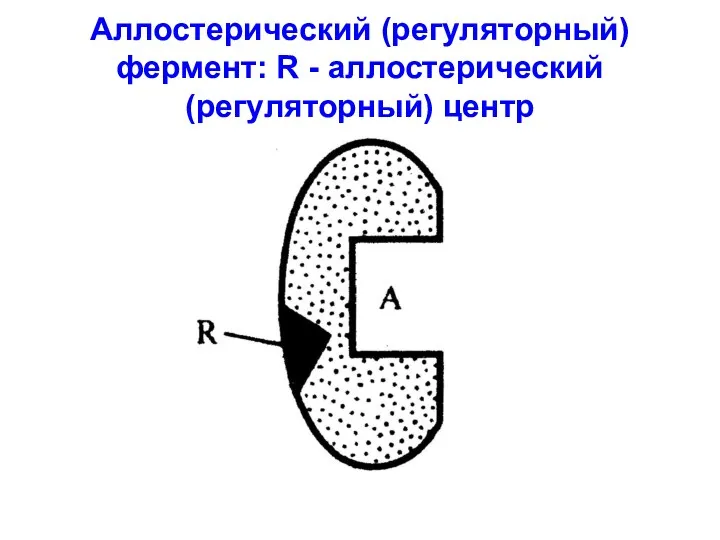
Аллостерический (регуляторный) фермент: R - аллостерический (регуляторный) центр
Слайд 51

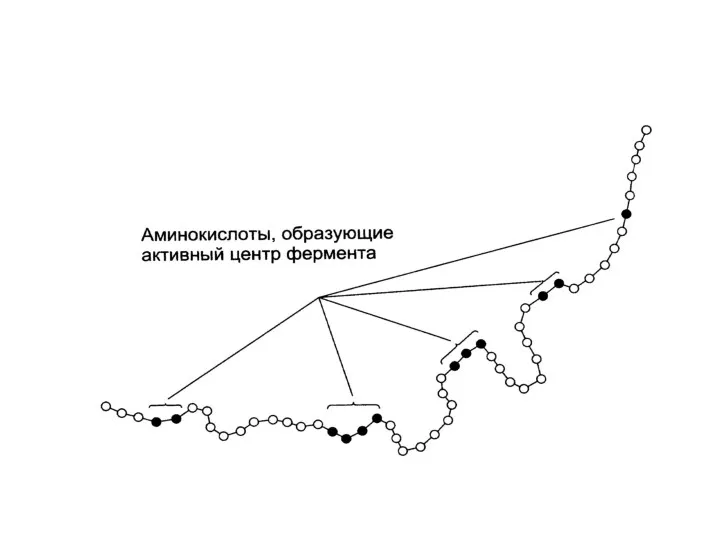
В активном центре обычно 12-16 аминокислотных остатков
АМК А находятся в различных
местах полипептидной цепи, нередко на противоположных концах
При пространственной укладке они сближаются и образуют А
Слайд 52
Слайд 53
Слайд 54
Слайд 55

У сложных ферментов главную роль контактных и каталитических центров активного центра
играет кофермент
Слайд 56

А может содержать различные функциональные группы:
NH2 (лизина, гуанидиновых групп аргинина,
концевых аминокислот),
COOH (дикарбоновых и концевых аминокислот),
OH (серина и треонина),
SH (цистеина),
Слайд 57

имидазольные гистидина,
тиоэфирные метионина,
фенольные группы тирозина,
гидрофобные цепи алифатических аминокислот,
ароматическое
кольцо фенилаланина
Слайд 58
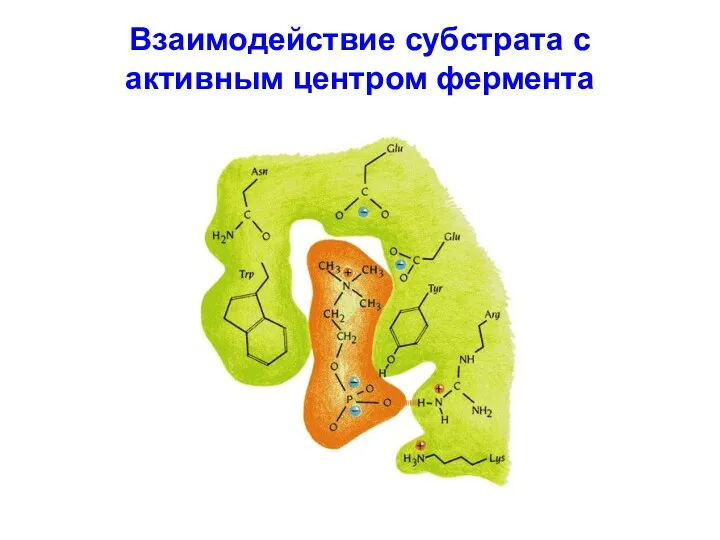
Взаимодействие субстрата с
активным центром фермента
Слайд 59

Свойства ферментов.
Общность и отличия их от
неорганических катализаторов
Слайд 60

Сходство с неорганическими катализаторами :
Повышают скорость химической реакции, но не являются
их инициаторами и не участвуют в образовании конечных продуктов (Р)
Не сдвигают равновесие химической реакции, ускоряют момент наступления равновесия
Снижают энергию активации
Слайд 61

Отличия:
Ферменты обладают намного большей активностью
Неорганические катализаторы активны в очень жестких условиях
(высокие t, давление, присутствие кислот, щелочей), а ферменты - в мягких условиях (t тела, атмосферное давление, нейтральное значение pH)
Слайд 62

Ферменты обладают специфичностью, т.е. способностью катализировать строго определенные реакции, в которые
вовлечены только субстраты, взаимодействующие с активным центром данного фермента
Слайд 63
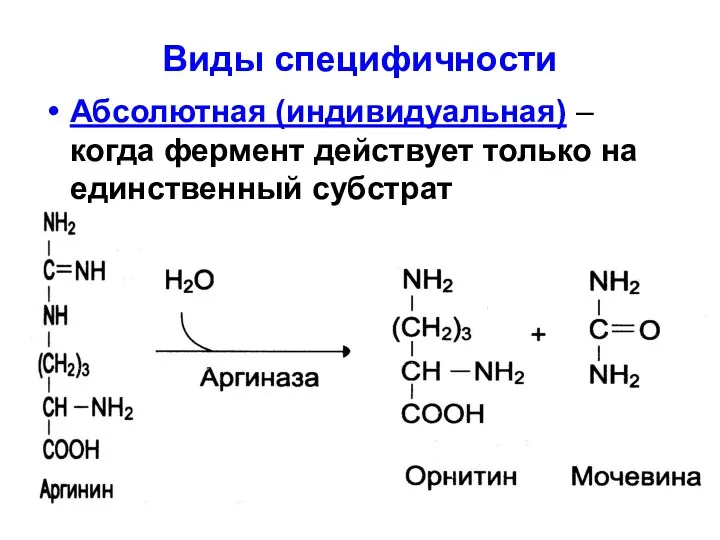
Виды специфичности
Абсолютная (индивидуальная) – когда фермент действует только на единственный
субстрат
Слайд 64

Групповая (относительная) – когда фермент действует на группу субстратов или на
один вид связи.
Например, пепсин действует только на пептидную связь в различных белках.
Слайд 65

Стереохимическая – когда фермент действует только на один из изомеров.
Самая
высокая специфичность
Слайд 66

Выделяют:
Стереоспецифичность к одному из оптических стереоизомеров:
- к D-сахарам
- к
L-аминокислотам
Слайд 67
Слайд 68

Стереоспецифичность к одному из геометрических стереоизомеров:
- к цис-транс-изомерам
- к α-
и β-гликозидным связям
(например, фермент амилаза действует только на α-гликозидные связи).
Слайд 69
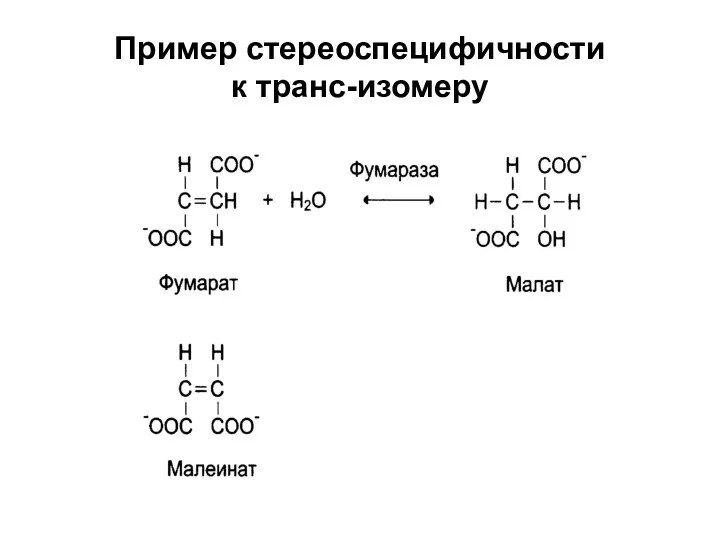
Пример стереоспецифичности к транс-изомеру
Слайд 70

Различают две основные теории специфичности ферментов:
«жесткого соответствия»
«индуцированного соответствия»
Слайд 71

1-ая теория предложена Э. Фишером
предусматривает наличие абсолютного совпадения А и S
(«ключ-замок»): S является как бы «ключом», соответствующим «замку» – А
Слайд 72








































































 Растительный мир Дальнего Востока
Растительный мир Дальнего Востока Постановка ИФА. Учет результатов реакций
Постановка ИФА. Учет результатов реакций Свойства живого
Свойства живого презентация Клетка
презентация Клетка Животные из красной книги
Животные из красной книги Картирование генов. Построение генетических и цитологических карт
Картирование генов. Построение генетических и цитологических карт 27 февраля – День белого медведя
27 февраля – День белого медведя Все о витамине С и его определение в лекарственных растениях и продуктах питания
Все о витамине С и его определение в лекарственных растениях и продуктах питания Периодизация и продолжительность жизни животных
Периодизация и продолжительность жизни животных Нормальная анатомия легких, плевры и средостения
Нормальная анатомия легких, плевры и средостения Причины разнообразия жизни на Земле
Причины разнообразия жизни на Земле Белки, жиры, углеводы
Белки, жиры, углеводы Биологическая безопасность в биотехнологии
Биологическая безопасность в биотехнологии Царство грибы
Царство грибы Қартаюдың молекулалық генетикалық механизмдері
Қартаюдың молекулалық генетикалық механизмдері Царство Животные Подцарство Простейшие (Одноклеточные)
Царство Животные Подцарство Простейшие (Одноклеточные) Органічні сполуки. Мікроелементи. Клітинна мембрана
Органічні сполуки. Мікроелементи. Клітинна мембрана Здоровьесберегающий подход к выбору туалетного мыла
Здоровьесберегающий подход к выбору туалетного мыла Изоляция
Изоляция Экологические группы растений
Экологические группы растений Система органов человека
Система органов человека Детям о насекомых
Детям о насекомых презентация Птицы нашего края
презентация Птицы нашего края 9 Обмен углеводов 1ч
9 Обмен углеводов 1ч Покровы тела. Сравнительная характеристика
Покровы тела. Сравнительная характеристика Естественный отбор и борьба за существование
Естественный отбор и борьба за существование Specimen Preparation for SEM investigation
Specimen Preparation for SEM investigation Пищеварительная система
Пищеварительная система