Содержание
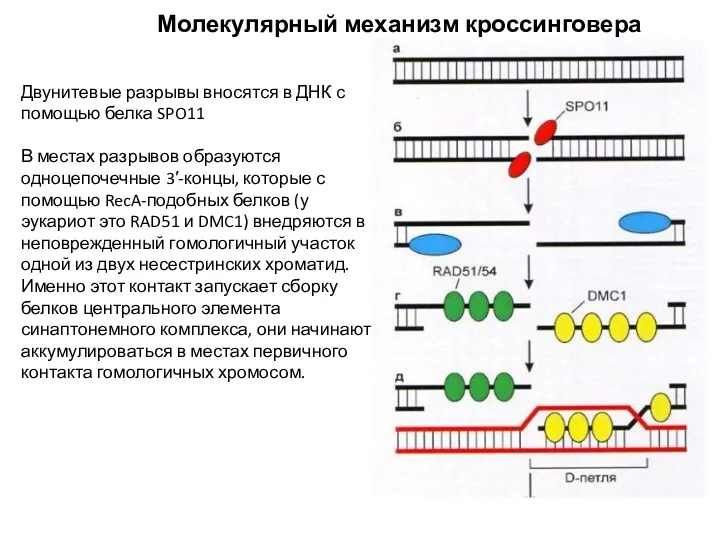
- 2. Молекулярный механизм кроссинговера Двунитевые разрывы вносятся в ДНК с помощью белка SPO11 В местах разрывов образуются
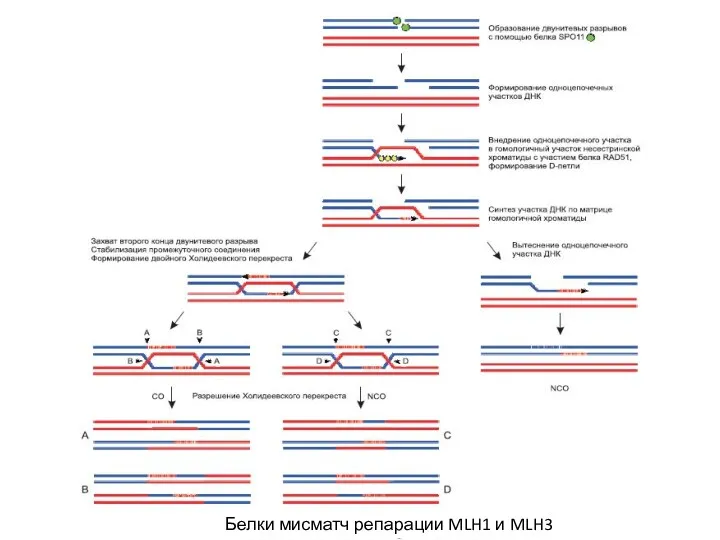
- 3. Белки мисматч репарации MLH1 и MLH3
- 4. Картирование генов Построение генетических и цитологических карт Толмачева Екатерина Николаевна Кандидат биологических наук, доцент кафедры биологии
- 5. Картирование генов - определение положения данного гена на какой-либо хромосоме относительно других генов. Используются три основных
- 6. Генетические и физические карты хромосом Генетическое картирование основано на использовании генетических методов для построения карт, показывающих
- 7. Морган представлял себе гены упорядоченными по длине хромосом, как бусинки в ожерелье Экспериментальные данные привели его
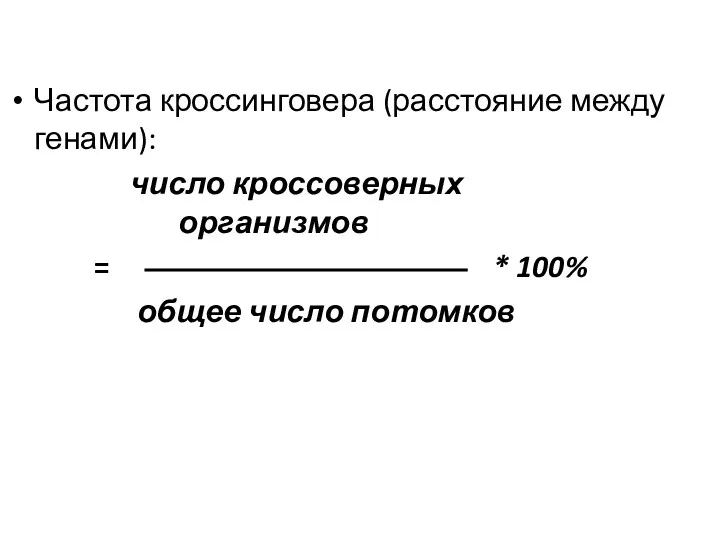
- 8. Частота кроссинговера (расстояние между генами): число кроссоверных организмов = * 100% общее число потомков
- 9. Эта частота строго пропорциональна расстоянию между сцепленными генами и измеряется в морганидах 1 морганида соответствует 1%
- 10. Частота рекомбинаций ЧР = Серое тело, длинные крылья (BbVv) – 965 (41,5%) Черное тело, короткие крылья
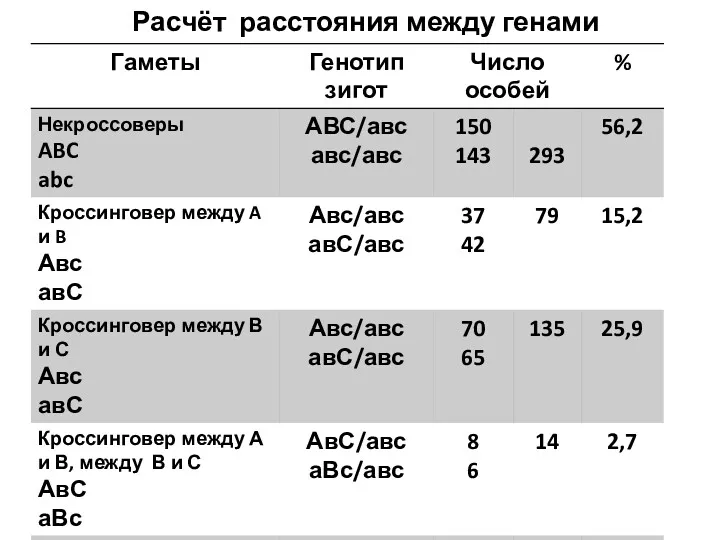
- 11. Расчёт расстояния между генами
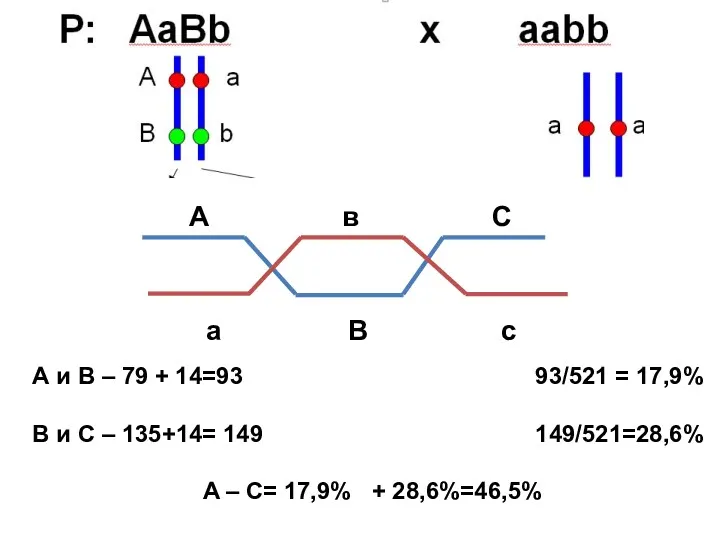
- 12. А в С а В с А и В – 79 + 14=93 93/521 = 17,9%
- 13. А. Стертевант в 1913 г. составил первую генетическую карту локализации генов в Х-хромосоме дрозофилы Генетические карты
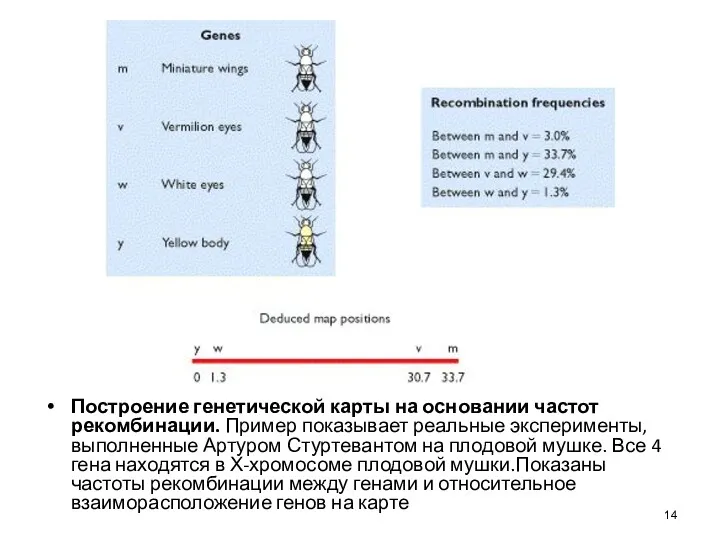
- 14. Построение генетической карты на основании частот рекомбинации. Пример показывает реальные эксперименты, выполненные Артуром Стуртевантом на плодовой
- 15. Генетические карты (группы сцепления) дрозофилы.
- 16. Генеалогический анализ в составлении генетических карт человека Для человека невозможно проведение экспериментальных браков с целью создания
- 17. Пример анализа родословной людей. (A) Родословная показывает наследование генетической болезни в семье двух живых родителей и
- 18. Физическое картирование использует молекулярно-биологические методы для непосредственного исследования молекул ДНК и построения карт, показывающих позиции определенных
- 19. Последовательности, распознаваемые разными рестриктазами EcoRI Г ААТТЦ ЦТТАА Г SmaI ЦЦЦ ГГГ ГГГ ЦЦЦ ДНК разрезают
- 20. Опорные точки карт хромосом – гены и ДНК-маркеры Гены – очень часто используемые маркеры, но они
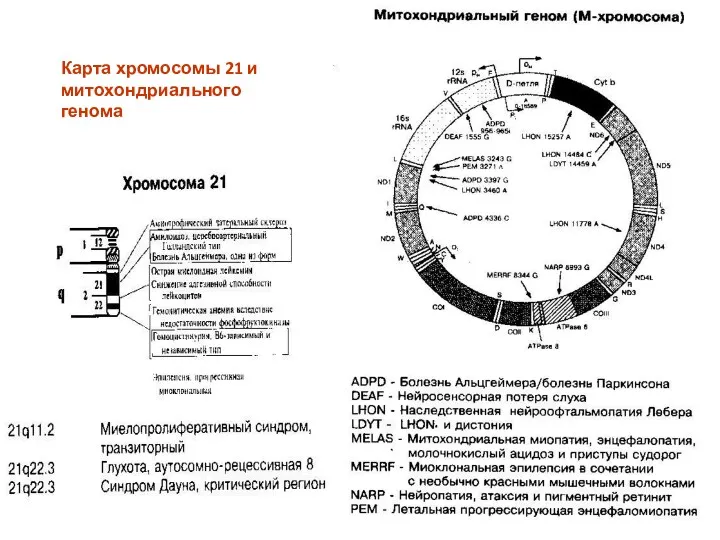
- 21. Карта хромосомы 21 и митохондриального генома
- 23. Методы картирования хромосом человека метод гибридизации соматических клеток грызунов и человека в культуре ткани Если изолировать
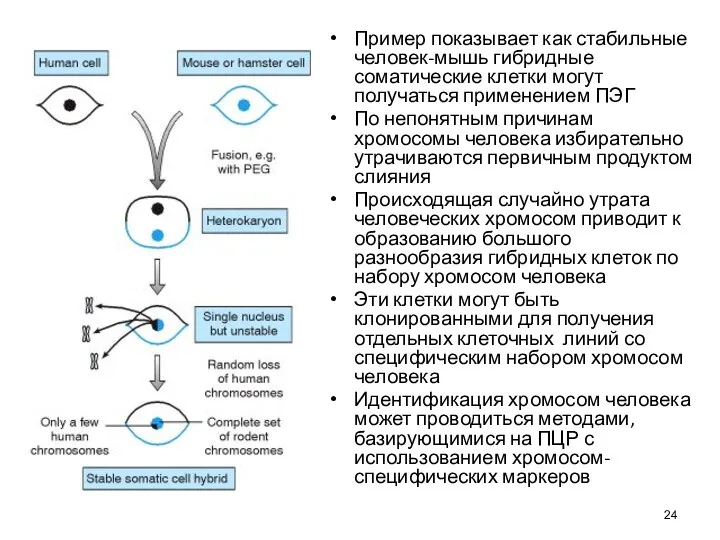
- 24. Пример показывает как стабильные человек-мышь гибридные соматические клетки могут получаться применением ПЭГ По непонятным причинам хромосомы
- 25. В гибридных клетках человек-мышь, полученных в результате слияния анеуплоидных клеток мыши и диплоидных эмбриональных фибробластов человека,
- 26. После размножения этой клетки можно провести анализ ферментов, активность которых связана с наличием именно данной хромосомы
- 27. В настоящее время для картирования генов хромосом человека используются также другие методы: Биохимические методы — сравнение
- 28. Пример анализа родословной людей. (A) Родословная показывает наследование генетической болезни в семье двух живых родителей и
- 31. Секвенирование ДНК определение первичной нуклеотидной последовательности (от англ. sequence — последовательность). В результате секвенирования получается линейное
- 32. Секвенирование ДНК Для секвенирования применяются методы Эдмана, Сэнжера и другие; в настоящее время для секвенирования нуклеиновых
- 33. Секвенирование ДНК по Сэнжеру Методология секвенирования была разработана в конце 1970-х гг. английским биохимиком Фредериком Сэнжером.
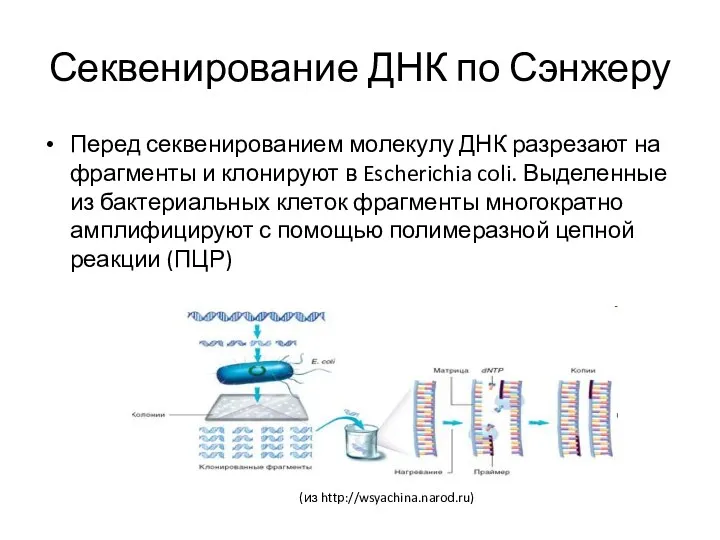
- 34. Секвенирование ДНК по Сэнжеру Перед секвенированием молекулу ДНК разрезают на фрагменты и клонируют в Escherichia coli.
- 35. Секвенирование ДНК по Сэнжеру Раствор с одноцепочечными фрагментами и праймерами распределяют по четырём пробиркам, в каждую
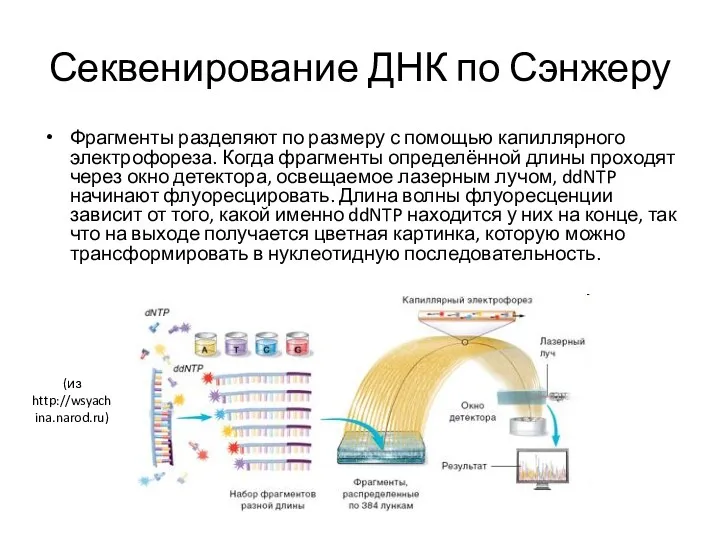
- 36. Секвенирование ДНК по Сэнжеру Фрагменты разделяют по размеру с помощью капиллярного электрофореза. Когда фрагменты определённой длины
- 37. Автоматическое секвенирование ДНК Особенно перспективным для массового секвенирования в автоматическом режиме оказалось применение меченых различными флуорохромами
- 41. Скачать презентацию


























 Продуктивность кукурузы в зависимости от приемов выращивания в центральной зоне Краснодарского края
Продуктивность кукурузы в зависимости от приемов выращивания в центральной зоне Краснодарского края Конспект урока. Внутреннее строение рыбы
Конспект урока. Внутреннее строение рыбы Волевые качества и самоконтроль спортсменов гребли на байдарке.
Волевые качества и самоконтроль спортсменов гребли на байдарке. Микробиология, как наука
Микробиология, как наука Тип Хордовые. Подтип Бесчерепные. Подтип Черепные (Позвоночные)
Тип Хордовые. Подтип Бесчерепные. Подтип Черепные (Позвоночные) Морщины как признак старения кожи
Морщины как признак старения кожи Методика решения задач по биологии подготовка к егэ
Методика решения задач по биологии подготовка к егэ Урок по биологии 8 класс Строение органа слуха
Урок по биологии 8 класс Строение органа слуха Обмен веществ и превращение энергии
Обмен веществ и превращение энергии Тип Хордовые
Тип Хордовые Дождевой червь. Опыты в детском саду
Дождевой червь. Опыты в детском саду Семейство растений пасленовые
Семейство растений пасленовые Влияние физических упражнений на организм человека
Влияние физических упражнений на организм человека Цветущий май
Цветущий май Вирусные заболевания человека
Вирусные заболевания человека Размножение птиц
Размножение птиц Урок биологии в 5 классе Наука о живой природе
Урок биологии в 5 классе Наука о живой природе Як вчаться пташенята
Як вчаться пташенята Вода и её роль в жизнедеятельности клетки
Вода и её роль в жизнедеятельности клетки Слуховий і вестибулярний аналізатори
Слуховий і вестибулярний аналізатори Pielea, organ tactil, termic, dureros și de presiune. (Lectie 11)
Pielea, organ tactil, termic, dureros și de presiune. (Lectie 11) Разнообразие животных
Разнообразие животных Микроорганизмдер генетикасы
Микроорганизмдер генетикасы Растения и окружающая среда
Растения и окружающая среда Развитие жизни на Земле
Развитие жизни на Земле Современные молекулярногенетические методы
Современные молекулярногенетические методы Многообразие грибов. Значение грибов в природе и жизни человека
Многообразие грибов. Значение грибов в природе и жизни человека Презентация Плоды
Презентация Плоды