Содержание
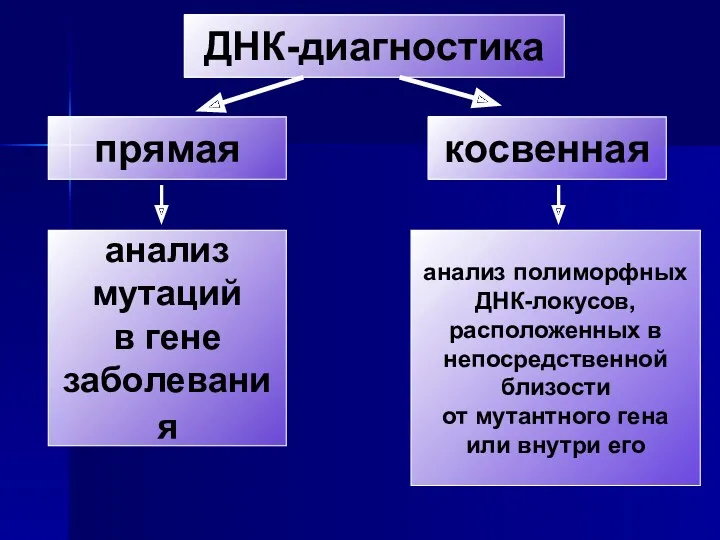
- 2. ДНК-диагностика прямая косвенная анализ мутаций в гене заболевания анализ полиморфных ДНК-локусов, расположенных в непосредственной близости от
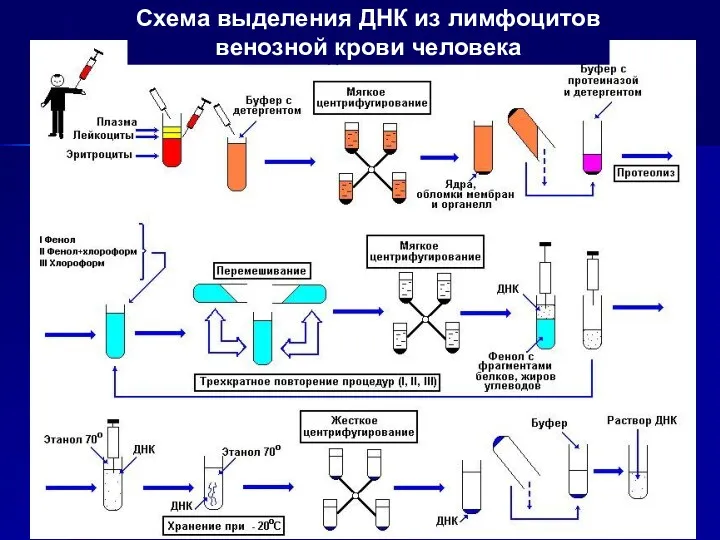
- 3. Схема выделения ДНК из лимфоцитов венозной крови человека
- 4. Полимеразная цепная реакция (ПЦР, PCR) Метод ПЦР был предложен в 1983 году американским исследователем Керри Мюллисом.
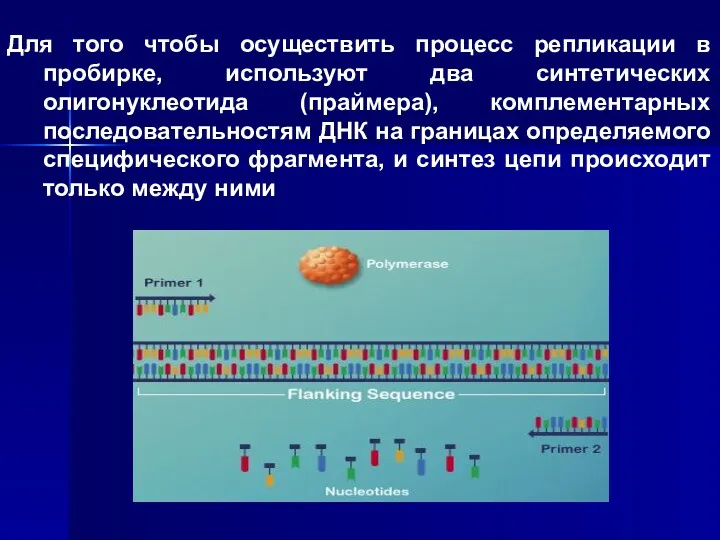
- 5. Для того чтобы осуществить процесс репликации в пробирке, используют два синтетических олигонуклеотида (праймера), комплементарных последовательностям ДНК
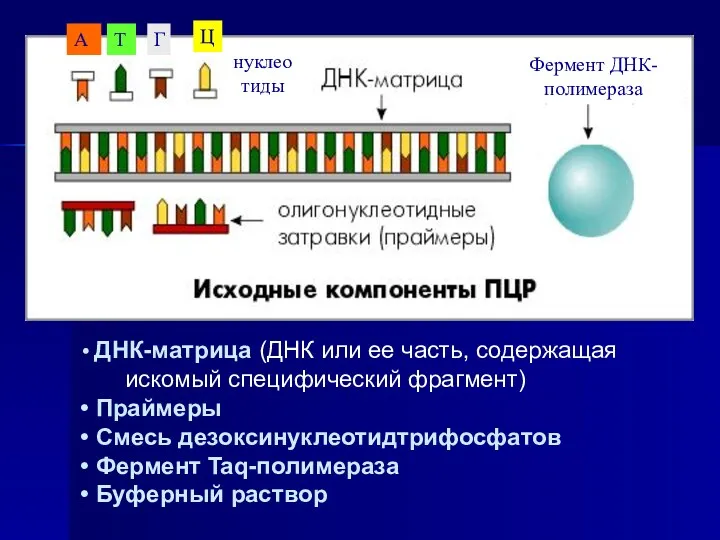
- 6. ДНК-матрица (ДНК или ее часть, содержащая искомый специфический фрагмент) Праймеры Смесь дезоксинуклеотидтрифосфатов Фермент Taq-полимераза Буферный раствор
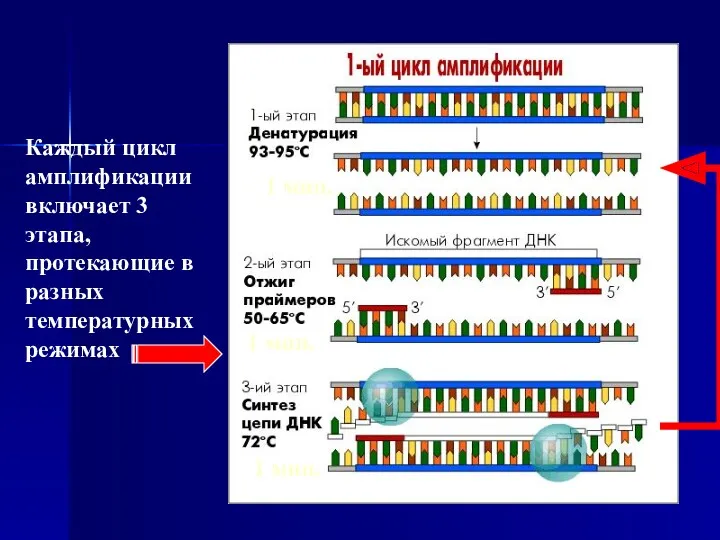
- 7. Циклический температурный режим ПЦР Каждый цикл амплификации включает 3 этапа, протекающих в различных температурных режимах: 1
- 8. Каждый цикл амплификации включает 3 этапа, протекающие в разных температурных режимах
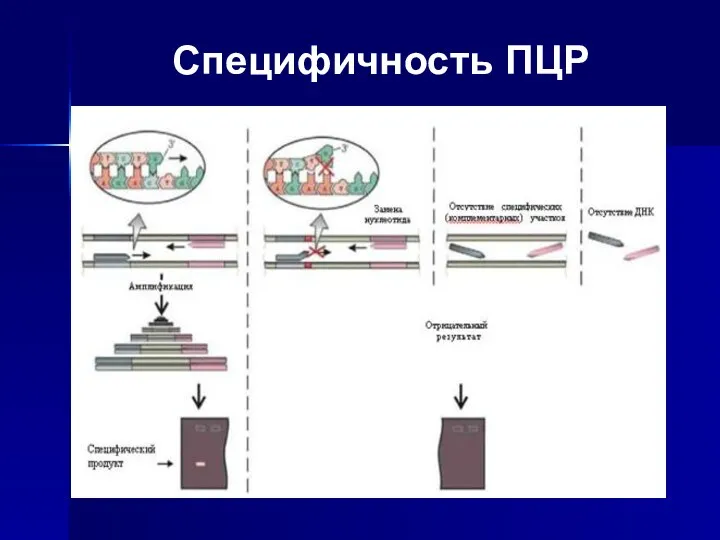
- 9. Специфичность ПЦР
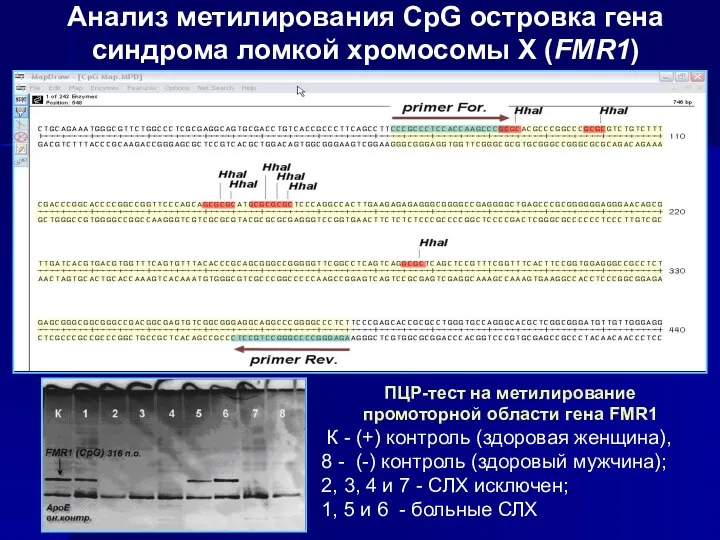
- 10. Анализ метилирования CpG островка гена синдрома ломкой хромосомы Х (FMR1) ПЦР-тест на метилирование промоторной области гена
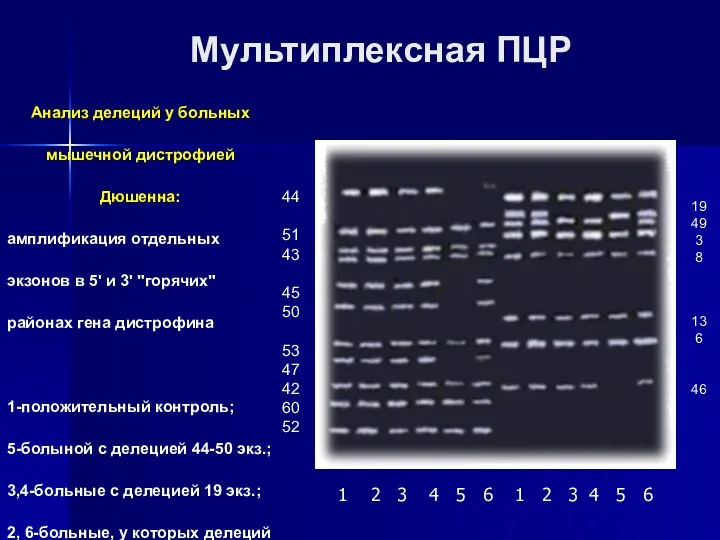
- 11. Мультиплексная ПЦР Анализ делеций у больных мышечной дистрофией Дюшенна: амплификация отдельных экзонов в 5' и 3'
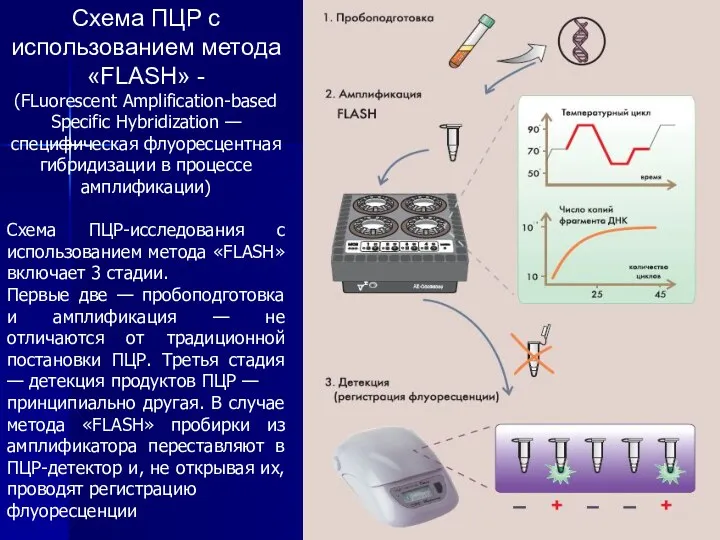
- 12. Схема ПЦР с использованием метода «FLASH» - (FLuorescent Amplification-based Specific Hybridization — специфическая флуоресцентная гибридизации в
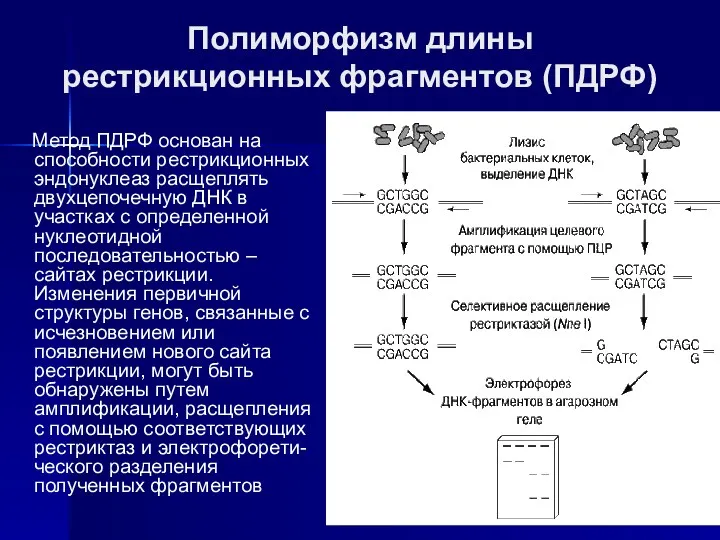
- 13. Полиморфизм длины рестрикционных фрагментов (ПДРФ) Метод ПДРФ основан на способности рестрикционных эндонуклеаз расщеплять двухцепочечную ДНК в
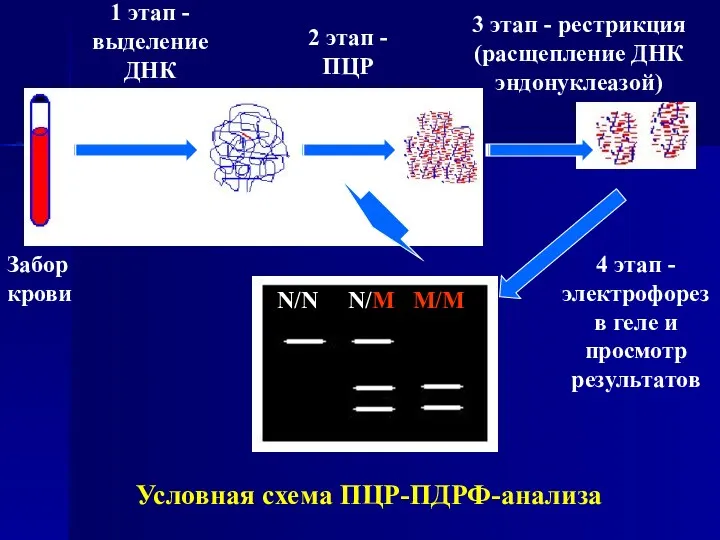
- 14. Условная схема ПЦР-ПДРФ-анализа 1 этап - выделение ДНК 2 этап - ПЦР 3 этап - рестрикция
- 15. Рестрикционный анализ
- 16. ПЦР в реальном времени Метод ПЦР «в реальном времени» включает в себя одновременную детекцию и количественное
- 17. Различные типы ПЦР «в реальном времени» Типы ПЦР «в реальном времени» различаются по способам генерации репортерной
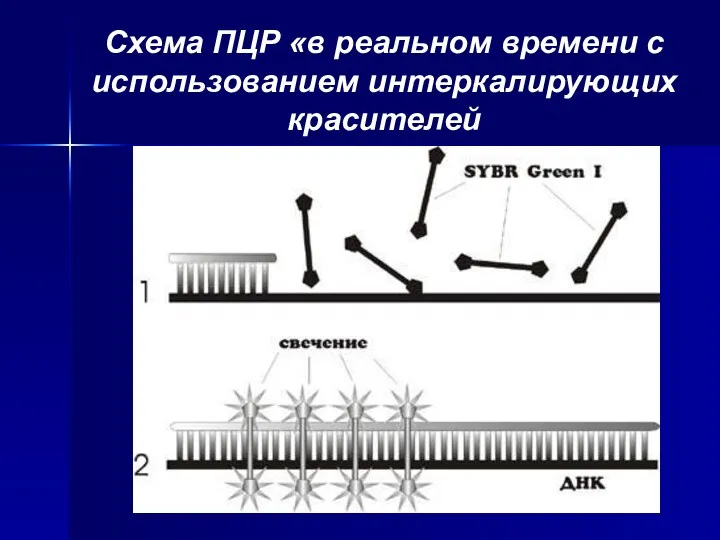
- 18. Схема ПЦР «в реальном времени с использованием интеркалирующих красителей
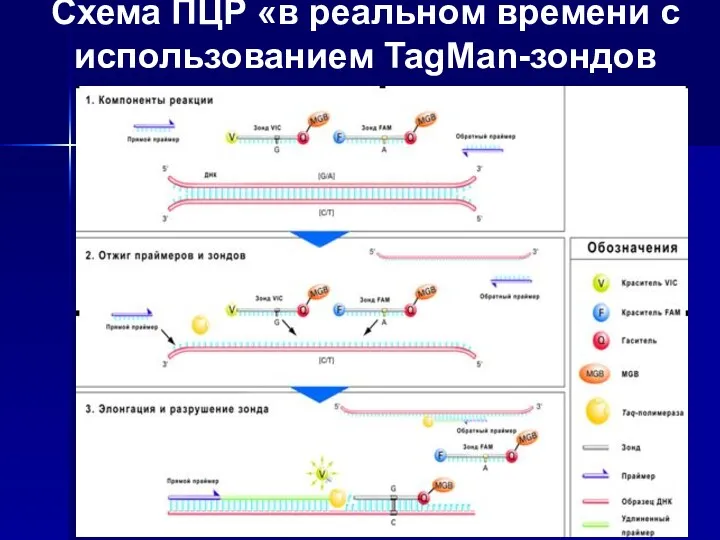
- 19. Схема ПЦР «в реальном времени с использованием TagMan-зондов принцип работы TaqMan-зондов
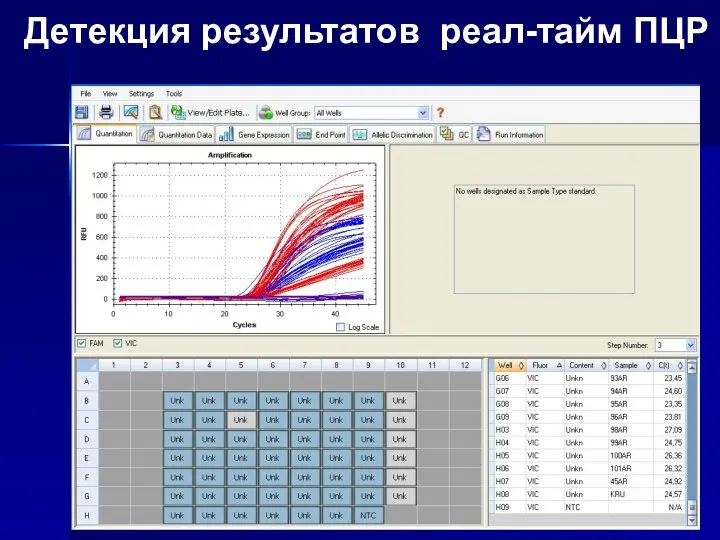
- 20. Детекция результатов реал-тайм ПЦР
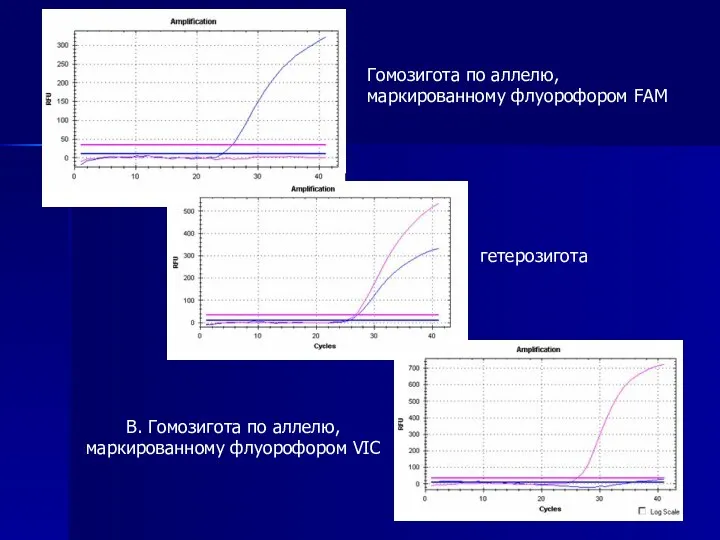
- 21. В. Гомозигота по аллелю, маркированному флуорофором VIC Гомозигота по аллелю, маркированному флуорофором FAM гетерозигота
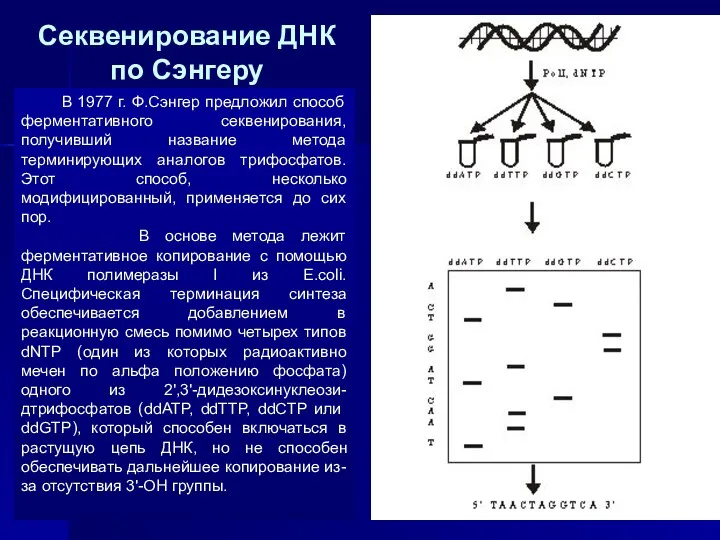
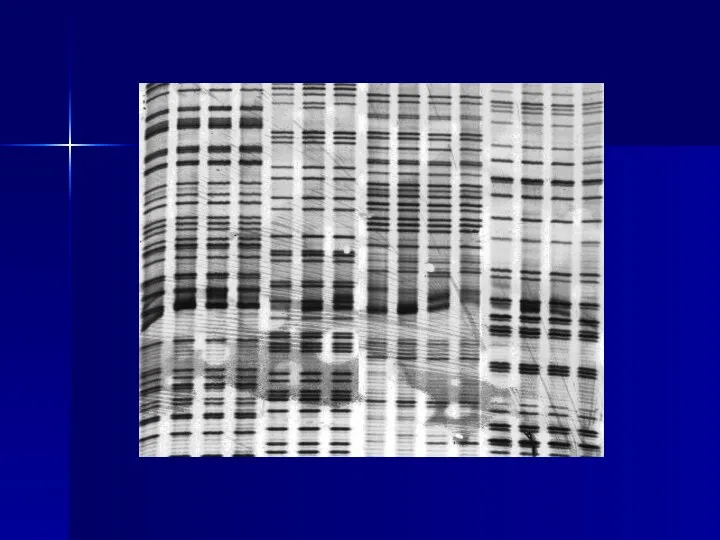
- 22. В 1977 г. Ф.Сэнгер предложил способ ферментативного секвенирования, получивший название метода терминирующих аналогов трифосфатов. Этот способ,
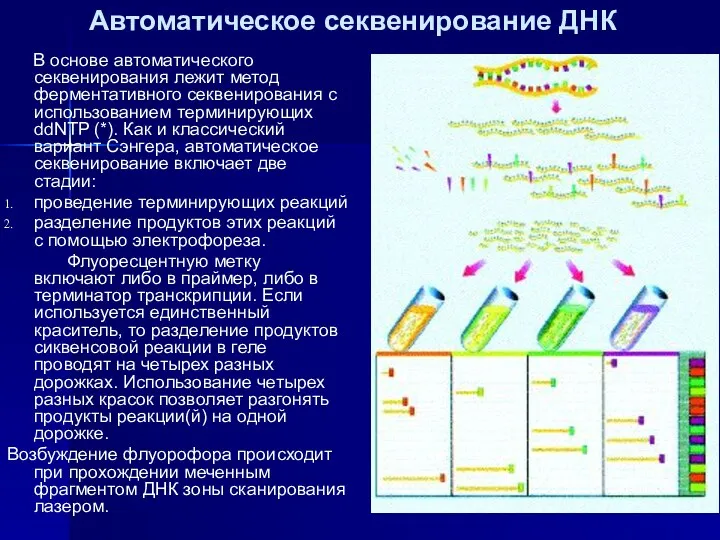
- 24. Автоматическое секвенирование ДНК В основе автоматического секвенирования лежит метод ферментативного секвенирования с использованием терминирующих ddNTP (*).
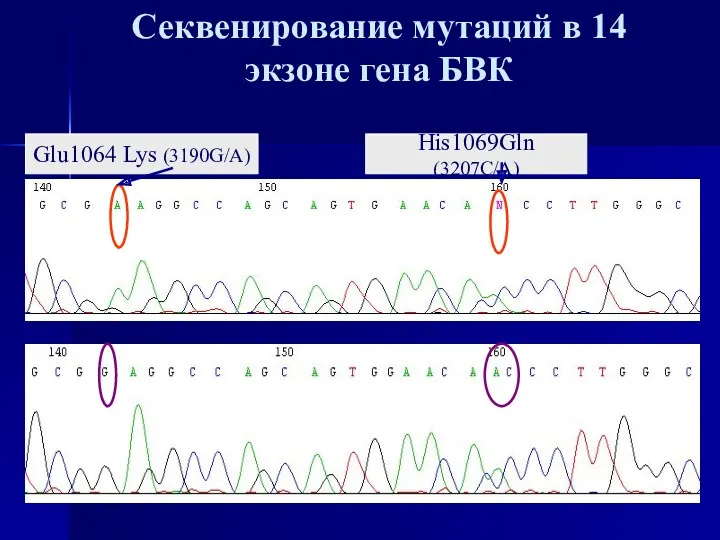
- 25. Секвенирование мутаций в 14 экзоне гена БВК Glu1064 Lys (3190G/A) His1069Gln (3207C/A)
- 26. SSCP (single strand conformation polymorphism) нормальная ДНК мутантная ДНК Метод анализа конформа- ционного полиморфизма однонитевой ДНК,
- 28. Гетеродуплексный анализ
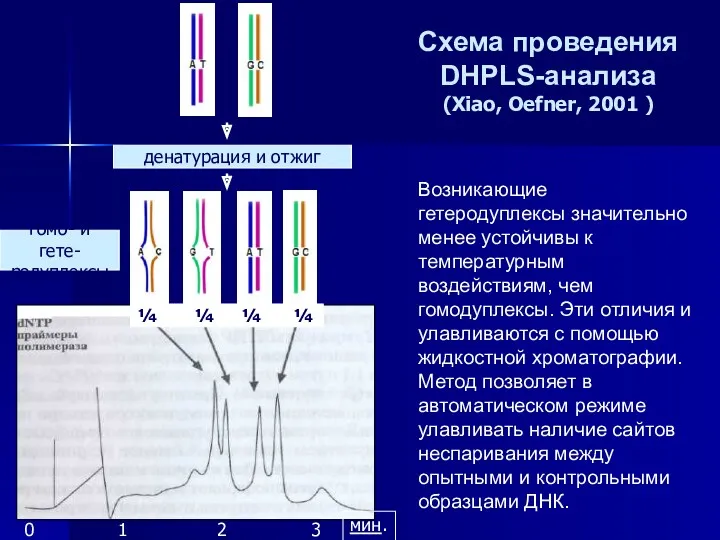
- 29. Метод DHPLC (денатурирующей жидкостной хроматографии высокого разрешения), предложенный еще в 1995 г. [Oefner, Underbill, 1995], позволяет
- 30. DHPLC Продукты ПЦР исследуемого фрагмента ДНК подвергаются частичной денатурации в растворе с контрольными образцами того же
- 31. ¼ ¼ ¼ ¼ денатурация и отжиг гомо- и гете- родуплексы 0 1 2 3 Возникающие
- 32. ДНК-чипы (DNA microarrays) Цвет и его интенсивность несут информацию о специфическом гене исследуемого образца ДНК-чип представляет
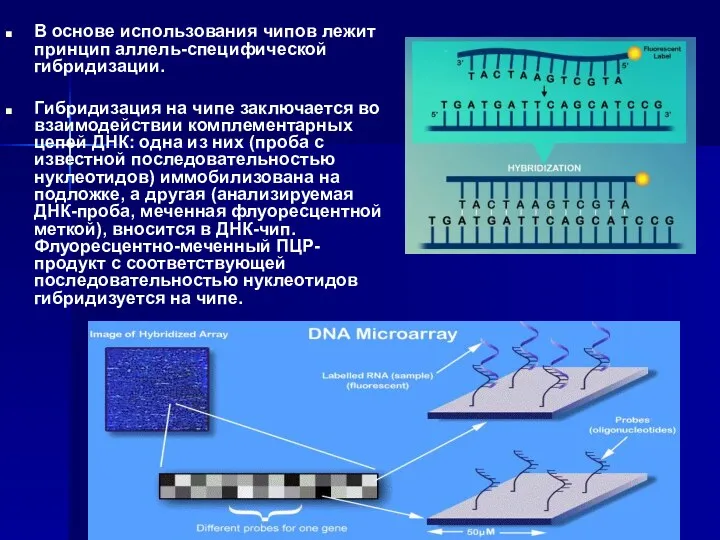
- 33. В основе использования чипов лежит принцип аллель-специфической гибридизации. Гибридизация на чипе заключается во взаимодействии комплементарных цепей
- 34. Современные технологии в молекулярной биологии: Полногеномный анализ и современные методы биоинформатики Изучение на модельных организмах Современные
- 35. Современные технологии исследования наследственных заболеваний
- 36. Секвенирование ДНК 1980-1990 1990-2005 > 2005 Radio - gel Fluorescent - capillary Next generation Thousand bp
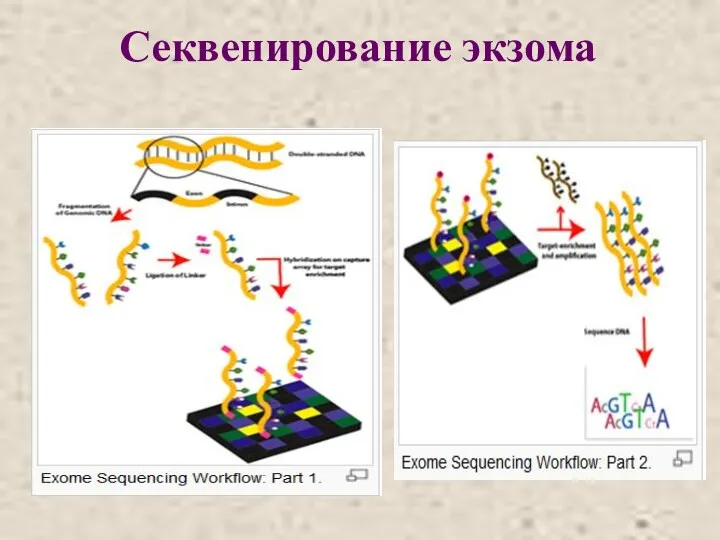
- 37. Секвенирование экзома
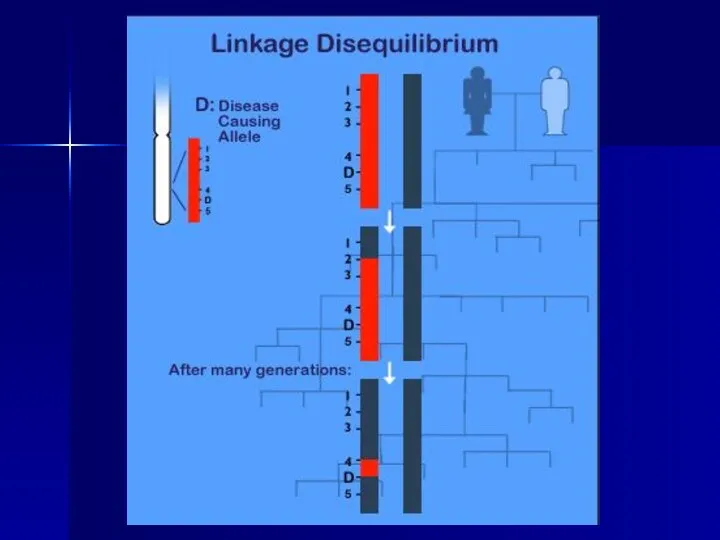
- 38. Косвенные методы ДНК-диагностики Генетический полиморфизм, т.е. одновременное существование в популяции нескольких аллельных вариантов какой-либо последовательности ДНК,
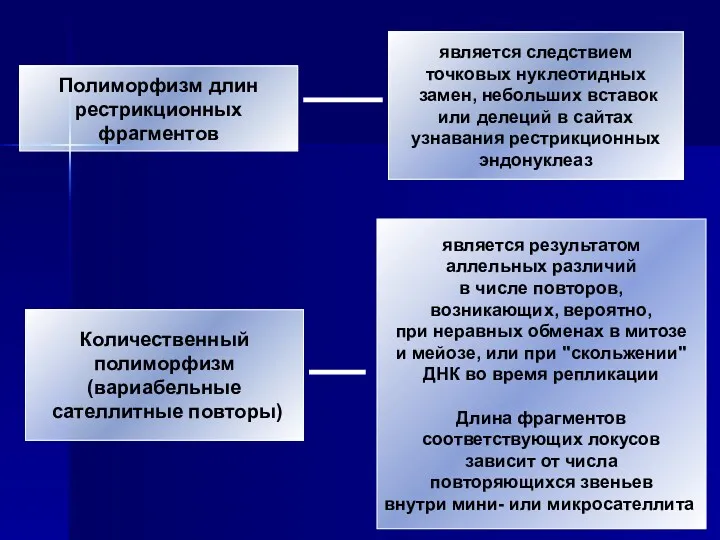
- 39. Полиморфизм длин рестрикционных фрагментов Количественный полиморфизм (вариабельные сателлитные повторы) является следствием точковых нуклеотидных замен, небольших вставок
- 40. Микросателлиты CATGTCAСАСАСАСАСАСАСАСАСАСАСАСАGATA - динуклеотидные повторы (CA-повторы) CTATTGACGACGACGACGACGACGACGTTCGGAT -тринуклеотидные повторы TCACAACTGACTGACTGACTGACTGACTGATTGAC -тетрануклеотидные повторы
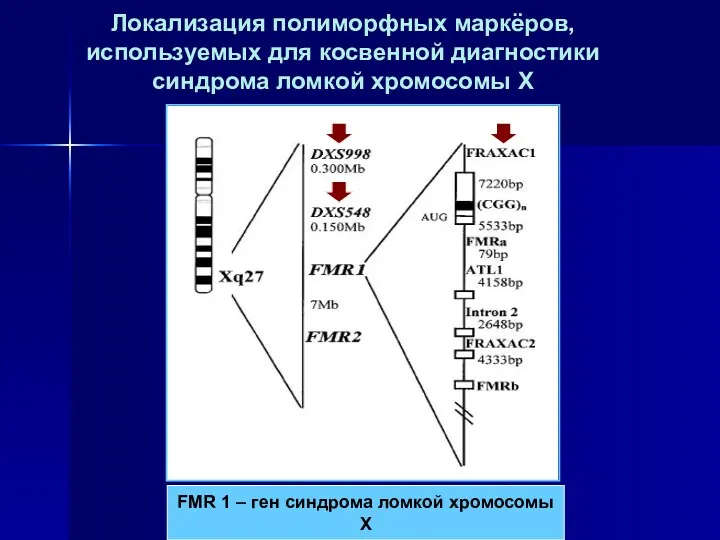
- 43. Локализация полиморфных маркёров, используемых для косвенной диагностики синдрома ломкой хромосомы Х FMR 1 – ген синдрома
- 44. Полиморфные ДНК-локусы, сцепленные с геном болезни Вильсона-Коновалова (ATP7B) Корреляция гаплотипов и мутаций в гене болезни Вильсона-Коновалова
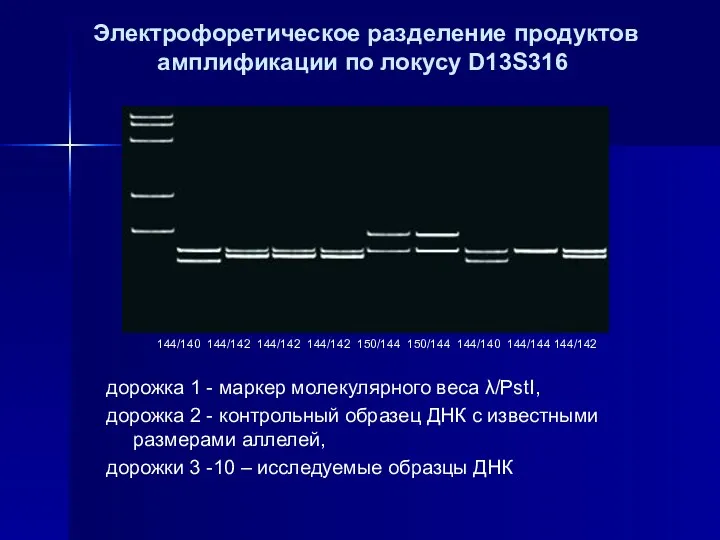
- 45. дорожка 1 - маркер молекулярного веса λ/PstI, дорожка 2 - контрольный образец ДНК с известными размерами
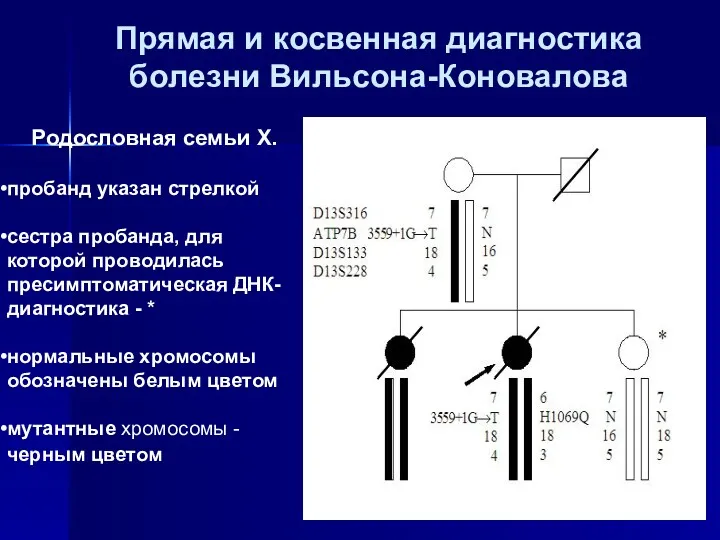
- 46. Прямая и косвенная диагностика болезни Вильсона-Коновалова Родословная семьи Х. пробанд указан стрелкой сестра пробанда, для которой
- 48. Скачать презентацию


















 Отравление животных гербицидами
Отравление животных гербицидами Культуры эукариотических клеток
Культуры эукариотических клеток Уровни организации и свойства живой материи
Уровни организации и свойства живой материи Породи свиней
Породи свиней Размножение и развитие птиц
Размножение и развитие птиц Эпителиальная ткань
Эпителиальная ткань Субстратное фосфорилирование
Субстратное фосфорилирование Викторина. Тема Птицы.
Викторина. Тема Птицы. Презентация программы элективного курса ОСНОВЫ ФИТОДИЗАЙНА для обучающихся 9 класса
Презентация программы элективного курса ОСНОВЫ ФИТОДИЗАЙНА для обучающихся 9 класса Многообразие млекопитающих
Многообразие млекопитающих Африканская чума свиней (Pestis africana suum)
Африканская чума свиней (Pestis africana suum) Тип Моллюски
Тип Моллюски Биологияны оқыту әдістемесі пәнінің қалыптасу тарихы
Биологияны оқыту әдістемесі пәнінің қалыптасу тарихы Строение тела человека. (2 класс)
Строение тела человека. (2 класс) Воздействие человека и его деятельности на животных
Воздействие человека и его деятельности на животных Спілкування тварин. 7 клас
Спілкування тварин. 7 клас Строение тела животных. Клетка.
Строение тела животных. Клетка. Клеточное строение листа
Клеточное строение листа Проблемы Антропогенеза (фрагмент курса Эволюция Биосферы)
Проблемы Антропогенеза (фрагмент курса Эволюция Биосферы) Генотип, как целостная система. Взаимодействие генов
Генотип, как целостная система. Взаимодействие генов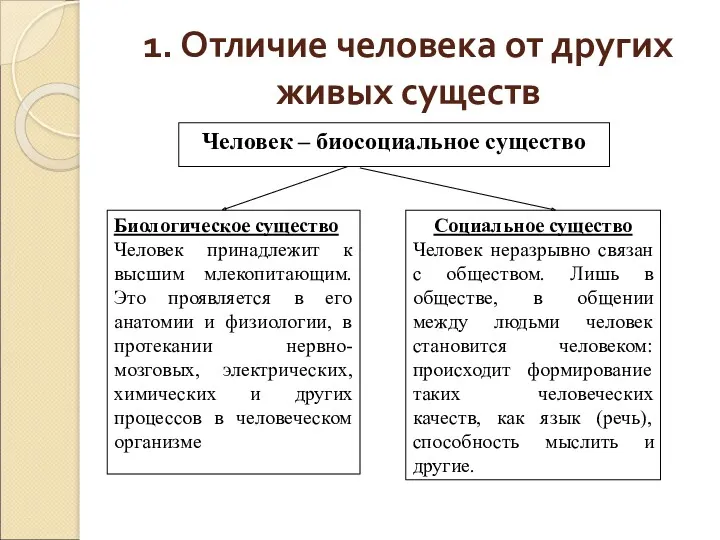 Отличие человека от других живых существ
Отличие человека от других живых существ Презентация по биологии Становление наук о человеке для 8 класса.
Презентация по биологии Становление наук о человеке для 8 класса. Отделы головного мозга
Отделы головного мозга Этапы развития науки генетики
Этапы развития науки генетики Протерозойская эра
Протерозойская эра ДЕРАТИЗАЦИЯ
ДЕРАТИЗАЦИЯ Sequoia sempervirens
Sequoia sempervirens Зрительный анализатор, его строение и функции, орган зрения
Зрительный анализатор, его строение и функции, орган зрения