Содержание
- 2. 2 класс. Трансферазы Катализируют реакции переноса группировок от одного вещества к другому: А – В +
- 3. 3 класс. Гидролазы Катализируют реакции распада более сложных веществ до более простых с присоединением воды к
- 4. 4 класс Лиазы – катализируют реакции негидролитического (без участия Н2О) распада молекул: А – В А
- 5. 5 класс. Изомеразы Катализируют изомерные превращения Например: глюкозо – 6- фосфат фруктозо – 6 – фосфат
- 6. Кинетика и регуляция ферментативного катализа
- 7. Скорость химической реакции пропорциональна концентрации реагирующих веществ (закон действующих масс), то есть зависит и от концентрации
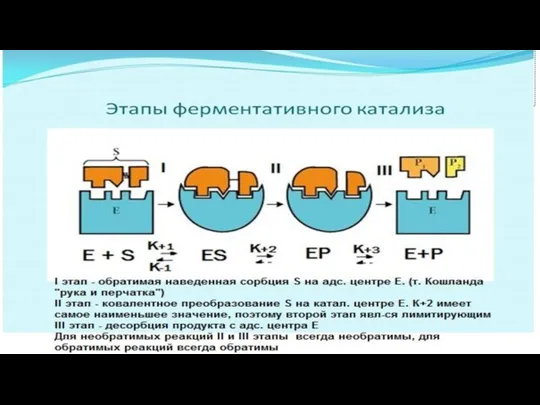
- 9. 1 этап. Происходит ориентированная сорбция субстрата на адсорбционном центре фермента. Образуется фермент-субстратный комплекс. Этап самый быстрый
- 10. 2 этап. Происходят химические превращения субстрата на каталитическом центре фермента. Образуется почти готовый продукт, но он
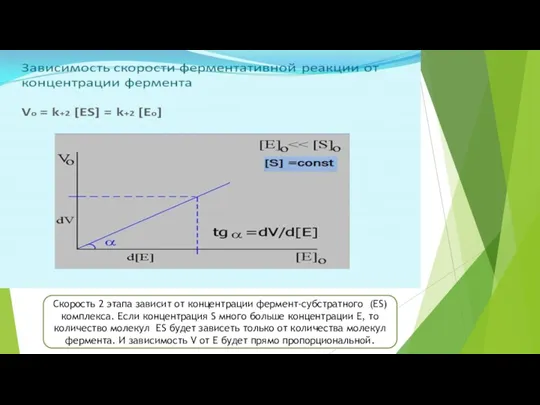
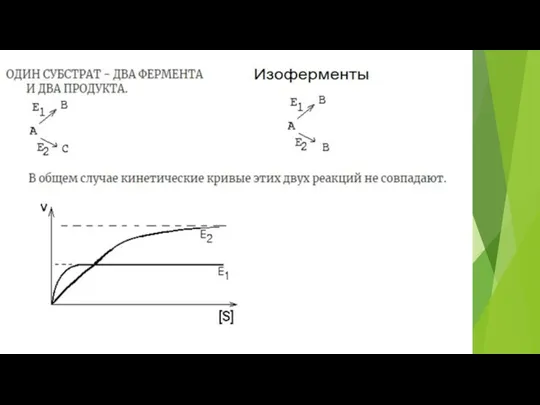
- 13. Скорость 2 этапа зависит от концентрации фермент-субстратного (ES) комплекса. Если концентрация S много больше концентрации Е,
- 19. Задача: Определить удельную активность фермента, указать, сколько юнит содержится в 1 мкг белка – фермента, если
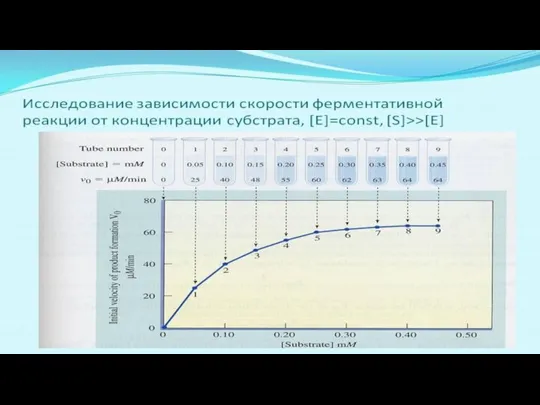
- 20. Зависимость V от S (при Е = const) – описывается уравнением Михаэлиса - Ментен При низких
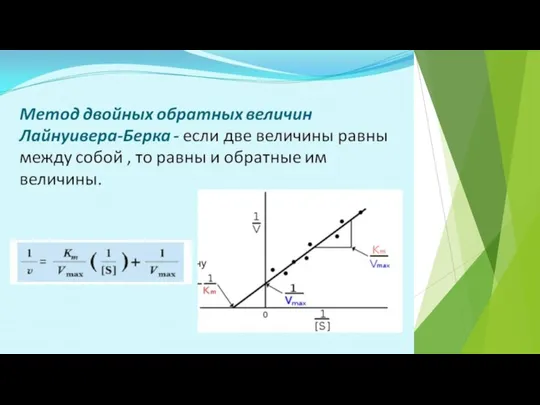
- 21. Км – константа равновесия между реакцией образования фермент-субстратного комплекса (она характеризуется k+1) и реакциями его распада
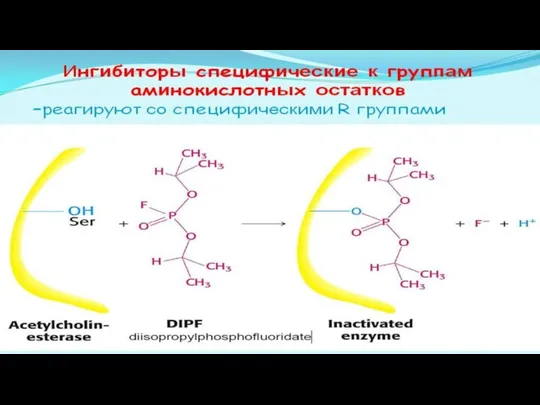
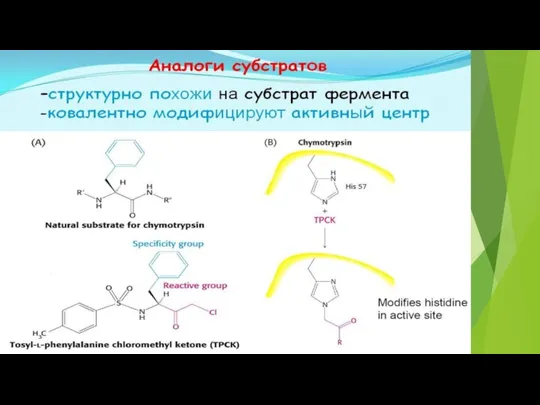
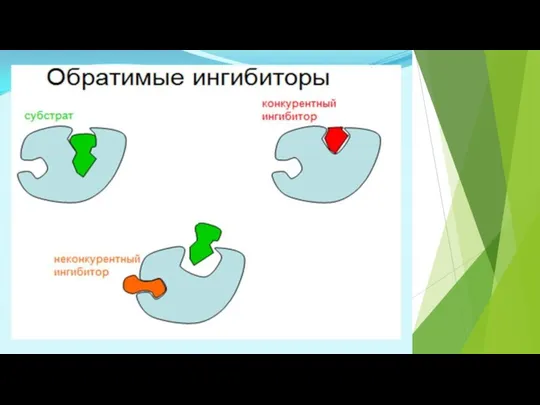
- 28. Ингибиторы делятся на неспецифические (вызывают денатурацию фермента) И специфические (связываются с определенными ферментами) Специфические :
- 34. KmI Vmax/2
- 35. 1
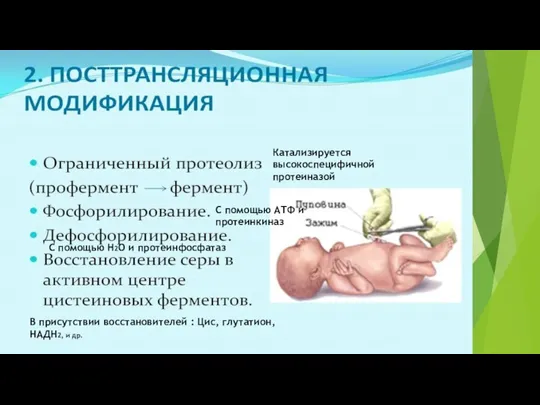
- 40. Катализируется высокоспецифичной протеиназой С помощью АТФ и протеинкиназ С помощью Н2О и протеинфосфатаз В присутствии восстановителей
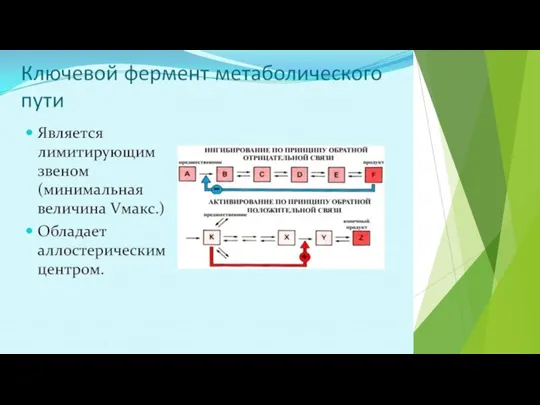
- 43. СУБСТРАТ или ПРОДУКТ - аллостерический ИНГИБИТОР своего фермента.
- 44. СУБСТРАТ - аллостерический АКТИВАТОР своего фермента Кинетическая кривая имеет S-образный характер, то есть имеет 2 перегиба
- 45. ПРОДУКТ реакции - аллостерический АКТИВАТОР своего фермента Кинетическая кривая имеет лавинообразный (взрывообразный) характер. С увеличением концентрации
- 53. Скачать презентацию








































 Строение сердца. Сердечный цикл
Строение сердца. Сердечный цикл Основы кролиководства
Основы кролиководства Адаптации организмов к условиям обитания
Адаптации организмов к условиям обитания О котах. Породы котов
О котах. Породы котов Человек. Природа человека
Человек. Природа человека Взаимоотношения человека и природы, как фактор развития биосферы
Взаимоотношения человека и природы, как фактор развития биосферы Взаимоотношения микроорганизмов. Факторы внешней среды и микроорганизмы. Экология микроорганизмов
Взаимоотношения микроорганизмов. Факторы внешней среды и микроорганизмы. Экология микроорганизмов Катаболизм. Цикл трикарбоновых кислот
Катаболизм. Цикл трикарбоновых кислот Развитие эволюционной теории. (Лекция 3)
Развитие эволюционной теории. (Лекция 3) Копротрофы. Паразиты высших растений
Копротрофы. Паразиты высших растений Кислотно – щелочное равновесие и основные буферные системы организма
Кислотно – щелочное равновесие и основные буферные системы организма Метаболизмнің гормондық реттелуі. Қоршаған және өндірістік орта факторларының әсер ету бағасының биохимиялық критерийлері
Метаболизмнің гормондық реттелуі. Қоршаған және өндірістік орта факторларының әсер ету бағасының биохимиялық критерийлері Видообразование - микроэволюция
Видообразование - микроэволюция Испарение воды растениями. Листопад
Испарение воды растениями. Листопад Строение клетки. 5 кл
Строение клетки. 5 кл Северный олень
Северный олень Искусственные природные сообщества
Искусственные природные сообщества Науки об организме человека
Науки об организме человека Азот в пище, воде и организме человека
Азот в пище, воде и организме человека “Професія” дощового черв’яка
“Професія” дощового черв’яка Отчёт-презентация по проектному уроку (биология, 6 класс, тема Шляпочные грибы)
Отчёт-презентация по проектному уроку (биология, 6 класс, тема Шляпочные грибы) Общий обзор головного мозга; его части как производные мозговых пузырей
Общий обзор головного мозга; его части как производные мозговых пузырей Увеличение антропогенного пресса водоёмы
Увеличение антропогенного пресса водоёмы Глобальная роль Fungi в биосфере Земли. Отрицательная роль грибов для человека
Глобальная роль Fungi в биосфере Земли. Отрицательная роль грибов для человека Теория стационарного состояния
Теория стационарного состояния Физминутка
Физминутка презентация Кастовая система семьи медоносной пчелы
презентация Кастовая система семьи медоносной пчелы