Содержание
- 2. 1. Общая характеристика системы регуляции На деление клеток могут действовать самые разные факторы: биогенные и абиогенные,
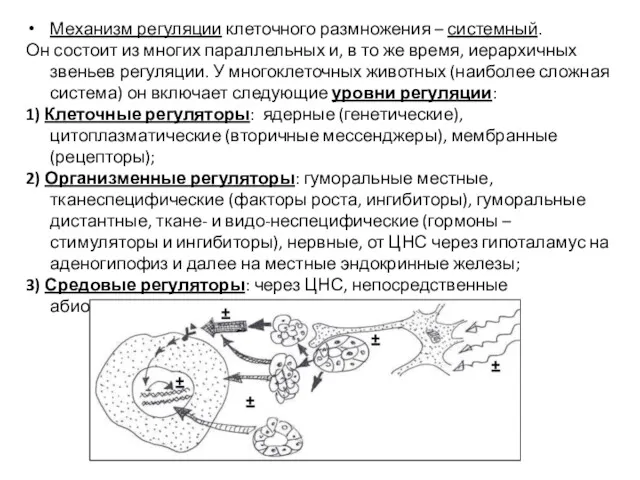
- 3. Механизм регуляции клеточного размножения – системный. Он состоит из многих параллельных и, в то же время,
- 4. NB: На разных уровнях регуляции есть как стимуляторы (+), так и ингибиторы (-). Давно существовало 2
- 5. 2. Доказательства генетического контроля цикла Установлено, что последовательность фаз митотического цикла (-G1-S-G2-M-) контролируется периодической активностью определенных
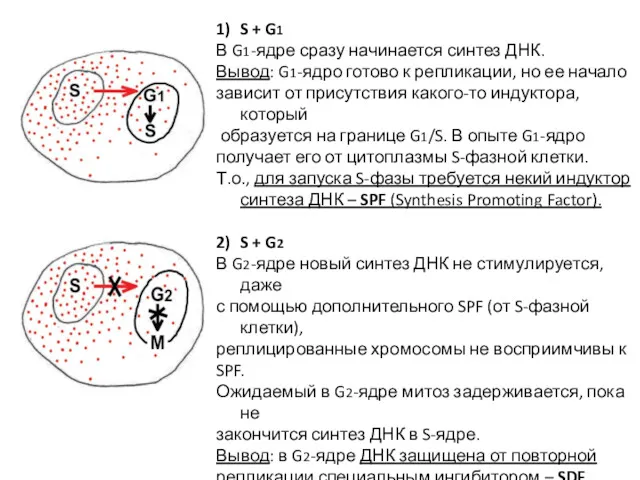
- 6. 1) S + G1 В G1-ядре сразу начинается синтез ДНК. Вывод: G1-ядро готово к репликации, но
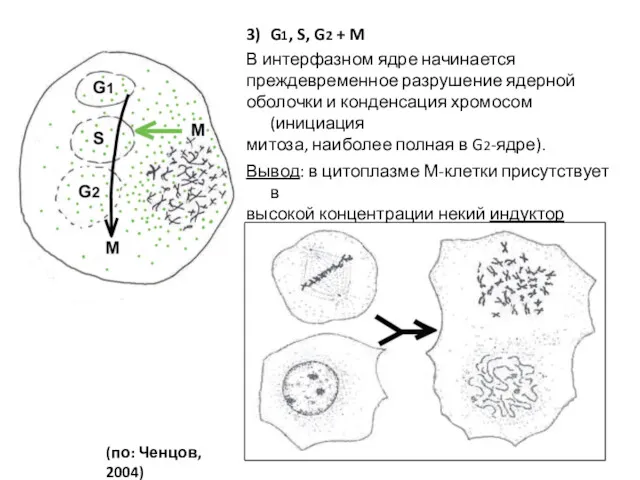
- 7. 3) G1, S, G2 + M В интерфазном ядре начинается преждевременное разрушение ядерной оболочки и конденсация
- 8. 4) G1 + G2 G1-ядро проходит цикл по графику, в G2-ядре блокируется начало митоза. Вывод: митоз
- 9. 2.2. Опыты по ингибированию синтезов РНК и белка в цикле – ингибиторный анализ для выявления возможной
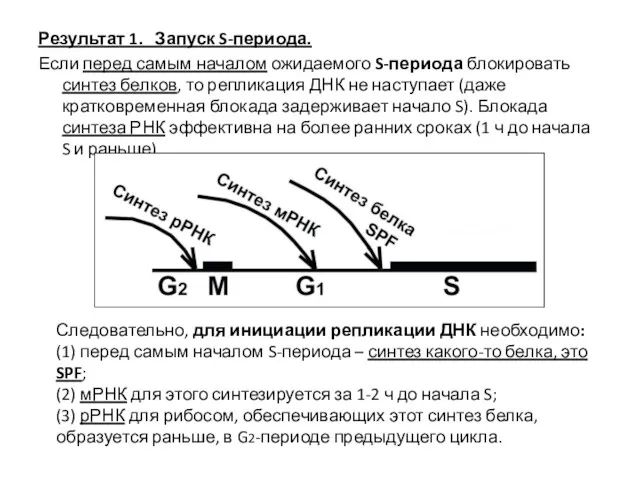
- 10. Результат 1. Запуск S-периода. Если перед самым началом ожидаемого S-периода блокировать синтез белков, то репликация ДНК
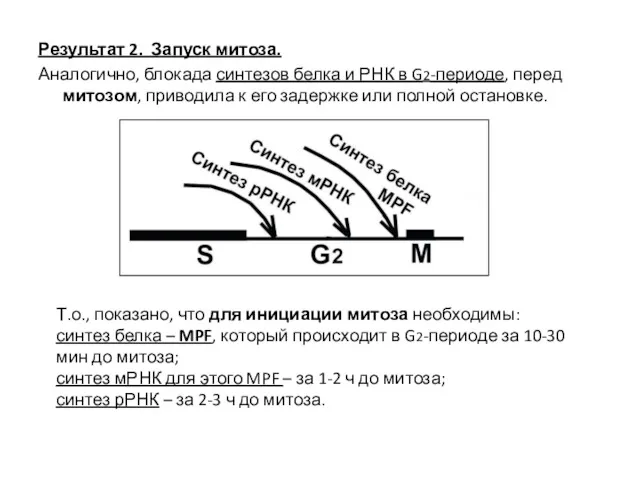
- 11. Результат 2. Запуск митоза. Аналогично, блокада синтезов белка и РНК в G2-периоде, перед митозом, приводила к
- 12. Т.о., ингибиторный анализ показал, что: 1) индукторы SPF и MPF вырабатываются самой клеткой, это собственные, внутриклеточные
- 13. 2.3. Генетические доказательства генной регуляции цикла. Генное семейство Сdc Лучшее доказательство генной регуляции того или иного
- 14. В делении дрожжей различимы 3 относительно независимых цикла (как и у других эукариот), и каждый из
- 15. Клетки млекопитающих. В различных клеточных культурах выявлены циклоспецифические мутации, гомологичные cdc-мутациям дрожжей. При нормальной температуре (37°)
- 16. 3. Гены компетентности к циклу (раннего ответа) Гены myc, fos, myb и др. Это ключевые гены
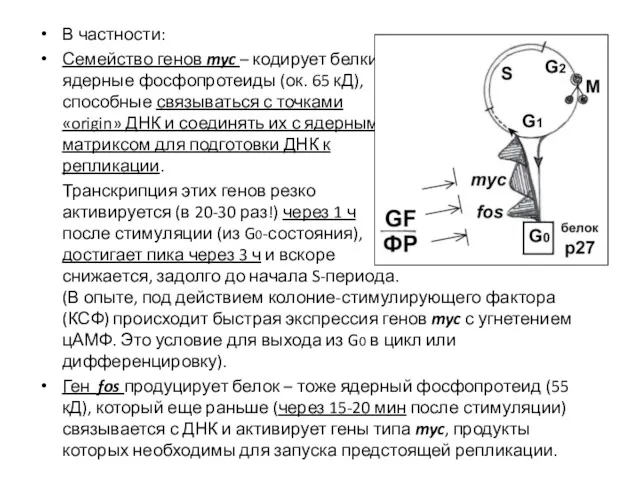
- 17. В частности: Семейство генов myc – кодирует белки, ядерные фосфопротеиды (ок. 65 кД), способные связываться с
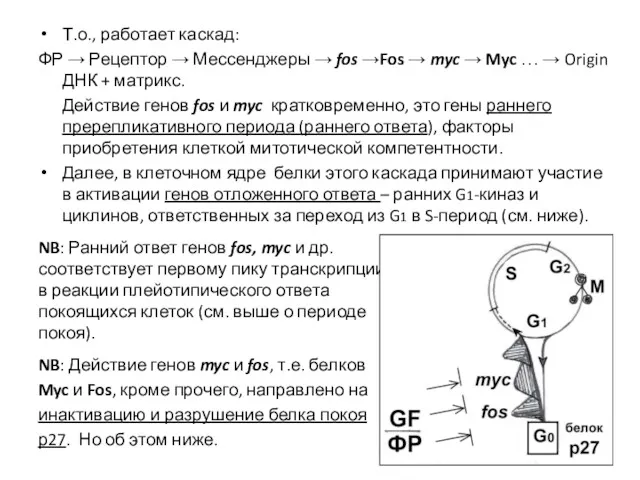
- 18. Т.о., работает каскад: ФР → Рецептор → Мессенджеры → fos →Fos → myc → Myc …
- 19. 4. Гены прогрессии цикла. Циклины и циклинзависимые киназы Для других генов – регуляторов митотического цикла установлено
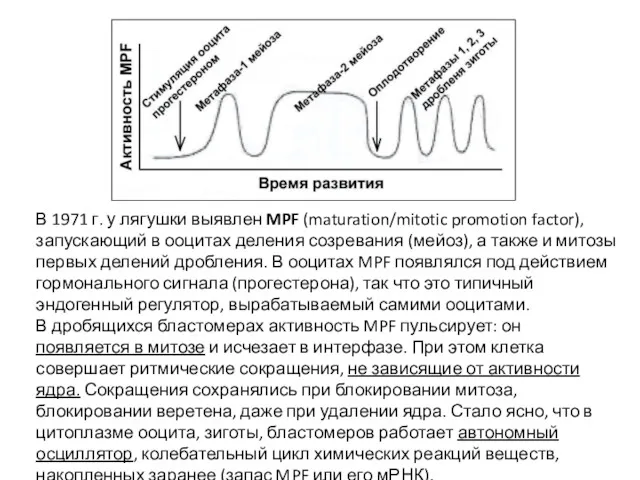
- 20. В 1971 г. у лягушки выявлен MPF (maturation/mitotic promotion factor), запускающий в ооцитах деления созревания (мейоз),
- 21. Так сформировались два конкурирующих (казалось – взаимоисключающих) представления о механизмах регуляции цикла: Механизм генного «домино», представляющий
- 22. В 1980-х годах была установлена идентичность белков, инициирующих митоз в этих двух моделях: белка-продукта гена cdc-2,
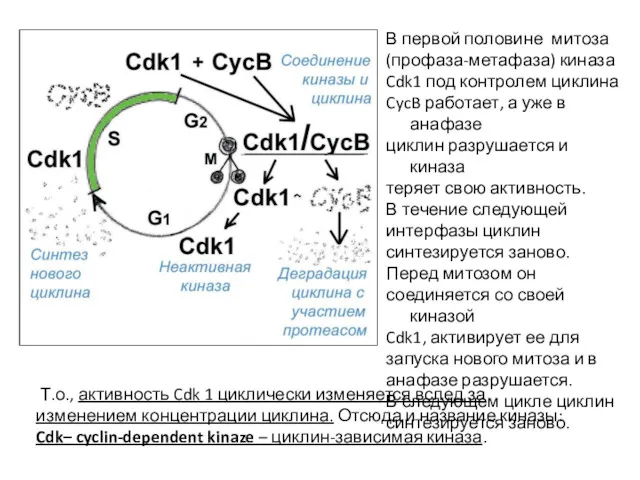
- 23. В первой половине митоза (профаза-метафаза) киназа Cdk1 под контролем циклина CycB работает, а уже в анафазе
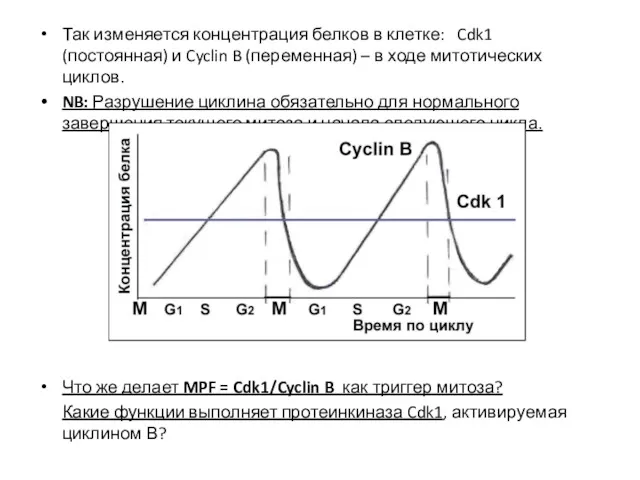
- 24. Так изменяется концентрация белков в клетке: Cdk1 (постоянная) и Cyclin B (переменная) – в ходе митотических
- 25. Функции (активности) протеинкиназы Cdk1 в организации митоза: 1) фосфорилирует ламины ядерной оболочки и, тем самым, инициирует
- 26. Но, как и следовало ожидать, вскоре были открыты и другие осцилляторы, стимулирующие переходы G1/S (SPF), S/G2
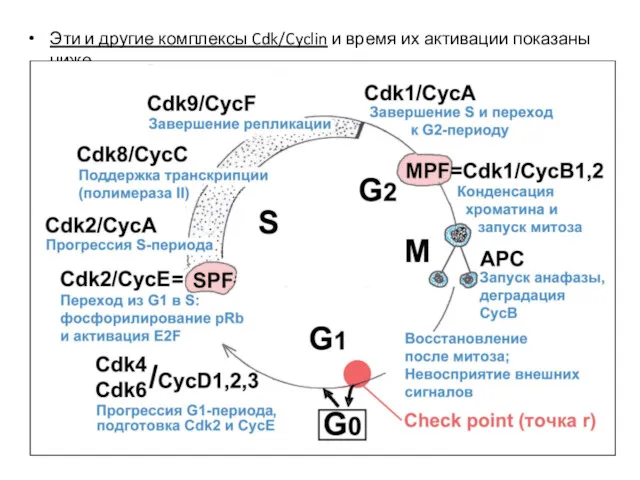
- 27. Эти и другие комплексы Cdk/Cyclin и время их активации показаны ниже.
- 28. NB: В раннем эмбриогенезе (дробление зиготы, бластула) работают в чистом виде только 2 осциллятора: Cdk1/CycB (MPF)
- 29. 5. Система контрольных точек и ингибиторы митотического цикла Т.о., события митотического цикла представляют взаимосвязанную цепь шагов:
- 30. Гипотеза Хартвела: В клетке существует контрольный механизм – система надзора за митотическим циклом. Должны быть специальные
- 31. Наиболее важен и сложен р53-р21/Waf1-pRb–зависимый путь (опухолевой супрессии), который останавливает клетки на границе G2/M и G1/S
- 32. NB: Транскрипционный фактор р53 участвует также в запуске синтезов мРНК (и, соответственно, белков), направляющих клетку в
- 33. И еще одно важное NB: Все гены белков-стимуляторов и промоторов цикла (гены компетентности, гены cdc, производящие
- 34. 6. Факторы роста Сколько бы генов не было задействовано в обеспечении цикла данной клетки, их регуляция
- 35. Действие ФР в чистом виде можно изучать на клеточных культурах in vitro, так как в организме
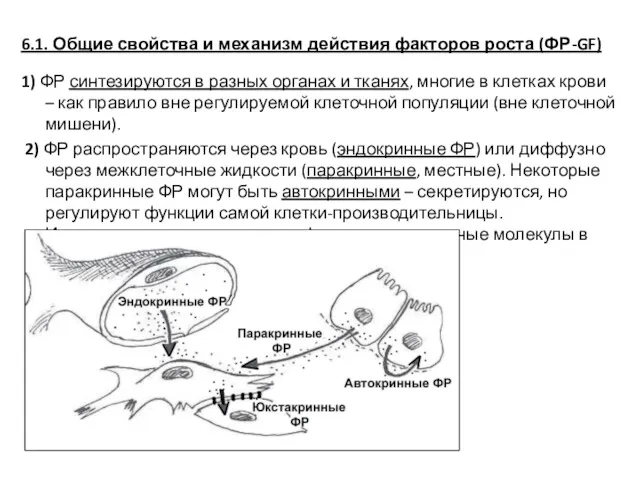
- 36. 6.1. Общие свойства и механизм действия факторов роста (ФР-GF) 1) ФР синтезируются в разных органах и
- 37. 3) ФР присутствуют в ткани и работают в очень малых концентрациях – 10-9 – 10-11 М.
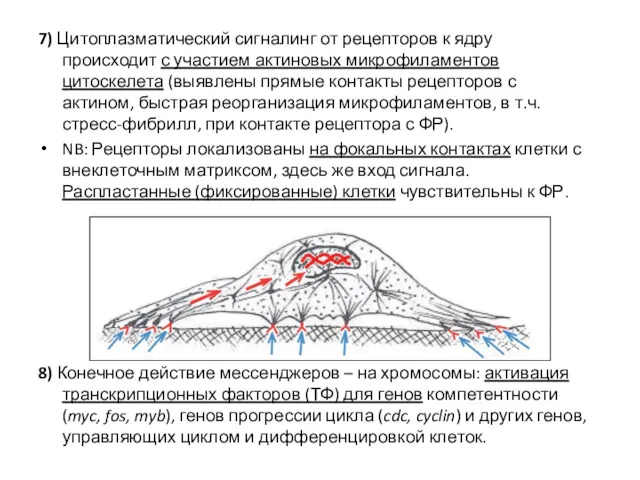
- 38. 7) Цитоплазматический сигналинг от рецепторов к ядру происходит с участием актиновых микрофиламентов цитоскелета (выявлены прямые контакты
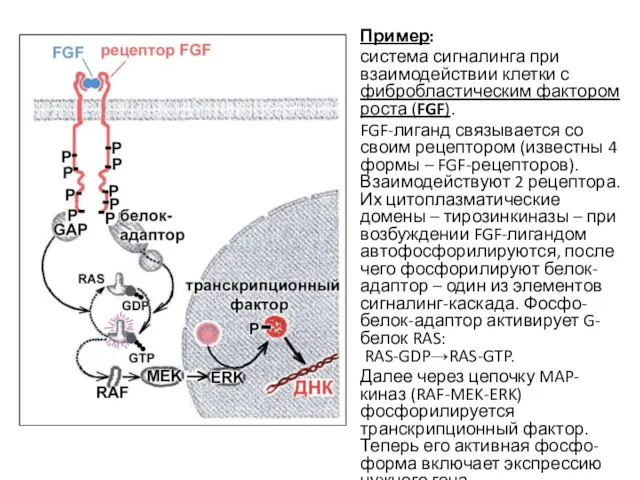
- 39. Пример: система сигналинга при взаимодействии клетки с фибробластическим фактором роста (FGF). FGF-лиганд связывается со своим рецептором
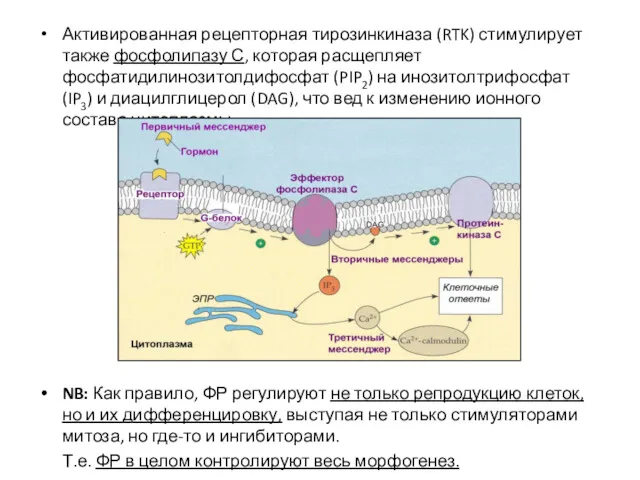
- 40. Активированная рецепторная тирозинкиназа (RTK) стимулирует также фосфолипазу С, которая расщепляет фосфатидилинозитолдифосфат (PIP2) на инозитолтрифосфат (IP3) и
- 41. 6.2. Разнообразие факторов роста Известны десятки семейств ФР (GF). Рассмотрим некоторые, наиболее изученные у млекопитающих животных
- 42. 2. PDGF – Plate Dependent Growth Factor; = ТФР – Тромбоцитарные ФР. Разновидности из 2 цепей
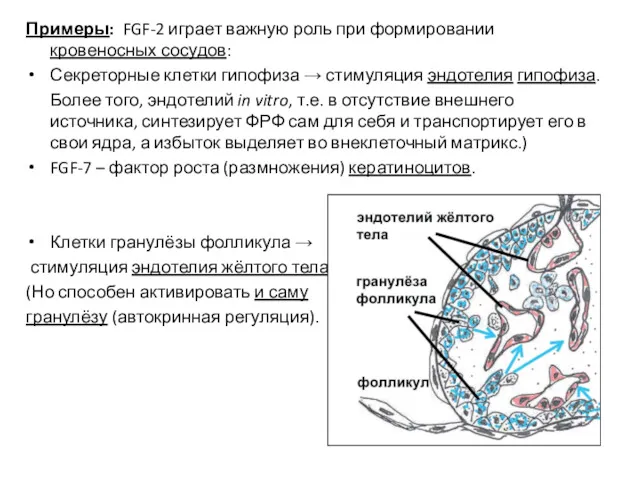
- 43. Примеры: FGF-2 играет важную роль при формировании кровеносных сосудов: Секреторные клетки гипофиза → стимуляция эндотелия гипофиза.
- 44. 4. SDGF-1 – Spleen Dependent Growth Factor; = ФР из селезенки. Гомологичен с ФРФ. Источник: клетки
- 45. 7. Гемопоэтические ФР. Эритропоэтин. Источник: юкстагломерулярные клетки почек. Мишень: эритробласты (эритропоэз). Гранулоцитопоэтин. Источник: строма костного мозга.
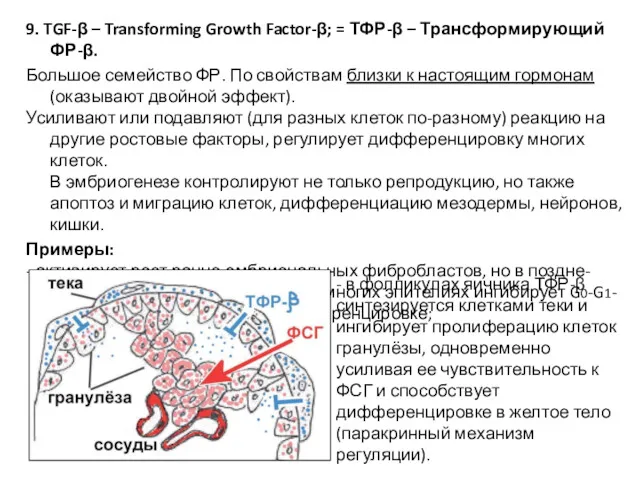
- 46. 9. TGF-β – Transforming Growth Factor-β; = ТФР-β – Трансформирующий ФР-β. Большое семейство ФР. По свойствам
- 47. 10. SDGF – Shwannomous Dependent Growth Factor – ФР из шванномы. Еще один пример гормоноподобного (двойственного)
- 48. 6.3. Факторы роста препятствуют старению и гибели клеток Для многих клеток в культуре установлен «лимит Хэйфлика»
- 49. Культура эпидермиса ребенка на обычной среде с сывороткой дает 50 циклов удвоения, но в присутствии избытка
- 50. Т.о., с факторами роста могут быть связаны причины старения тканей, органов и организмов (наряду с другими):
- 51. 7. Гормоны и пролиферация клеток В отличие от факторов роста настоящие гормоны – продукты эндокринных желез.
- 52. 7.1. Моноамины Моноаминовые гормоны образуются из аминокислот путем небольшой перестройки. Это – неспецифические регуляторы роста и
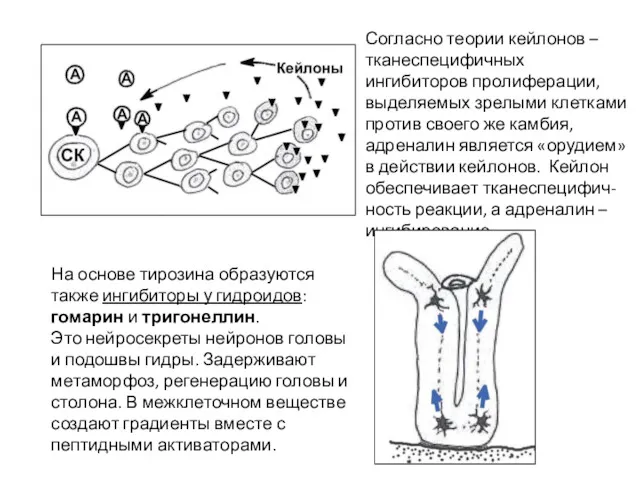
- 53. Согласно теории кейлонов – тканеспецифичных ингибиторов пролиферации, выделяемых зрелыми клетками против своего же камбия, адреналин является
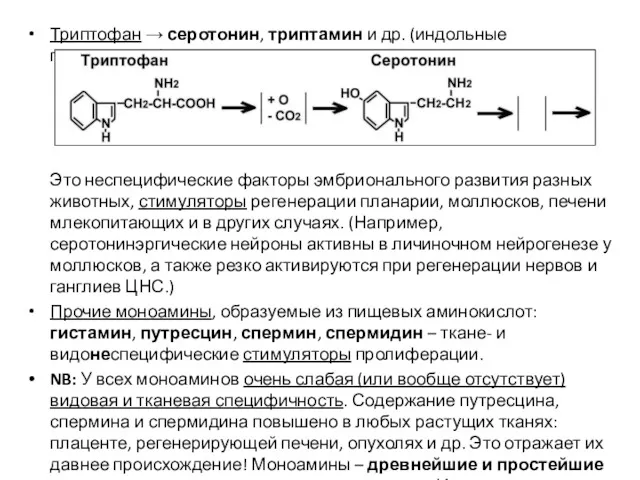
- 54. Триптофан → серотонин, триптамин и др. (индольные производные). Это неспецифические факторы эмбрионального развития разных животных, стимуляторы
- 55. Образование более сложных гормонов шло посредством реакций поликонденсации – в направлении стероидов и полипептидов. 7.2. Стероидные
- 56. Кортикостероиды – гормоны коры надпочечников позвоночных. Функционально различаются: глюкокортикоиды (кортикостерон, кортизон, гидрокортизон), минералкортикоиды (альдостерон и др.).
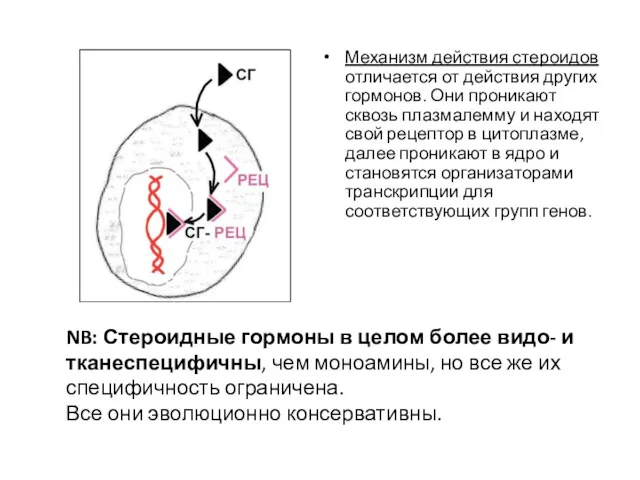
- 57. Механизм действия стероидов отличается от действия других гормонов. Они проникают сквозь плазмалемму и находят свой рецептор
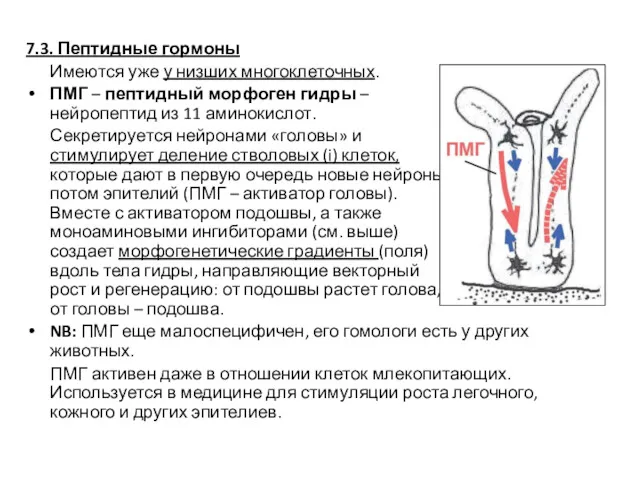
- 58. 7.3. Пептидные гормоны Имеются уже у низших многоклеточных. ПМГ – пептидный морфоген гидры – нейропептид из
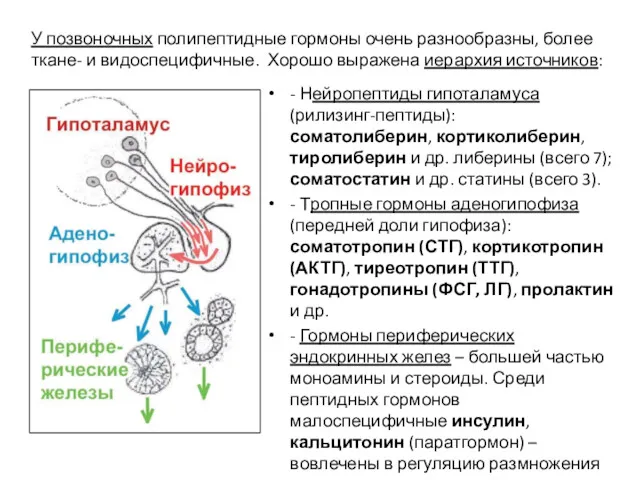
- 59. - Нейропептиды гипоталамуса (рилизинг-пептиды): соматолиберин, кортиколиберин, тиролиберин и др. либерины (всего 7); соматостатин и др. статины
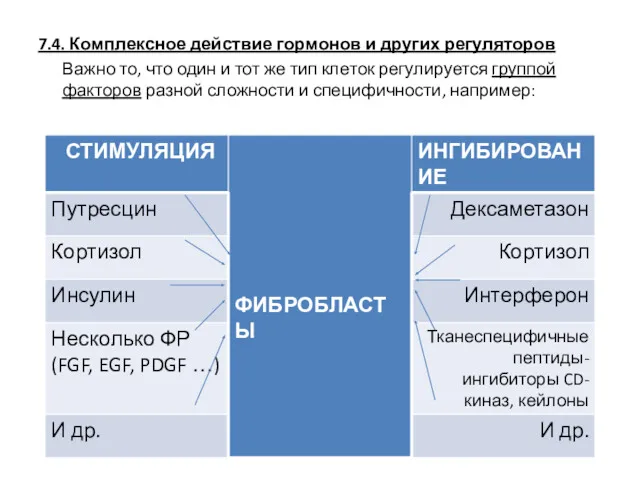
- 60. 7.4. Комплексное действие гормонов и других регуляторов Важно то, что один и тот же тип клеток
- 61. При этом сами регуляторы встроены в сложные иерархические цепи (сети) управления с возможностью изменения уровня активности.
- 62. Таким образом, гормоны включены в кооперативное действие всех регуляторов пролиферации и дифференцировки, в комбинации с несколькими
- 63. Заключение В целом получается такая система регуляции клеточного размножения. 1) Клетка генетически запрограммирована на пролиферацию. Синтез
- 64. 3) У одноклеточных переход через точку r в новый цикл регулируется наличием или отсутствием пищи, феромонов
- 66. Скачать презентацию







































 Химический состав клеток. Углеводы. Липиды
Химический состав клеток. Углеводы. Липиды Перелетные птицы
Перелетные птицы Становлення еволюційних поглядів
Становлення еволюційних поглядів Организм как целостная система
Организм как целостная система Положение человека в системе животного мира
Положение человека в системе животного мира Биолюминесценция
Биолюминесценция Элементы и подсистемы
Элементы и подсистемы Тип Chordata. Хордовые
Тип Chordata. Хордовые Вирусология. Құрылысын, көбеюін, биохимиясын
Вирусология. Құрылысын, көбеюін, биохимиясын Марикультура. Поняття про марикультуру. Види вирощування. Мануфактура в найбільш розвинених країнах. Перспективи розвитку
Марикультура. Поняття про марикультуру. Види вирощування. Мануфактура в найбільш розвинених країнах. Перспективи розвитку Биосфера,ее структура
Биосфера,ее структура Физиология растений. Механизмы поступления воды в растительную клетку. Дальний транспорт воды в растении
Физиология растений. Механизмы поступления воды в растительную клетку. Дальний транспорт воды в растении Окружающая среда
Окружающая среда Свойства простых и сложных белков
Свойства простых и сложных белков Тварини-будівельники
Тварини-будівельники Адаптация - приспособления организмов к среде обитания
Адаптация - приспособления организмов к среде обитания Особенности кровоснабжения головы и шеи
Особенности кровоснабжения головы и шеи урок в 6 классе Растение-целостный организм
урок в 6 классе Растение-целостный организм Отделы царства растений. Особенности
Отделы царства растений. Особенности Факторы, влияющие на продолжительность жизни человека
Факторы, влияющие на продолжительность жизни человека Отдел моховидные – Bryophyta
Отдел моховидные – Bryophyta Відчуття та сприймання
Відчуття та сприймання Контрольная работа на тему: Физиологические особенности ребенка грудного возраста
Контрольная работа на тему: Физиологические особенности ребенка грудного возраста Эндокринная система
Эндокринная система Анатомическое строение стебля
Анатомическое строение стебля Природа Антарктиды
Природа Антарктиды Клетка – элементарная единица жизни на земле
Клетка – элементарная единица жизни на земле Биохимия белковых гормонов
Биохимия белковых гормонов