Содержание
- 2. 1. Organizace praktik z Buněčné a molekulární biologie 2. Obecné principy specifické detekce molekul 3. Mikroskopické
- 3. 1) ORGANIZACE PRAKTIK Z BMB • 2 části (2 x 4 vyučovací hodiny) • Pro udělení
- 4. 2) OBECNÉ PRINCIPY SPECIFICKÉ DETEKCE MOLEKUL 2.1. Jak najít to, co nás zajímá, mezi všemi ostatními
- 5. 2.1 ZAJIŠTĚNÍ SPECIFICKÉ DETEKCE Molekula ve vzorku je rozeznána na základě známé a specifické interakce s
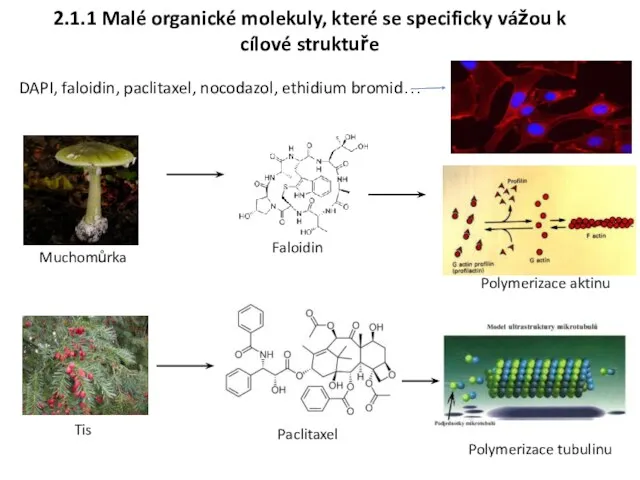
- 6. 2.1.1 Malé organické molekuly, které se specificky vážou k cílové struktuře Muchomůrka Faloidin Polymerizace aktinu Polymerizace
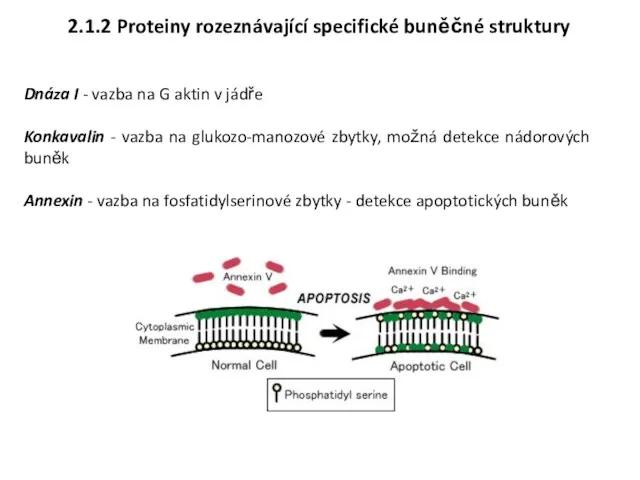
- 7. 2.1.2 Proteiny rozeznávající specifické buněčné struktury Dnáza I - vazba na G aktin v jádře Konkavalin
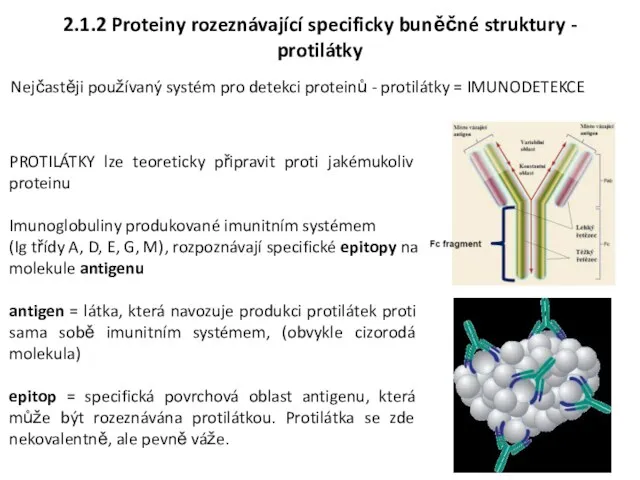
- 8. PROTILÁTKY lze teoreticky připravit proti jakémukoliv proteinu Imunoglobuliny produkované imunitním systémem (Ig třídy A, D, E,
- 9. 2.2 MOŽNOSTI DETEKCE SIGNÁLU Detekující molekulu většinou není možné přímo pozorovat (výjimka např. DAPI). Proto musí
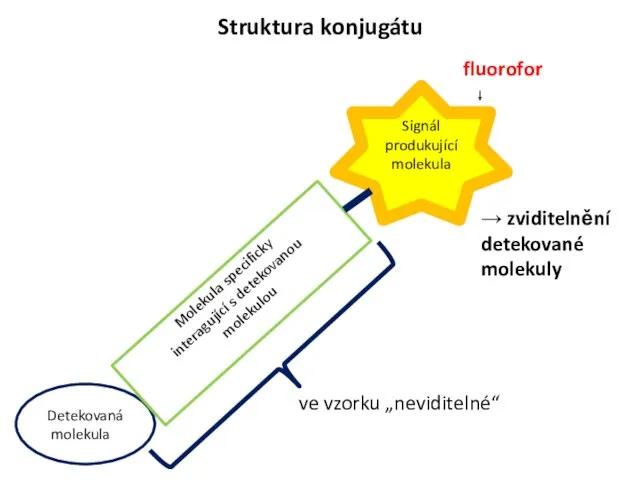
- 10. Struktura konjugátu Detekovaná molekula Molekula specificky interagující s detekovanou molekulou ve vzorku „neviditelné“ → zviditelnění detekované
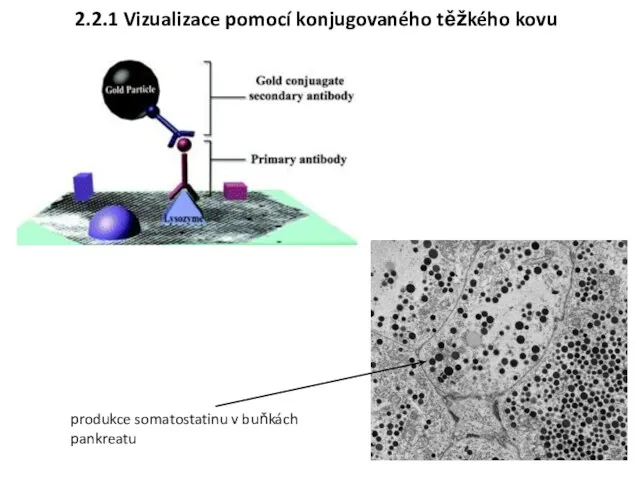
- 11. 2.2.1 Vizualizace pomocí konjugovaného těžkého kovu produkce somatostatinu v buňkách pankreatu
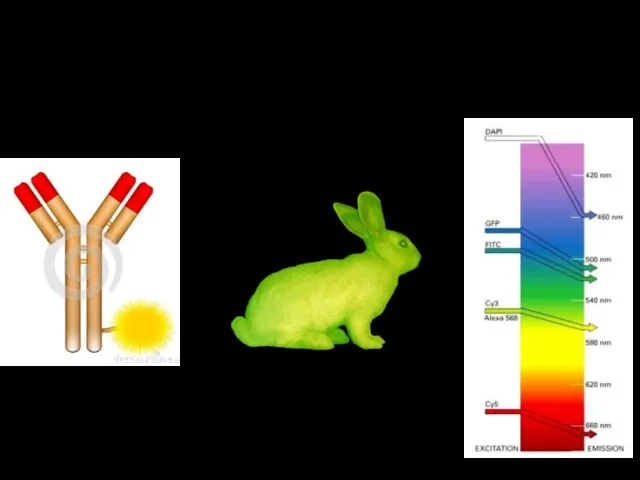
- 12. fluorofor = molekula schopná absorbovat záření určité vlnové délky (=být excitována) a vyzářit (=emitovat) záření jiné
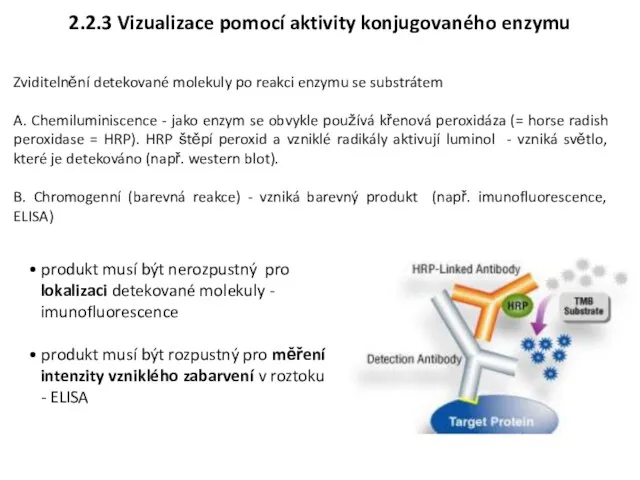
- 13. Zviditelnění detekované molekuly po reakci enzymu se substrátem A. Chemiluminiscence - jako enzym se obvykle používá
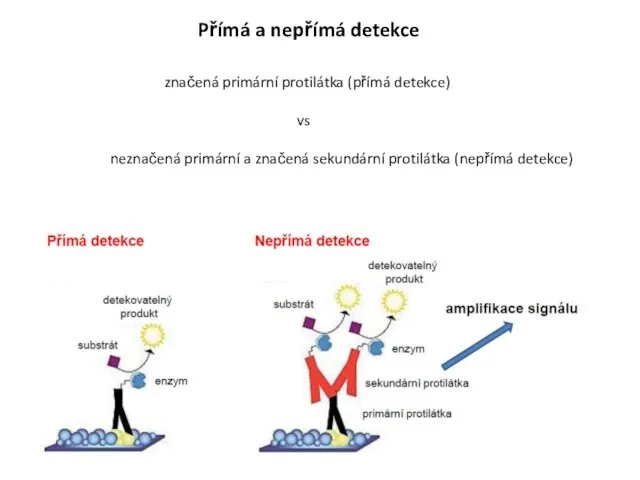
- 14. značená primární protilátka (přímá detekce) vs neznačená primární a značená sekundární protilátka (nepřímá detekce) Přímá a
- 15. 3) MIKROSKOPICKÉ TECHNIKY 3.1 Imunohistochemie 3.2 Elektronová mikroskopie 3.3 Fluorescenční mikroskopie
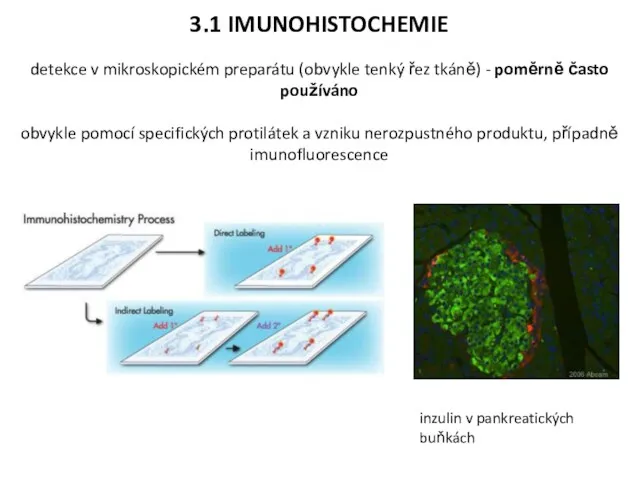
- 16. 3.1 IMUNOHISTOCHEMIE detekce v mikroskopickém preparátu (obvykle tenký řez tkáně) - poměrně často používáno obvykle pomocí
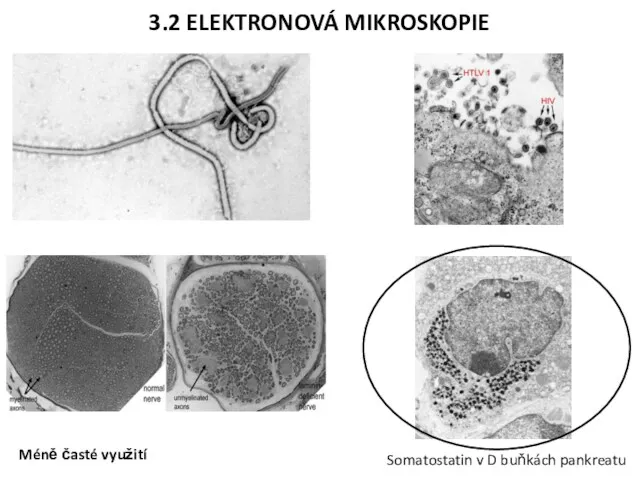
- 17. 3.2 ELEKTRONOVÁ MIKROSKOPIE Somatostatin v D buňkách pankreatu Méně časté využití
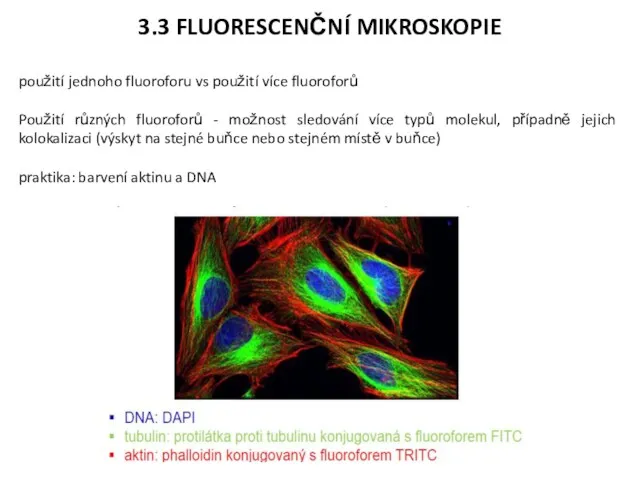
- 18. 3.3 FLUORESCENČNÍ MIKROSKOPIE použití jednoho fluoroforu vs použití více fluoroforů Použití různých fluoroforů - možnost sledování
- 19. 4) STANOVENÍ KONCENTRACE PROTEINŮ V ROZTOKU založené na spektrofotometrickém stanovení (měření absorbance) 4.1 Stanovení z UV
- 20. 4.1. Stanovení koncentrace z absorbance UV záření Proteiny přirozeně absorbují v UV spektru (260 ̶ 280
- 21. Detekční činidlo obsahuje BCA (bicinchoninic acid). Kolorimetrická reakce založena na interakci činidla přímo s peptidovou vazbou
- 22. 4.3. Metoda dle Bradforda Princip: kolorimetrická reakce po smíchání Bradfordova (Bradfordové) činidla s roztokem obsahujícím proteiny
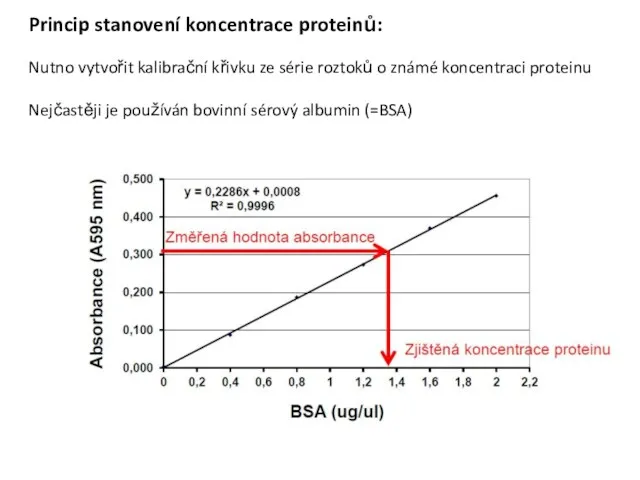
- 23. Princip stanovení koncentrace proteinů: Nutno vytvořit kalibrační křivku ze série roztoků o známé koncentraci proteinu Nejčastěji
- 24. 5) STANOVENÍ HLADINY PROTEINŮ Metody založené na imunodetekci: ELISA průtoková cytometrie SDS-PAGE + Western blot =
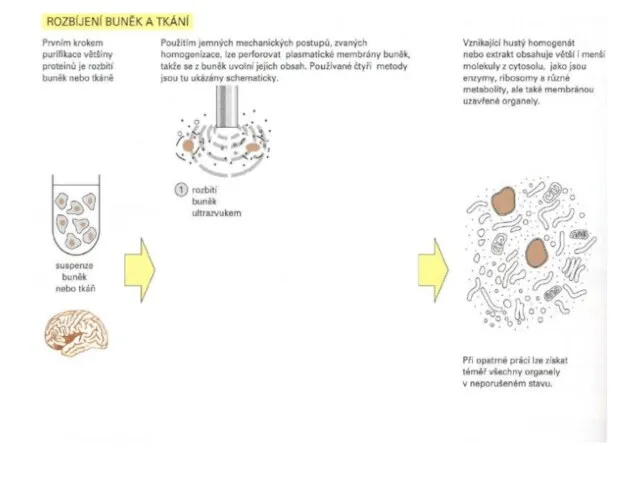
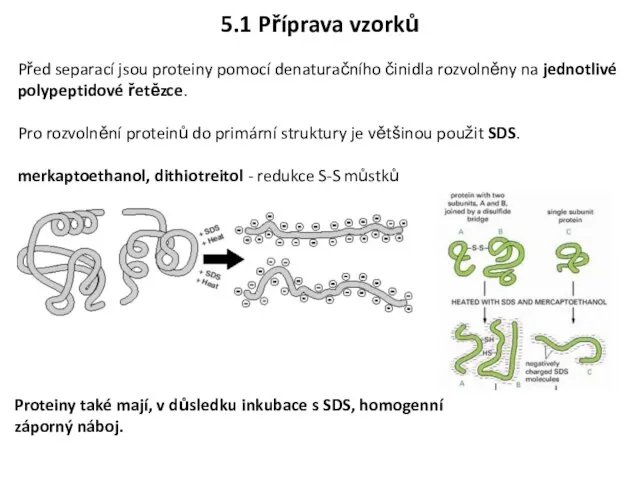
- 26. 5.1 Příprava vzorků Před separací jsou proteiny pomocí denaturačního činidla rozvolněny na jednotlivé polypeptidové řetězce. Pro
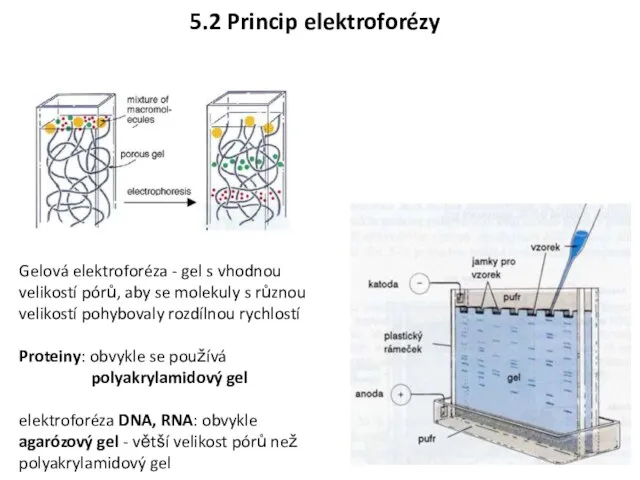
- 27. Gelová elektroforéza - gel s vhodnou velikostí pórů, aby se molekuly s různou velikostí pohybovaly rozdílnou
- 28. Separace proteinů probíhá víceméně pouze podle molekulové hmotnosti. Záporně nabité proteiny taženy ke kladné elektrodě. Čím
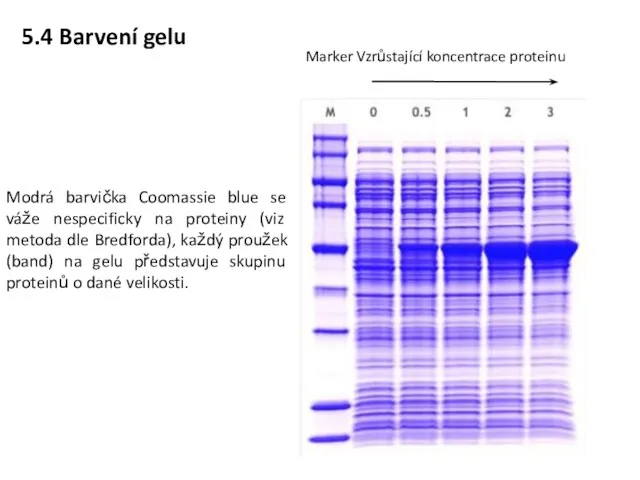
- 29. 5.4 Barvení gelu Modrá barvička Coomassie blue se váže nespecificky na proteiny (viz metoda dle Bredforda),
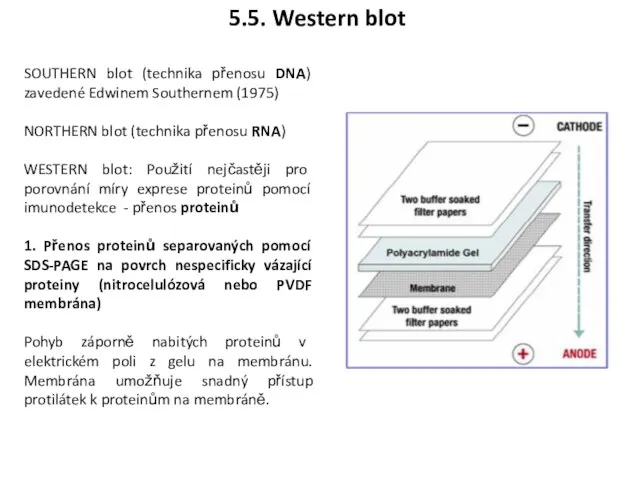
- 30. SOUTHERN blot (technika přenosu DNA) zavedené Edwinem Southernem (1975) NORTHERN blot (technika přenosu RNA) WESTERN blot:
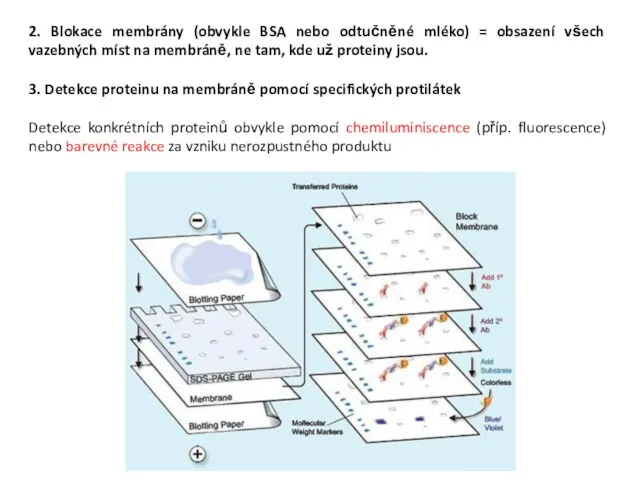
- 31. 2. Blokace membrány (obvykle BSA nebo odtučněné mléko) = obsazení všech vazebných míst na membráně, ne
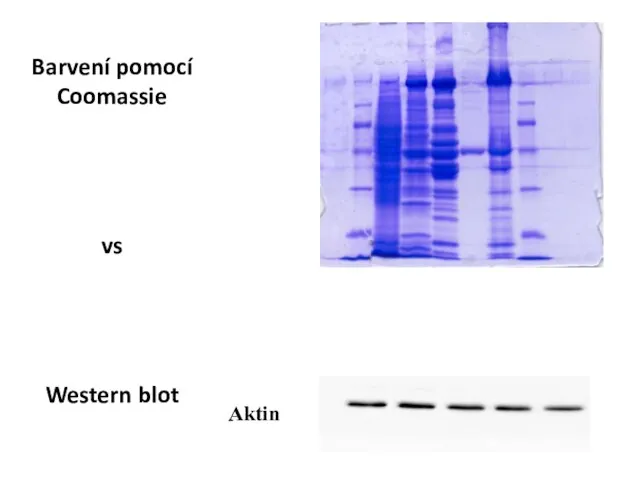
- 32. Barvení pomocí Coomassie vs Western blot
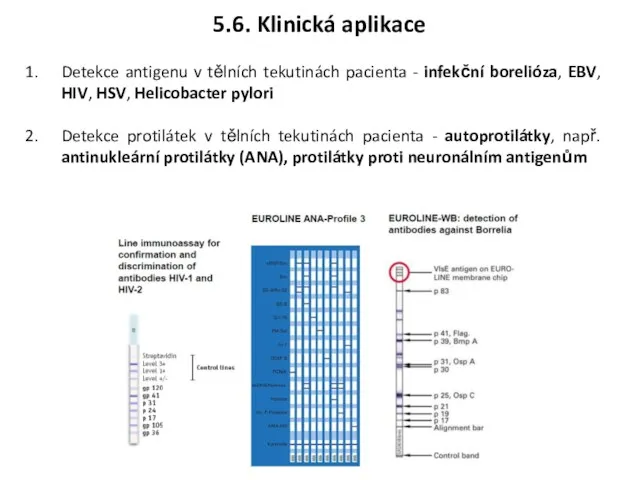
- 33. Detekce antigenu v tělních tekutinách pacienta - infekční borelióza, EBV, HIV, HSV, Helicobacter pylori Detekce protilátek
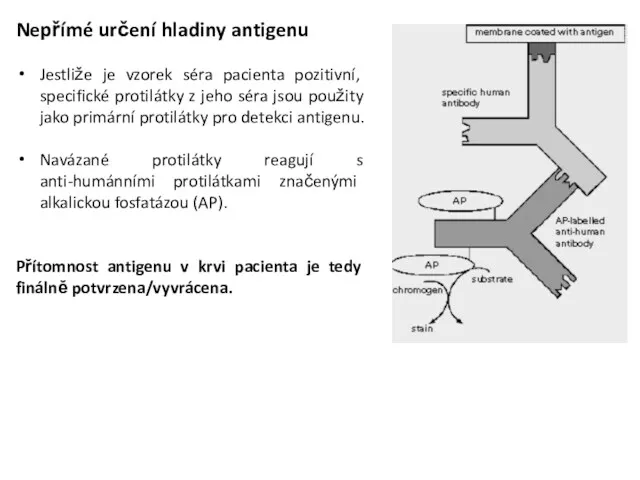
- 34. Nepřímé určení hladiny antigenu Jestliže je vzorek séra pacienta pozitivní, specifické protilátky z jeho séra jsou
- 36. Скачать презентацию











 Распространенные методы окраски цитологических препаратов
Распространенные методы окраски цитологических препаратов Косметичні засоби по догляду за шкірою м’якої консистенції
Косметичні засоби по догляду за шкірою м’якої консистенції Цветок – орган семенного размножения
Цветок – орган семенного размножения Роль гормонов в обмене веществ, росте и развитии организма
Роль гормонов в обмене веществ, росте и развитии организма Красоты Урала
Красоты Урала Строение клетки
Строение клетки Биологическая и хозяйственная эффективность комплексных микроудобрений и биостимуляторов компании Leili на развитие яблони
Биологическая и хозяйственная эффективность комплексных микроудобрений и биостимуляторов компании Leili на развитие яблони Биология клетки в культуре. Оборудование и среды для работы с клеточными культурами
Биология клетки в культуре. Оборудование и среды для работы с клеточными культурами Семейство растений маревые
Семейство растений маревые Цитология как наука
Цитология как наука Моё Приморье – мой край родной
Моё Приморье – мой край родной Клеточные рецептор определение понятия. Характеристики
Клеточные рецептор определение понятия. Характеристики Живые организмы как среда жизни
Живые организмы как среда жизни Основные генетические и морфофизиологические характеристики популяции
Основные генетические и морфофизиологические характеристики популяции Конспект урока и презентация по темеЖизнь организмов в морях и океанах
Конспект урока и презентация по темеЖизнь организмов в морях и океанах Насекомые. Вредители культурных растений
Насекомые. Вредители культурных растений Роль комнатных растений в жизни человека
Роль комнатных растений в жизни человека Медицинская арахноэнтомология
Медицинская арахноэнтомология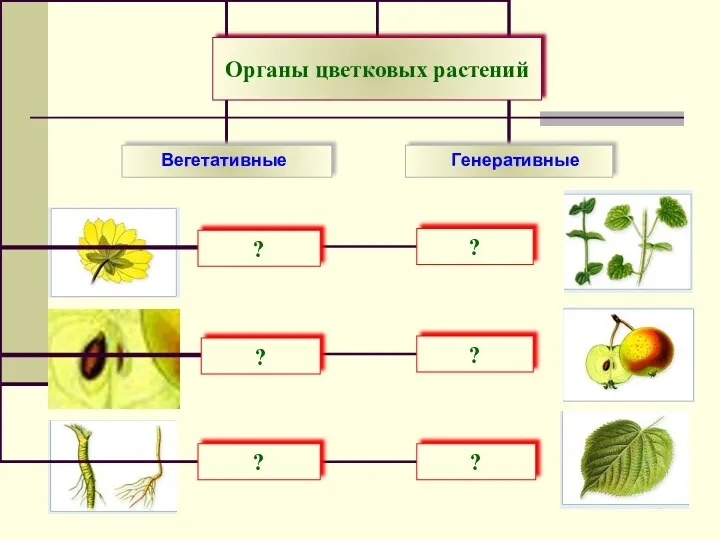 Органы цветковых растений. Вегетативные. Генеративные
Органы цветковых растений. Вегетативные. Генеративные Животные Красной Книги России - 2
Животные Красной Книги России - 2 Білки та їх роль в забезпеченні біологічної специфічності
Білки та їх роль в забезпеченні біологічної специфічності Bio chemical method. PCR and DNA diagonstics
Bio chemical method. PCR and DNA diagonstics Проект. Почему желтеют и опадают листья
Проект. Почему желтеют и опадают листья Жақ-бет аймағының лимфа жүйесі
Жақ-бет аймағының лимфа жүйесі Семейство лилейные
Семейство лилейные Lenguaje Somato emocional de nuestro Cuerpo
Lenguaje Somato emocional de nuestro Cuerpo Психологічні аспекти дресирування
Психологічні аспекти дресирування Эндокринная система рыб. Лекция 3
Эндокринная система рыб. Лекция 3