Содержание
- 2. Роль микроорганизмов в генной и белковой инженерии
- 3. Генная инженерия - совокупность методов молекулярной генетики, направленных на искусственное создание различных сочетаний генов. Цели генной
- 4. Основные операции генной инженерии : Выделение из клеток ДНК, содержащей нужный ген. Разрезание ДНК на мелкие
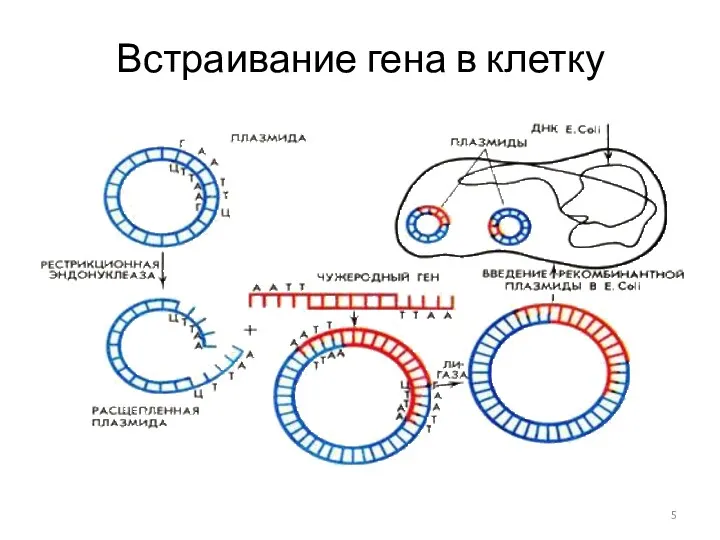
- 5. Встраивание гена в клетку 5
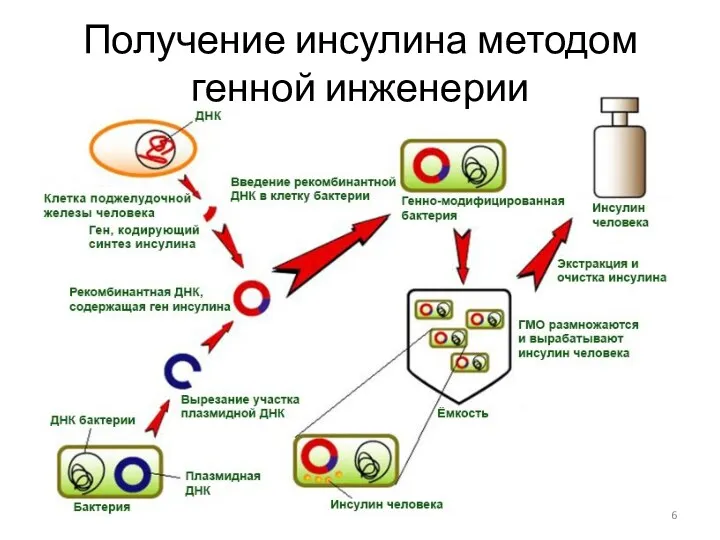
- 6. Получение инсулина методом генной инженерии
- 7. Вектор – генно-инженерная конструкция, используемая для переноса генетического материала в клетку и способная к саморепликации. Векторы
- 8. Длительное существование в популяции клеток-хозяев; Наличие генетических или биохимических маркеров, позволяющих обнаруживать присутствие вектора в клетках;
- 9. Основные этапы конструирования векторов Наработка необходимого количества генетического материала (хромосомной или плазмидной ДНК с помощью ПЦР);
- 10. Плазмидные векторы Плазмида – внехромосомная кольцевая ДНК, которая существует в автономном состоянии в цитоплазме. Ограничения на
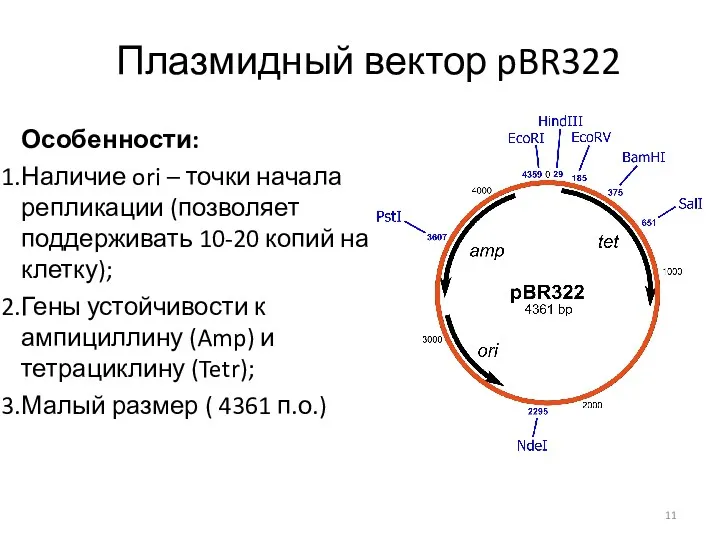
- 11. Плазмидный вектор pBR322 Особенности: Наличие ori – точки начала репликации (позволяет поддерживать 10-20 копий на клетку);
- 12. Методы первичного контроля вставки ДНК в плазмидный вектор Обработка щелочной фосфатазой (липкие концы плазмиды без вставки
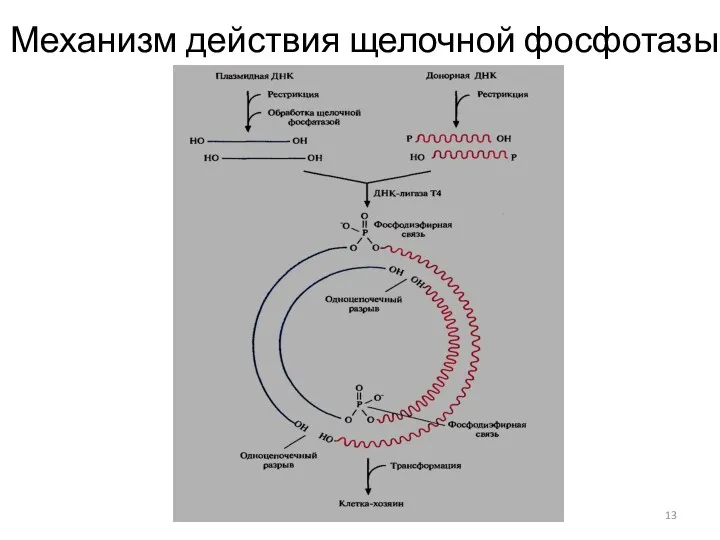
- 13. Механизм действия щелочной фосфотазы
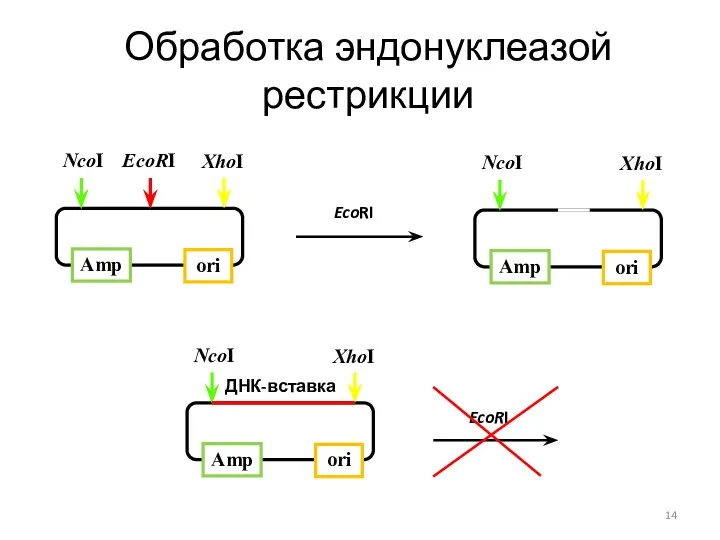
- 14. Обработка эндонуклеазой рестрикции
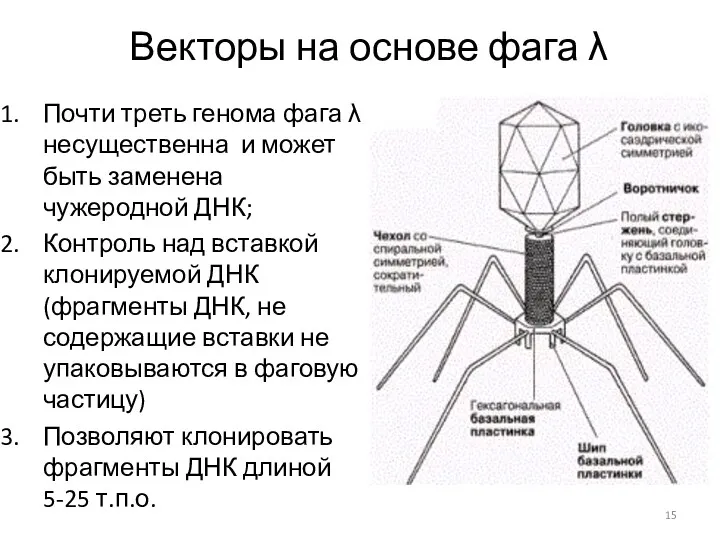
- 15. Векторы на основе фага λ Почти треть генома фага λ несущественна и может быть заменена чужеродной
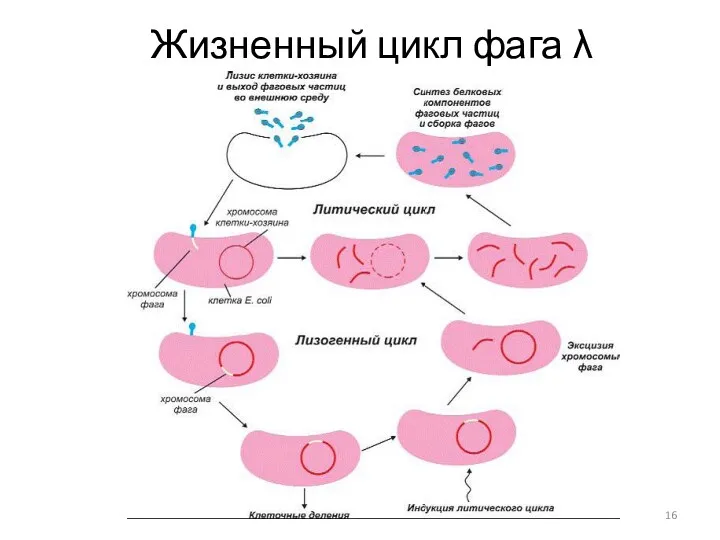
- 16. Жизненный цикл фага λ
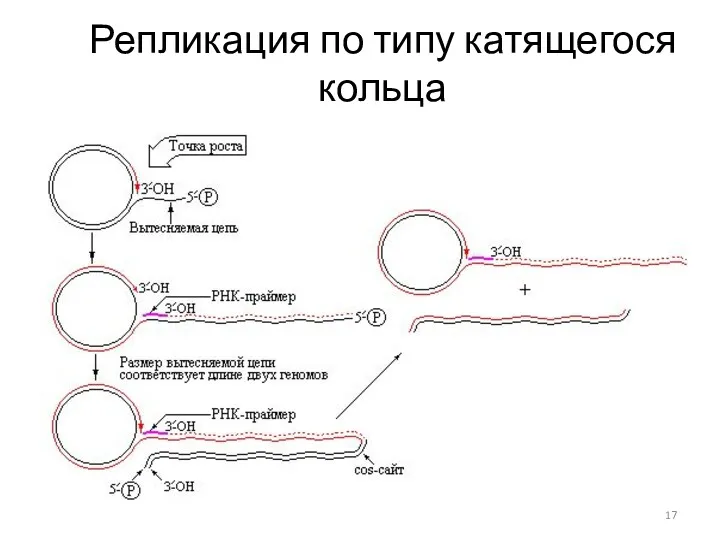
- 17. Репликация по типу катящегося кольца
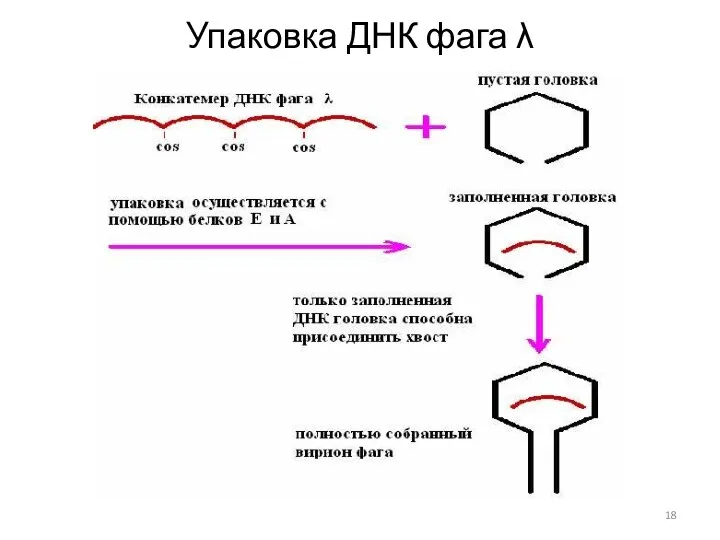
- 18. Упаковка ДНК фага λ
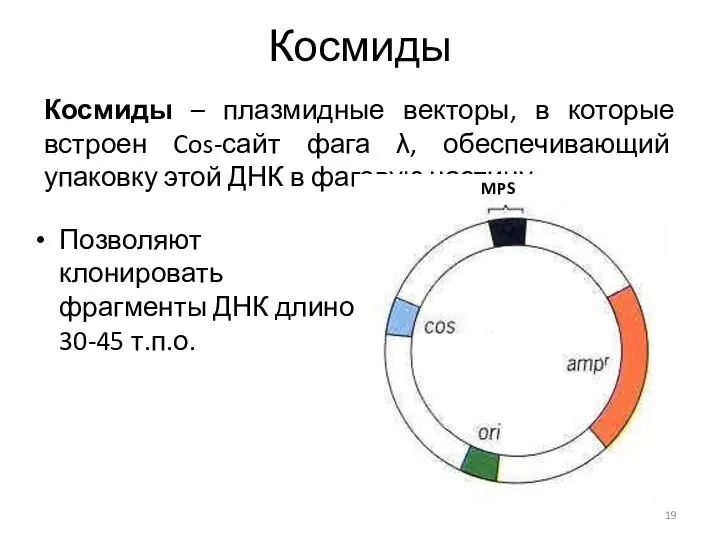
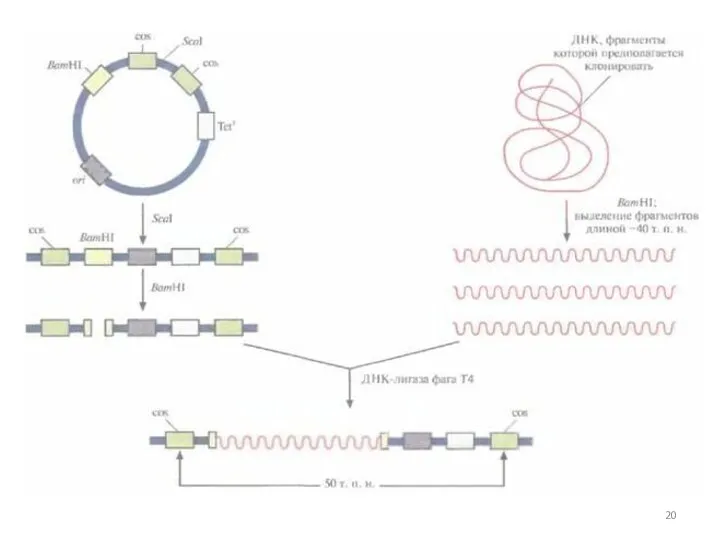
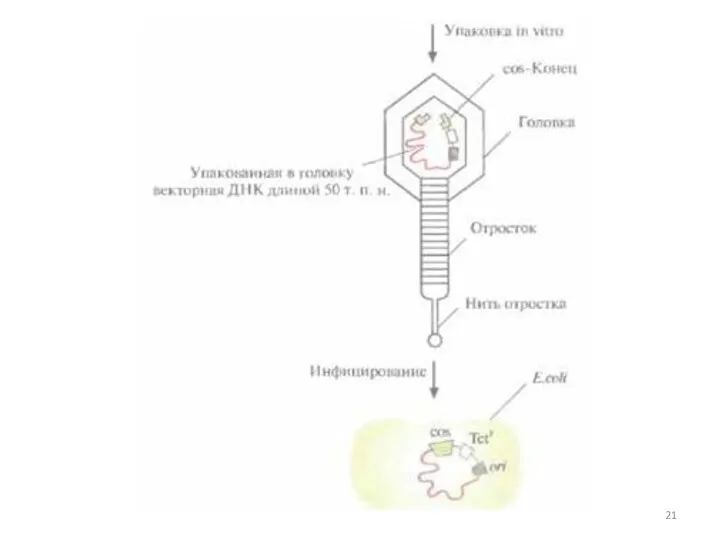
- 19. Космиды Позволяют клонировать фрагменты ДНК длиной 30-45 т.п.о. Космиды – плазмидные векторы, в которые встроен Cos-сайт
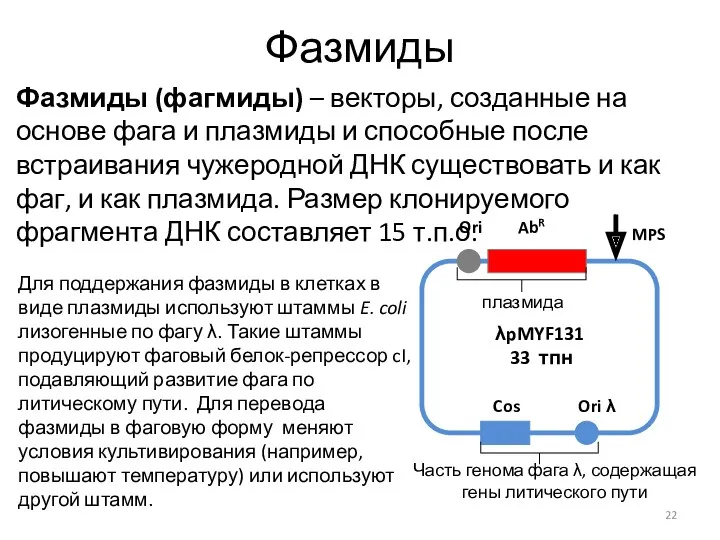
- 22. Фазмиды Фазмиды (фагмиды) – векторы, созданные на основе фага и плазмиды и способные после встраивания чужеродной
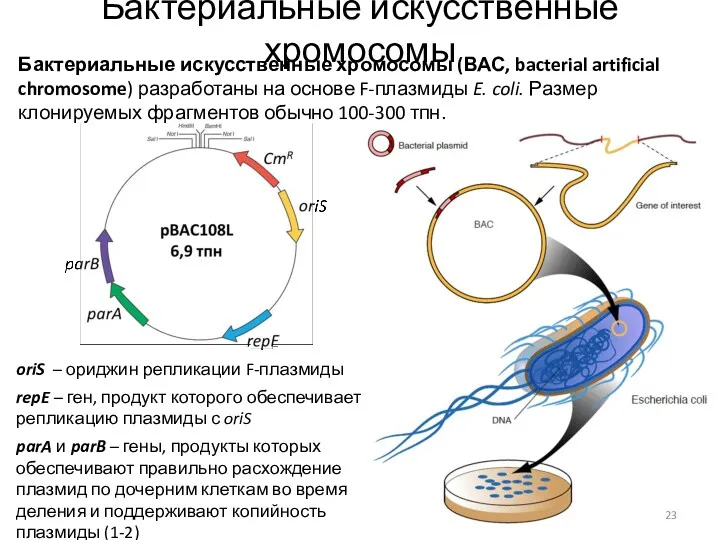
- 23. Бактериальные искусственные хромосомы Бактериальные искусственные хромосомы (ВАС, bacterial artificial chromosome) разработаны на основе F-плазмиды E. coli.
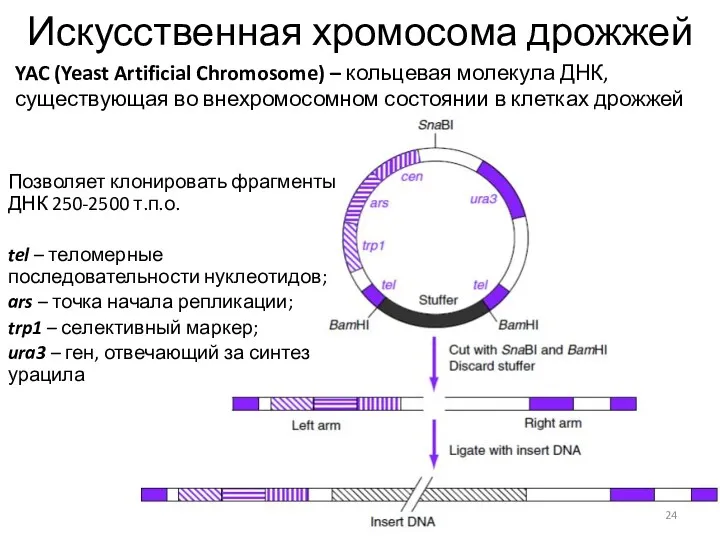
- 24. Искусственная хромосома дрожжей Позволяет клонировать фрагменты ДНК 250-2500 т.п.о. tel – теломерные последовательности нуклеотидов; ars –
- 25. Введение рекомбинантных ДНК в клетки Трансформация – процесс поглощения экзогенной ДНК бактериальными клетками. Трансфекция – образование
- 26. Виды трансформации Тепловой шок Клетки, предварительно обработанные раствором CaCl2, выдерживают 2 мин при 42°С, а затем
- 27. Идентификация клеток-реципиентов со встроенным геном-мишенью
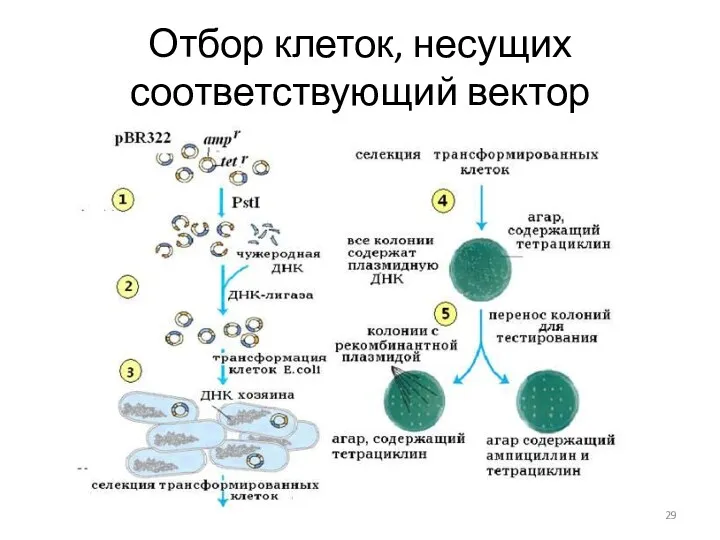
- 28. Отбор проводится в 2 этапа Отбор клеток, несущих соответствующий вектор Отбор клеток, несущих ген-мишень
- 29. Отбор клеток, несущих соответствующий вектор
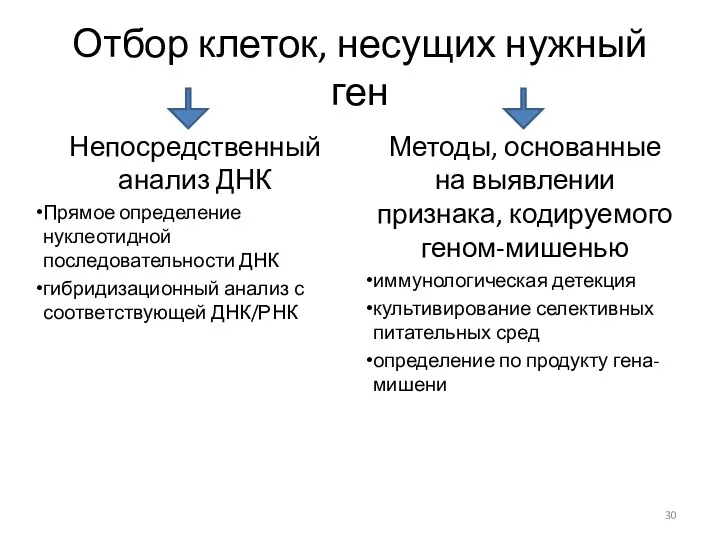
- 30. Отбор клеток, несущих нужный ген Непосредственный анализ ДНК Прямое определение нуклеотидной последовательности ДНК гибридизационный анализ с
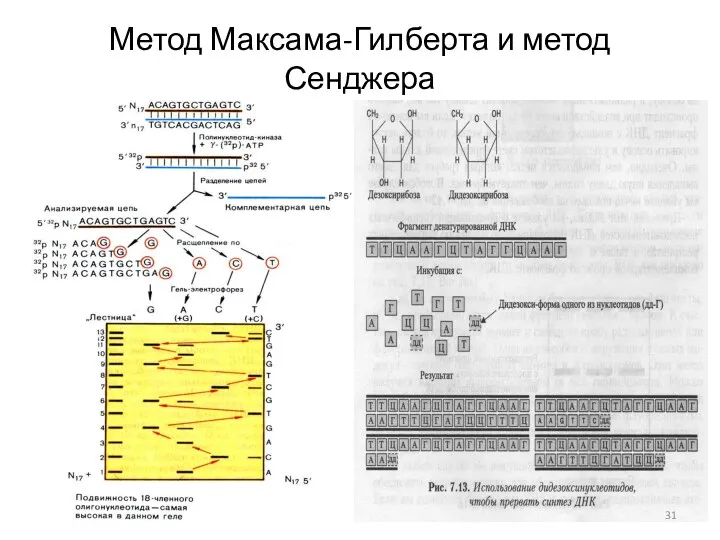
- 31. Метод Максама-Гилберта и метод Сенджера
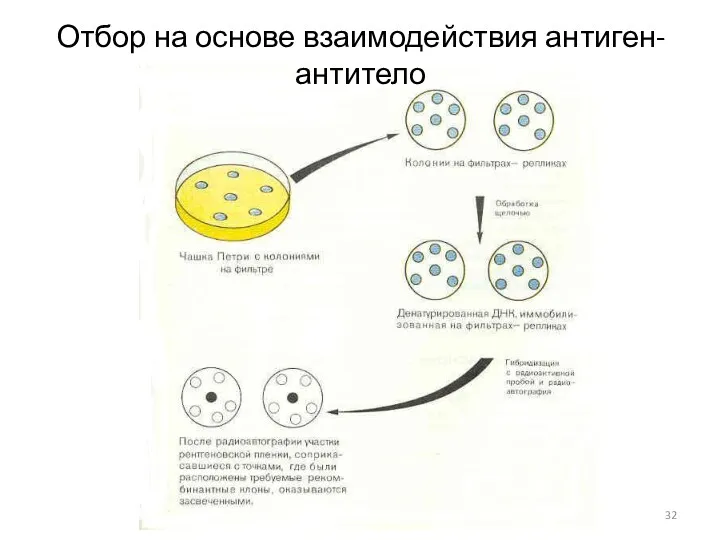
- 32. Отбор на основе взаимодействия антиген-антитело
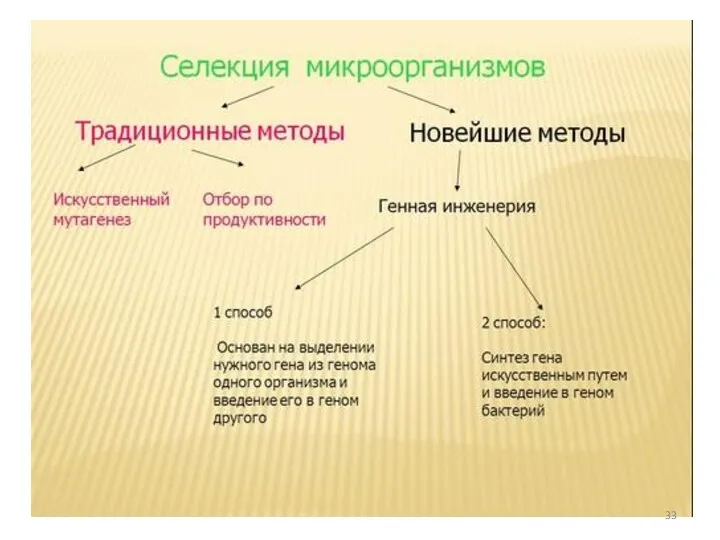
- 34. Классификация метаболитов 1. Молекулы с большой, до нескольких миллионов, молекулярной массой (ферменты и полисахариды). 2. Первичные
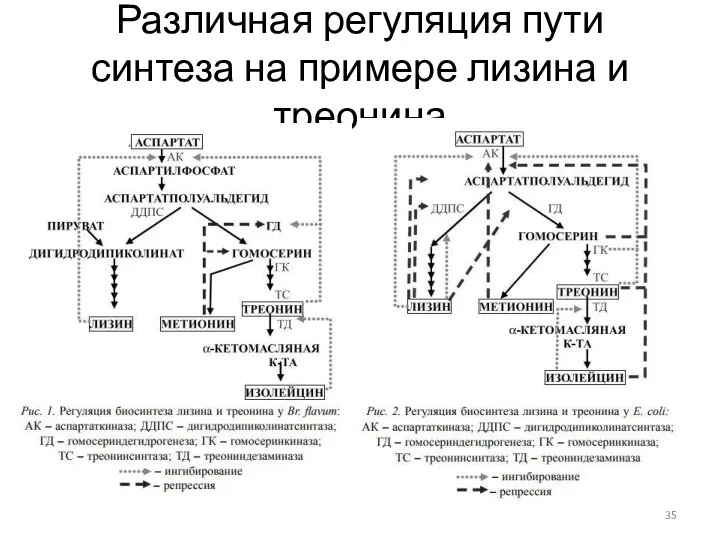
- 35. Различная регуляция пути синтеза на примере лизина и треонина
- 36. Выбор исходного штамма Выбор исходного штамма зависит: 1) от природных свойств штамма; 2) от ограничений, связанных
- 37. Требования, предъявляемые к промышленным штаммам Штаммы микроорганизмов, используемые в производстве, должны отвечать некоторым промышленным стандартам, а
- 39. Скачать презентацию















 Охрана животных. Окружающий мир. (3 класс)
Охрана животных. Окружающий мир. (3 класс) Класс Амфибии
Класс Амфибии Презентация по биологии 8 класс темы Внутренняя среда организма
Презентация по биологии 8 класс темы Внутренняя среда организма Половое размножение животных
Половое размножение животных Скелетные ткани. Хрящевая ткань
Скелетные ткани. Хрящевая ткань Орхидеи. Виды орхидеи
Орхидеи. Виды орхидеи Ненаследственная изменчивость.11 класс
Ненаследственная изменчивость.11 класс Происхождение и многообразие пресмыкающихся
Происхождение и многообразие пресмыкающихся Сенсорные системы. Общая характеристика сенсорных рецепторов. Зрительная система
Сенсорные системы. Общая характеристика сенсорных рецепторов. Зрительная система 35.Толстая и тонкая кишка
35.Толстая и тонкая кишка Перелётные птицы России
Перелётные птицы России Нехромосомное наследование
Нехромосомное наследование Загальні прийоми вирощування провідних декоративних культур у захищеному грунті. Гортензія, цикламен, фрезія, азалія, примула
Загальні прийоми вирощування провідних декоративних культур у захищеному грунті. Гортензія, цикламен, фрезія, азалія, примула Бактерії
Бактерії Красная книга Архангельской области
Красная книга Архангельской области Общая характеристика грибов (5-6 классы)
Общая характеристика грибов (5-6 классы) Біологічні небезпеки
Біологічні небезпеки Раздел анатомии спланхнология. (Лекция 1)
Раздел анатомии спланхнология. (Лекция 1) Хромосомная теория наследственности
Хромосомная теория наследственности Cattle breeds
Cattle breeds Биохимия крови
Биохимия крови Осуществление закупок масличного сырья на условиях барьерной компании
Осуществление закупок масличного сырья на условиях барьерной компании Влияние алкоголя на организм
Влияние алкоголя на организм Лікарські рослини - поряд
Лікарські рослини - поряд Общая характеристика грибов
Общая характеристика грибов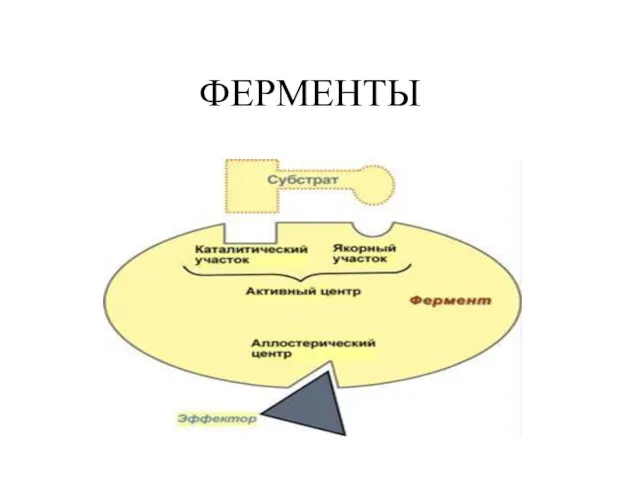 Ферменты. Значение ферментов
Ферменты. Значение ферментов Условия, необходимые для прорастания семян
Условия, необходимые для прорастания семян Красная книга Тверской области
Красная книга Тверской области